3 professionals
Coup d’oeil du congrès ESPD 2022
Coup d’oeil du congrès ESPD 2022
Améliorez vos connaissances professionnelles en profitant de nombreux services exclusifs dans le domaine de la dermatologie : plus de 500 visuels de pathologies, des cas cliniques, des vidéos d’experts…
Bénéficiez d’options uniques telles que l’offre de contenus audio et de supports à proposer à vos patients.
Restez informé(e) des événements et des webinaires à venir, des dernières publications scientifiques et des innovations produit.
Vous avez déjà un compte ? Se connecter
Comptes-rendus rédigés Dr Nives PUSTISEK (Pédiatre Dermatologue, Croatie), Prof. Ivelina YORDANOVA (Dermatologue, Bulgarie) and Dr. Rémi MAGHIA (Dermatologue, France)
Sujets liés
Chers collègues,
Je suis heureuse et honorée de participer au premier congrès de l’ESPD en personne depuis la pandémie. Nous avons tous accepté d’utiliser des plateformes de vidéo pendant cette période, cependant, le contact en personne et les discussions de vive voix sont les plus adaptés pour partager efficacement les connaissances et renforcer les relations entre les collègues. Ceci étant dit, je me félicite de l’organisation de cet excellent programme scientifique qui nous a permis de rencontrer nos collègues pendant le congrès de l’ESPD à Munich cette année. Comme vous le savez, ce programme s’est déroulé en deux sessions parallèles. Veuillez trouver ci-dessous plusieurs résumés de conférences très intéressantes.
Orateurs : Antonio Torrelo, Milos Nikolic, Henning Hamm
Comptes-rendus rédigés par Dr Nives PUSTISEK
D’après une présentation du Pr Antonio Torrelo (Espagne)
La conférence a débuté par la classification des maladies auto-inflammatoires (Dilan Dissanyake, Congrès SPD 2021, Toronto) : inflammasomopathie, interféronopathie, NF-κBopathie. Chaque groupe présente certaines caractéristiques cliniques communes et des phénotypes et options thérapeutiques variables. Les inflammasomopathies constituentun groupe hétérogène de maladies génétiques avec des profils variables de cytokines (IL-1ß, IL-18, IL-36). On les appelle les maladies auto-inflammatoires induites par IL-1. Les caractéristiques cliniques de l’inflammasomopathie comprennent de la fièvre, une atteinte des organes (douleurs abdominales, éruption cutanée sans vascularite, uvéite, arthrite), des concentrations élevées de globules blancs/neutrophiles et des marqueurs inflammatoires très élevés. Ce groupe est associé à des phénotypes variables (urticarien, oedémateux, pustulaire, neutrophilique, psoriasiforme et autres) et à des signes systémiques variables. Ce traitement comprend l’inhibition d’IL-1 (anakinra, rilonacept, canakinumab), l’inhibition d’IL-18 (tadekinig-alfa-IL-18BP) et d’IL-36 (spésolimab). Des rapports de cas très intéressants ont été présentés tels que les syndromes périodiquesassociés à la cryopyrine (CAPS ; identification des changements des agents pathogènes par NLRP3) et la déficience de l’antagoniste du récepteur d’IL-36 (DITRA). Les caractéristiques cliniques des interféronopathies comprennent de la fièvre, une atteinte des organes (éruptions cutanées sans vascularite, pneumopathie interstitielle etcalcifications intracrâniennes), les marqueurs inflammatoires peuvent ne pas être aussi élevés, des auto-anticorps peuvent être présents. Elles sont traitées par des inhibiteurs de JAK. Dans ce groupe de patients, des cas intéressants ont également été présentés avec une liste des principales interféronopathies monogéniques et des caractéristiques cutanées. Les caractéristiques cliniques de la NF-κBopathie comprennent de la fièvre, une atteinte très variable des organes (ulcération buccale/GI/GU, granulomes).
En conclusion, on peut soupçonner une maladie auto-inflammatoire lorsqu’on se trouve en présence d’une fièvre périodique non infectieuse et de lésions cutanées ; de lésions cutanées induites par des facteurs déclencheurs courants ; d’une apparition précoce de maladie du tissu conjonctif ; d’une panniculite récidivante chez le jeune enfant ; d’une vascularite cutanée et de signes systémiques ; de lésions cutanées inattendues et de signes systémiques ; d’une maladie cutanée inflammatoire avec des anomalies minimes dans les analyses biologiques ; d’un trouble sévère et imprévisible de la kératinisation ; de lésions cutanées chez l’enfant en bas âge avec prédominance des neutrophiles ; de lésions cutanées inhabituelles ainsi que d’une immunodéficience et de cytopénies. Avoir un doute sur l’identité de la maladie est un autre indicateur de sa nature auto-inflammatoire. Il existe environ 50 maladies auto-inflammatoires bien caractérisées. Pourtant, seuls 50 % environ des patients atteints d’une maladie auto-inflammatoire possèdent un gène qui en est responsable.
D’après une présentation du Pr Milos Nikolic (Serbie)
D’après une présentation du Pr Milos Nikolic (Serbie)
La dermatomyosite juvénile (DMJ) est une maladie auto-immune systémique rare et grave avec une vasculopathie provoquant l’occlusion des petits vaisseaux. C’est lamyopathie inflammatoire idiopathique juvénile la plus fréquente qui affecte la peau, le muscle squelettique, les articulations, l’appareil gastro-intestinal, le cœur et les poumons. Certains patients (1 à 5 %) sont atteints de DMJ amyopathique (parmi lesquels 25 % présentent une DMJ manifeste). 1/3 des patients présentent une évolution monocyclique aiguë (jusqu’à 2 ans), ¼ sont atteints d’une maladie polycyclique. Plus de 50 % souffrent d’une maladie chronique continue malgré le traitement. Même après 16 ans d’évolution, plus de 50 % des patients atteints de DMJ présentent encore une maladie active (modifications des capillaires du pli unguéal, éruption cutanée et autres symptômes). Avant l’avènement des stéroïdes, 1/3 des patients mouraient, 1/3 souffraient d’un handicap important et 1/3 récupéraient complètement de la maladie. Aujourd’hui, la mortalité est légèrement supérieure à 2 %. La DMJ n’est généralement pas paranéoplasique. Des cas paranéoplasiques très rares ont été présentés dans la littérature. L’incidence est de 1 à4/1 000 000 d’enfants/an, avec un rapport filles/garçons de 3:1. L’étiopathogenèse est complexe, il y a un dysfonctionnement immunologique (patrimoine génétique) et des stimuli environnementaux/facteurs déclencheurs (infection, médicaments, lumière UV, etc.). Certains anticorps présentent la même association chez l’adulte : anti-PM-Scl (points communs avec la sclérodermie), anti-Mi-2 (éruption cutanée classique, atteinte moins grave des muscles, risque moins important de pneumonie interstitielle, bonne réponse au traitement) et ant-Jo-1 (pneumopathie interstitielle). Certains anticorps sont associés à une forme bénigne de la maladie comme les anti-MDAS et les anti-SAE. Les anti-Ro (SSA) sont associés à un pronostic défavorable. Les nouveaux critères 2017 de la classification des myopathies inflammatoires adulte et juvénile ont été présentés. La deuxième partie de la présentation a porté sur des patients atteints de DMJ dans le service de dermatologie de Belgrade entre 1990 et 2021, avec une présentation clinique, l’évolution de la maladie et la complexité des options thérapeutiques.
D’après une présentation du Pr Henning Hamm (Allemagne)
Le psoriasis pédiatrique est une maladie inflammatoire systémique à médiation immunitaire. La maladie se déclare avant l’âge de 20 ans chez 30 % des patients. La prévalence chez les enfants et adolescents européens est de 0,5 à 1 %. Le psoriasis pédiatrique présente une forte prédisposition génétique, en particulier en ce qui concerne le locus PSORS1 et l’allèle HLA-Cw6. La pathogenèse est très complexe, les kératinocytes sont stimulés par des cytokines pro-inflammatoires (lymphocytes T : IL-17A, IL 6, IL8,TNFα ; cellules dendritiques : IL-1ß, IL-12, IL-23, THFα). Le psoriasis pédiatrique est associé à de nombreuses comorbidités (métaboliques, cardiovasculaires, articulaires, gastro-intestinales et psychologiques, la plus importante étant l’obésité). Il influe fortement sur la qualité de vie du patient ainsi que sur la qualité de vie des parents et de la famille. Un traitement systémique est indiqué en cas de psoriasis modéré à sévère défini par un indice de sévérité et de surface du psoriasis (PASI) ≥ 10, une surface corporelle(BSA) ≥ 10, un indice de qualité de vie en dermatologie pour enfants (CDLQI) ou un indice de qualité de vie en dermatologie (DLQI) ≥ 16 ans ≥10 ; une atteinte prédominante des sites sensibles (cuir chevelu, visage, paumes des mains, plantes des pieds, ongles, région génitale et surfaces intertrigineuses) qui n’est pas suffisamment prise en compte dans le PASI et le BSA. Cinq agents biologiques ont été approuvés pour le psoriasis pédiatrique (étanercept, adalimumab, ustékinumab, ixékinumab, scukunumab). La version actualisée des directives allemandes de 2021 et les critères diagnostiques pour le psoriasis pédiatrique ont également été présentés. La présentation clinique et le traitement du type annulaire du psoriasis pustuleux généralisé ont également été décrits. La « dermatite psoriasique » est une maladie qui présente des points communs avec le psoriasis et la dermatite atopique. La dermatite psoriasiforme associée à un traitement par dupilumab et le psoriasis paradoxal (lésions psoriasiformes induites par des médicaments biologiques, essentiellement des inhibiteurs de TNF-alpha) ont été présentés.
Orateurs : Pr May El Hachem, Pr Stephanie Christen-Zäch, Pr Antonella Muraro
Comptes-rendus rédigés par Dr Nives PUSTISEK
D’après une présentation du Pr May El Hachem (Italie)
La photosensibilité est une réaction anormale à l’exposition au soleil ou à une source de lumière artificielle, avec des manifestations variables sous la forme d’éruptions cutanées et de prurit. La présentation comprenait une classification de la photosensibilité : photosensibilité primaire (lucite polymorphe, prurigo actinique, photodermatose printanière juvénile, urticaire solaire, hydroa vacciniforme), due à des agents exogènes (d’origine médicamenteuse, phytophotodermatose), maladies du tissu conjonctif (lupus érythémateux néonatal, lupus érythémateux systémique, dermatomyosite juvénile), dermatoses photoaggravées (herpès simplex, psoriasis, dermatite atopique, lichen, maladie de Darier),différents troubles métaboliques (protoporphyrie érythropoïétique, porphyrie érythropoïétique congénitale et autres) et génodermatoses (trichothiodystrophie, xeroderma pigmentosum, syndrome de Rothmund-Thomson, épidermolyse bulleuse de Kindler et autres). Des rapports de cas intéressants ont permis de présenter différents troubles de la photosensibilité avec les diagnostics différentiels, le diagnostic et le traitement associés. L’investigation diagnostique comprend les antécédents cliniques et familiaux (date d’apparition des lésions, relation avec l’exposition au soleil, évolution, hypothèse d’une origine médicamenteuse ou de l’utilisation d’un produit topique, troubles associés, antécédents familiaux (génodermatoses, maladies du tissu conjonctif, etc.), un examen clinique, des analyses biologiques (en fonction de l’hypothèse de diagnostic clinique), des phototests (dans certains cas), une biopsie cutanée et d’autres examens.
En conclusion, la photosensibilité est présente dans plusieurs troubles, elle peut exacerber de nombreuses maladies courantes. Il faut rechercher les antécédents cliniques aigus et effectuer des analyses. Un traitement précoce doit être instauré pour éviter les complications et garantir l’utilisation du traitement approprié. Il faut toujours envisager un diagnostic différentiel. La prise en charge du diagnostic dépend de l’hypothèse du diagnostic clinique. Une prise en charge pluridisciplinaire est souvent nécessaire.
D’après une présentation du Pr Stephanie Christen-Zäch (Suisse)
Étiologie de l’urticaire et de l’angioedème : infections allergiques (aliments, médicaments, allergènes de contact, aéroallergènes), pseudo-allergiques (aspirine, AINS, additifs alimentaires, anesthésie locale, agents de radiocontraste), physiques (mécaniques, lumière, froid/chaleur), toxiques (insectes, végétaux, méduses, substances chimiques), cholinergiques (pendant un effort), endogènes (auto-immunes, auto-inflammatoires, hématologiques) et idiopathiques. Si un patient se présente avec un angioedème sans urticaire, il pourrait s’agir d’une déficience en inhibiteur de la C1 estérase, en inhibiteurs de l’enzyme de conversion de l’angiotensine, d’un angioedème héréditaire (avec médiation par la bradykinine). La présentation clinique de l’urticaire peut avoir une forme classique, en cas d’urticaire figurée, de dermographisme, de papules urticariennes (urticaire cholinergique), d’urticaire géante (chez les bébés, ressemble à un hématome, souvent située sur les mains et les pieds). La vascularite urticarienne, les réactions de la maladie sérique, l’œdème aigu hémorragique du nourrisson, la mastocytose cutanée maculopapuleuse, les syndromes auto-inflammatoires et l’angioedème sans médiation mastocytaire peuvent se manifester sous la forme de papules ou d’angioedème, mais ne sont pas considérés comme des sous-types d’urticaire, car ils présentent des mécanismes physiopathologiques différents. Classification de l’urticaire : urticaire aiguë (inférieure à 6 semaines), urticaire chronique (supérieure à 6 semaines), urticaire spontanée (pas de facteur déclencheur spécifique impliqué) et urticaire inductible (facteur déclencheur spécifique impliqué). Les sous-types de l’urticaire chronique peuvent être l’urticaire chronique spontanée (UCS) et l’urticaire chronique inductible (physique ou d’une autre nature). Dans la plupart des cas, la durée estimée de l’UCS est comprise entre 1et 5 ans. Lors de l’investigation diagnostique de l’urticaire, il n’est pas nécessaire de réaliser un programme de dépistage général intensif et coûteux ni de rechercher tous les facteurs responsables possibles chez l’ensemble des patients. Le plus important concerne les antécédents du patient, l’examen physique et chez certains patients, au besoin, des tests diagnostiques approfondis appropriés (se reporter à l’algorithme diagnostique pour l’urticaire chronique [Allergy 2018]). Lors de la dernière partie de la conférence, l’algorithme de traitement pour l’urticaire conforme aux directives de l’EAACI/GA2LEN/EDF/WAO (Allergy, 2018) et l’influence importante de l’urticaire chronique sur la qualité de vie ont été présentés.
D’après une présentation du Pr Antonella Muraro (Italie)
La conférence a présenté le lien entre les allergies alimentaires et la dermatite atopique (une progression en parallèle ?), ainsi que la physiopathologie : la sensibilisation épicutanée et l’investigation diagnostique des allergies alimentaires dans la dermatite atopique et les stratégies de prévention. Les allergies alimentaires et la dermatite atopique semblent étroitement associées. Toutes deux représentent un fardeau pour la santé publique avec des conséquences psychosociales importantes sur les enfants et leur famille. Chez les enfants de moins de 6 ans atteints de dermatite atopique bénigne, une investigation diagnostique pour les allergies alimentaires peut se justifier s’il existe des antécédents de réaction immédiate à certains aliments. Dans le cas de la dermatite atopique modérée, si la réponse à un traitement local adéquat est faible ou s’il existe des antécédents de réaction immédiate à certains aliments. L’introduction des œufs et des arachides très tôt, chez les bébés de 4 à 6 mois semble éviter les allergies alimentaires, en particulier chez les enfants à haut risque présentant une dermatite atopique bénigne et dans les pays avec une prévalence élevée de l’allergie aux arachides. Optimiser les soinsde la peau est fondamental pour parvenir à un bon contrôle des allergies alimentaires et sans doute, pour éviter une sensibilisation supplémentaire. Des découvertes récentes sur les endotypes et le variant ILRA étayent encore davantage la double hypothèse de sensibilisation comparée à la tolérance et sont en faveur de l’utilisation de médicaments biologiques actifs sur les voies TH2 de l’inflammation allergique pour réduire les allergies alimentaires et la dermatite atopique. En conclusion, l’objectif final est de modifier les antécédents naturels d’allergies alimentaires et de dermatite atopique en prévenant la progression de la maladie allergique, c’est-à-dire la « marche atopique ».
Orateurs : Dirk van Gysel, Klara Martinaskova, Regina Fölster-Holst
Comptes-rendus rédigés par Dr Nives PUSTISEK
D’après une présentation du Pr Dirk van Gysel (Belgique)
La définition et la classification des exanthèmes ont été présentées pendant l’introduction. Les exanthèmes sont des dermatoses mucocutanées aiguës associées à un érythème(vasodilatation), à de l’urticaire (œdème, extravasation), à des papules (infiltrat cellulaire) et à un purpura (lésion de la paroi des vaisseaux sanguins). Les exanthèmes peuvent être viraux (rougeole, rubéole, érythème infectieux, exanthème subit, varicelle, infection à entérovirus, infection à adénovirus, infection à EBV, syndrome pied-main-bouche),bactériens (impétigo, épidermolyse staphylococcique aiguë, scarlatine, septicémie à méningocoque, fièvre pourprée des montagnes Rocheuses) et de différents types (syndrome de Gianotti-Crosti, maladie de Kawasaki, exanthème périflexural asymétrique de l’enfant, érythème exsudatif multiforme – syndrome de Stevens-Johnson). Pendant la conférence, de très bonnes photos et des rapports de cas d’anciens exanthèmes (présentation classique et présentation atypique/nouvelle) et de nouveaux exanthèmes (provoqués par de nouveaux virus et dus à des mouvements vectoriels et de la population) ont été présentés. Par exemple, la rougeole peut se présenter sous la forme d’une rougeole classique, d’une rougeole atypique, d’une rougeole atténuée 6 jours après la vaccination et d’une rougeole modifiée après 2 doses antérieures de vaccin ROR. La varicelle est un exanthème viral très courant provoqué par le virus varicelle-zona (HHV-3) qui peut se compliquer d’une varicelle hémorragique et d’une surinfection bactérienne. Le zona est une réactivation du virus varicelle-zona qui se caractérise par une phase pré-éruptive, une phase éruptive aiguë et une phase chronique. Dans un zona, le signe de Hutchinson se manifeste par des lésions cutanées au bout, sur le côté et à la racine du nez, ce qui correspond aux dermatomes des branches nasale externe et infratrochléaire du nerf nasociliaire. Le signe de Hutchinson est associé à une augmentation de la probabilité de complications oculaires liées à l’infection. Le syndrome de Ramsay-Hunt (herpeszoster oticus) est une réactivation du virus varicelle-zona qui touche le nerf facial et le nerf vestibulocochléaire. Les exanthèmes associés à une mononucléose infectieuse peuvent exister sous 3 formes : maculopapulaire (chez le jeune enfant), éruptions morbilliformes (associées à des antibiotiques, ampicilline ou amoxicilline), et syndrome de Gianotti-Crosti. Les présentations cliniques de l’exanthème périfléxural asymétrique de l’enfant, des manifestations cutanées associées au virus d’Epstein-Barr, du syndrome pied-main-bouche, et du syndrome papulo-purpurique en gants et chaussettes ont été décrites. Enfin, les manifestations cutanées de la COVID-19 (COVID 19 aiguë, lésions cutanées induites par le vaccin contre la COVID-19) et les maladies liées aux voyages (dermatoses d’importation) ont été présentées.
En conclusion, différents agents (virus, médicaments, etc.) peuvent provoquer une éruption similaire et un même agent (virus, médicaments, etc.) peut induire des éruptions différentes. Le tableau clinique est souvent clair. Dans certains cas, une approche systématique est nécessaire pour parvenir au diagnostic exact. L’approche diagnostique dans le cas des exanthèmes viraux comprend les antécédents (âge, saison, prise de médicaments, poussées, phase prodromique, fièvre, autres plaintes ou symptômes, dates et destinations de voyage), un examen physique puis des analyses techniques et de laboratoire.
D’après une présentation du Pr Klara Martinaskova (Slovaquie)
Chez les enfants, les exanthèmes sont extrêmement fréquents et leurs manifestations s’étendent des maladies bénignes aux maladies sévères. Un exanthème se définit comme une éruption cutanée qui peut être associée à des lésions des muqueuses (énanthème), à de la fièvre ou à d’autres symptômes. L’exanthème peut être une manifestation d’une maladie infectieuse ou une réaction indésirable à des médicaments. Le risque de gravité de l’exanthème peut être associé à une immunodéficience primaire ou secondaire, des troubles génétiques, des tumeurs, un traitement immunosuppresseur, une co-infection, un syndrome post-COVID. Il existe une co-infection lorsque dans certains cas, à la même période, on détecte plusieurs agents pathogènes. Certains auteurs distinguent les infections concomitantes/co-infections des surinfections. Une co-infection se produit en même temps que l’infection initiale tandis qu’une surinfection succède à une infection antérieure. Des cas de co-infections du syndrome pied-main-bouche avec un adénovirus, de co-infections par le parvovirus B19 et Mycoplasma pneumoniae, de co-infections par l’entérovirus B6, Mycoplasma pneumoniae et le parvovirus B19 chez une fillette de 10 ans immunodéprimée et d’autres cas ont été présentés ainsi que d’autres rapports de cas concernant des infections virales avec une COVID-19.
D’après une présentation du Pr Regina Fölster-Holst (Allemagne)
L’exanthème paraviral est un exanthème qui se distingue cliniquement. On soupçonne une infection virale, mais il n’y a pas d’effet cytopathogène direct lié au virus. L’exanthème paraviral reflète simplement la réponse immunitaire de l’hôte. Il existe plusieurs exanthèmes paraviraux, dont quelques-uns seulement ont été présentés tels que le syndrome de Gianotti-Crosti, l’exanthème périfléxural asymétrique, le pityriasis rosé, le pityriasis lichénoïde, l’œdème aigu hémorragique du nourrisson, le syndrome papulo-purpurique engants et chaussettes (PPGS), la pseudoangiomatose éruptive et l’hypomélanose éruptive. Les critères diagnostiques comprennent la morphologie, la distribution, lesantécédents, l’état de santé général, l’histologie, les analyses sanguines et les frottis. De nombreux micro-organismes (virus et bactéries) et vaccinations (vaccin anti-hépatite B,vaccin anti-rougeole-oreillons-rubéole) peuvent être associés au syndrome de Gianotti-Crosti. Une réaction virale et une infection viscérale sont associées au syndrome d’hypersensibilité médicamenteuse (DRESS). Le titre d’anticorps viraux et la charge virale sont corrélés à la gravité du DRESS. Au moment de l’établissement du diagnostic, lestitres d’anticorps peuvent encore être négatifs et la charge virale peut ne pas présenter d’anomalies. Des diagnostics viraux doivent être réalisés pour les virus suivants : HHV-6,HHV-7, CMV, EBV. Un traitement antiviral est utile, mais seulement en association avec des corticostéroïdes systémiques. Des rapports de cas très intéressants concernant des exanthèmes paraviraux ont été présentés, comme le cas d’un DRESS infantile (Chow ML et al, 2018), d’un syndrome hémorragique de Gianotti-Crosti chez un nourrisson d’un mois et demi (Sarma N et al, 2013), d’une réaction de type syndrome de Gianotti-Crosti consécutive à un molluscum contagiosum (Estébanz A, 2020), d’une réaction du virus de l’herpès humain de types 6, 7 et du virus d’Epstein-Barr dans le pityriasis rosé pendant la COVID-19 (2021) et d’un exanthème médiothoracique unilatéral (Chuh A et al, 2016).Différentes présentations cliniques d’une infection à parvovirus B19 ont été décrites : Érythème infectieux (cause unique), PPGS (peut être provoqué par le parvovirus B19, EBV,CMV, HHV6, Coxsackie B6, hépatite B), exanthème pétéchial dans une distribution « en maillot de bain » provoquée par une infection à parvovirus B19 (Huerta-Brogeras M etal).
Enfin, des exanthèmes paraviraux très intéressants récemment décrits ont été présentés : L’association d’une pseudoangiomatose éruptive avec des écho- et des adénovirus (Acta Derm Venerology, 2017), une angiomatose éruptive déclenchée par la vaccination contre la COVID 19 (Shanshai et al, 2022) et une hypomélanose éruptive (éruption de macules hypopigmentées dans une fratrie, Chuh, 2016 ; premier cas d’hypomélanose éruptive signalé hors d’Asie, Donne M et al, 2018).
J’aimerais terminer par une excellente conférence dans le domaine de la psychodermatologie.
Orateur : Uwe Gieler
Comptes-rendus rédigés par Dr Nives PUSTISEK
D’après une présentation du Pr Uwe Gieler (Allemagne)
Les troubles de l’arrachage de la peau peuvent s’expliquer par une auto-infliction associée à un comportement obsessionnel ou impulsif. Les symptômes cutanés sont visibles et manifestes. Le patient est conscient de son comportement et accepte d’en parler. Il n’y a pas de sensations au niveau de la peau (arrachage sans symptômes). Le patient a essayé plusieurs fois de modifier son comportement. Des sentiments de honte et de dégoût sont présents. Les lésions cutanées sont essentiellement localisées sur le visage, les bras et la tête. Les critères diagnostiques pour le trouble de l’excoriation (arrachage de la peau) figurent dans le DSM-V (Mai 2013). Les troubles de l’arrachage de la peau comprennent l’excoriation iatrogène, l’onychophagie, l’onychotillomanie, la trichotillomanie, la trichtériromanie, le fait de se curer le nez et les oreilles, de se mordre les joues (morsicatio buccarum), de se mordre les lèvres ou d’arracher les peaux des lèvres, ou encore de faire craquer ses articulations. Il est important de distinguer l’arrachage de la peau d’une pathomimie. La pathomimie reste le plus souvent secrète, le patient ne nous parle pas de la manipulation de sa peau. Le problème de l’arrachage de la peau n’est pas un secret, vous pouvez toujours interroger vos patients qui essayent de mettre fin à ce comportement. La prévalence de l’arrachage de la peau est voisine de 5,4 %. L’arrachage de la peau peut être compulsif ou impulsif. Il convient de les distinguer en raison d’options thérapeutiques différentes. Lorsque l’arrachage de la peau est impulsif, il est important de clarifier le comportement impulsif (journal), les compétences et l’arrêt de l’arrachage impulsif, tandis que dans le cas d’un arrachage de la peau obsessionnel compulsif, il faut clarifier le comportement obsessionnel compulsif (journal), et réduire l’arrachage de la peau par autonomisation positive. Les traitements pratiques pour lutter contre l’arrachage de la peau consistent par exemple à occuper ses mains avec autre chose jusqu’à ce que l’envie irrépressible cesse ou de mettre des gants ; lorsque l’on est tenté d’arracher la peau, à prendre soin de sa peau à la place (par exemple en appliquant une crème hydratante) ; à essayer de différer le besoin de plus en plus longtemps à chaque fois si l’on n’est pas en mesure d’y résister ; à maintenir la peau propre pour éviter les infections ; à rester occupé ; à se débarrasser des pinces, épingles et de tout autre instrument que l’on pourrait être tenté d’utiliser ; à essayer de serrer une balle souple ou de jouer avec de la gomme adhésive à la place. Au début du traitement, décrivez l’arrachage de la peau comme un comportement obsessionnel compulsif ou impulsif et ne donnez pas de conseils simplistes comme « Cessez ce comportement ». Des techniques d’inversion des habitudes et plusieurs sites Internet de traitements en ligne pour l’arrachage de la peau ont été présentés.
Orateur : Pr Rudolf Happle
Comptes-rendus rédigés par Pr Ivelina YORDANOVA
Le 20 mai 2022, après 2 ans de pandémie, la ravissante ville cosmopolite de Munich, située au cœur de la Bavière, a accueilli un événement remarquable : le 21e congrès de l’Association européenne de dermatologie pédiatrique.
L’événement a été officiellement inauguré par la présidente de l’association, le professeur Veronica Kinsler, et le professeur Andreas Wollenberg, président du comité d’organisation local de l’événement à Munich.
Un beau programme en perspective avec 6 conférences plénières et 16 sessions thématiques, animées par les plus grands experts mondiaux en dermatologie pédiatrique.
Pour donner le coup d’envoi de cette rencontre scientifique, la première des six conférences plénières était présentée par le brillant professeur Rudolf Happle, qui a choisi de commencer par aborder le thème du mosaïcisme.
Au cours de son exposé, le professeur Happle a proposé une nouvelle catégorie de mosaïcisme segmentaire cutané : le mosaïcisme monoclonal biallélique segmentaire isolé. Il a indiqué que différentes formes de mosaïcisme cutané ont été identifiées selon des traits autosomiques dominants et caractérisés par des tumeurs cutanées multiples telles que la neurofibromatose 1 ou la cylindromatose, entre autres. Les lésions disséminées proviennent de nombreux événements postzygotiques distincts de perte d’hétérozygotie. Dans le cas du mosaïcisme segmentaire simple, une nouvelle mutation postzygotique très précoce donne naissance à une zone segmentaire qui, en raison de différents facteurs secondaires, développera ultérieurement de multiples tumeurs bialléliques. Durant sa présentation, le professeur Happle a mis l’accent sur une autre catégorie inhabituelle de mosaïcisme biallélique segmentaire, liée aux troubles cutanés autosomiques dominants, dans lesquels les lésions se développent à la suite de deux mutations précoces impliquant les deux allèles d’un gène donné. Cette nouvelle catégorie apparaît toujours de manière sporadique. Le professeur Happle et le professeur Torello proposent de la baptiser « mosaïcisme monoclonal biallélique segmentaire isolé ». Le cas du neurofibrome isolé de grande taille, généralement de type plexiforme, en est un exemple éloquent. En général, des tumeurs volumineuses de ce type apparaissent chez des patients présentant des caractéristiques typiques de NF1 et sont donc considérées comme la manifestation d’un mosaïcisme superposé. Cependant, il existe de nombreux rapports concernant des neurofibromes sporadiques de grande taille sans aucune autre lésiondisséminée de NF1, tels que des neurofibromes ordinaires, des macules café au lait ou des taches de rousseur axillaires, en l’absence de toute caractéristique de NF1 chez les membres de la famille. Jusqu’à présent, il était difficile d’expliquer l’apparition sporadique de ces neurofibromes isolés de grande taille. Selon le professeur Happle, ces cas pourraient être le reflet d’un mosaïcisme segmentaire monoclonal isolé à deux foyers. À un stade précoce du développement, une mutation postzygotique de la NF1 peut être rapidement suivie d’un second événement mutationnel impliquant le même clone cellulaire. Il est important de comprendre que le deuxième événement mutationnel postzygotique, qui entraîne la perte de l’allèle de type sauvage correspondant, doit avoir eu lieu avant ou autour de l’implantation du blastocyste. Dans le cas contraire, une manifestation segmentaire ne serait plus possible, comme on peut le déduire de schémas mosaïques analogues reflétant l’inactivation de X. Le professeur Happle insiste sur lecaractère monoclonal du deuxième trait, qui contraste avec le mosaïcisme segmentaire simple des troubles cutanés bialléliques tels que la neurofibromatose, où les lésions cliniques ont tendance à provenir de nombreux traits secondaires différents et dérivent donc de clones cellulaires différents. Il faut également distinguer cette nouvelle catégorie du mosaïcisme segmentaire simple des troubles cutanés monoalléliques tels que l’ichtyose kératinopathique de Brocq et Siemens, où les cellules mutantes affectées ne sont porteuses que d’un seul trait. En outre, le mosaïcisme gonadosomatique ne peut être exclu dans les deux autres catégories. Le professeur Happle a indiqué que ces patients couraient le risque de donner naissance à un enfant atteint d’une ichtyose kératinopathique de Siemens à part entière, en raison de la possibilité d’un mosaïcisme gonadosomatique. Il a également présenté deux cas similaires rares de maladie de Hailey-Hailey à début infantile segmentaire et de nævus épidermoïde acantholytique et kératodermie palmoplantaire, comme exemples de mosaïcisme superposé.
Orateur : Flora B. de Waard-van der Spek
Comptes-rendus rédigés par Pr Ivelina YORDANOVA
Le Dr Flora B. de Waard-van der Spek est consultante en dermatologie pédiatrique au département de dermatologie du centre médical universitaire Erasmus de Rotterdam et du Kinder Haven Havenziekenhuis, à Rotterdam (Pays-Bas). Elle est présidente du groupe de travail de l’EAACI (Académie européenne d’allergie et d’immunologie clinique) sur la dermatite allergique de contact chez l’enfant et présidente de la société néerlandaise de dermatologie pédiatrique.
Le Dr de Waard-van der Spek a déclaré que la dermatite allergique de contact (DAC) chez l’enfant est en augmentation ces dernières années. Il est très important de comprendre que la DAC n’est pas rare chez les jeunes enfants et qu’elle doit toujours être envisagée dans en cas d’eczéma réfractaire. Elle a ajouté que la sensibilisation aux allergènes de contact pouvait apparaître dès la petite enfance, lorsque la barrière épidermique joue un rôle crucial dans le développement de la sensibilisation et l’apparition de la DAC. Les facteurs pouvant jouer sur l’apparition de la sensibilisation chez l’enfant sont la dermatite atopique, les dysfonctionnements de la barrière cutanée et le contact intense ou répété avec des allergènes. Une dermatite allergique de contact due à des haptènes présents dans les chaussures ou les protège-tibias doit être envisagée en cas d’éruptions persistantes des pieds ou de dermatite bien délimitée sur la partie inférieure des jambes. Le polymorphisme clinique de la dermatite de contact liée aux vêtements peut complexifier le diagnostic de dermatite aux textiles. Les jouets sont une autre source potentielle d’exposition aux haptènes chez l’enfant, en particulier les produits cosmétiques pour enfants tels que le parfum, le rouge à lèvres et le fard à paupières. Les allergènes de contact les plus fréquents chez l’enfant sont les métaux, les parfums, les conservateurs, la néomycine, les produits chimiques à base de caoutchouc et, plus récemment, les colorants. Le Dr de Waard-van der Spek a donné des exemples de dermatite allergique de contact chez de jeunes enfants dont les mères utilisaient des émollients contenant du bisabolol et d’autres ingrédients naturels. Elle a cité un exemple tiré de sa propre expérience concernant le développement d’une dermatite allergique de contact à la paraphénylènediamine, utilisée dans les tatouages éphémères pour enfants. Elle a indiqué que ces tatouages éphémères pouvaient entraîner une dermatite allergique de contact chez l’enfant à long terme. C’est pourquoi, en tant que médecins, nous recommandons aux parents de ne pas autoriser les tatouages éphémères sur leurs enfants. Selon le Dr de Waard-van der Spek, si l’éruption cutanée persiste malgré un traitement approprié, un test épicutané doit toujours être effectué sur les enfants atteints de dermatite atopique. Il convient de soumettre ces derniers à un test épicutané portant sur une sélection d’allergènes présentant la plus forte proportion de réactions positives et pertinentes. Le profil d’exposition aux allergènes diffère selon les groupes d’âge et les adolescents peuvent également être exposés à des allergènes d’origine professionnelle.
En conclusion, le Dr de Waard-van der Spek a indiqué que le processus de diagnostic de l’eczéma chez l’enfant doit tenir compte des nombreux produits avec lesquels ces derniers sont en contact, et qui sont susceptibles de provoquer une dermatite de contact irritative ou allergique.
Orateurs : Dr Smail Hadj Rabia, Pr Judith Fischer, Dr Juliette Mazereeuw-Hautier
Comptes-rendus rédigés par Pr Ivelina YORDANOVA
Nous avons assisté à un état des lieux sur l’ichtyose lors d’une brillante session parallèle 3.
Présidée par le Dr Smail Hadj Rabia du service de dermatologie de l’hôpital Necker-Enfants malades, de Paris.
Au cours de cette session, le Pr Judith Fischer, directrice médicale de l’Institut de génétique humaine à l’université de Fribourg-en-Brisgau (Allemagne), a présenté la classification actuelle et les caractéristiques génétiques des différentes formes d’ichtyose syndromique et non syndromique. Elle a mis l’accent sur le phénotype et les caractéristiques cliniques de chaque maladie, le mode de transmission et les caractéristiques génétiques moléculaires, notamment les gènes affectés et leur fonction : mutations germinales (dans toutes les cellules du corps), mosaïcisme (mutations postzygotiques/somatiques) et combinaisons de ces deux dernières.

Le professeur Fischer a présenté deux nouveaux syndromes appartenant au groupe des ichtyoses syndromiques. Le syndrome SAM (syndrome d’activation macrophagique) se caractérise par une érythrodermie congénitale accompagnée d’une kératose palmoplantaire (striée, focale et diffuse), d’une hypotrichose et d’un taux élevé d’immunoglobuline E sérique. La transmission autosomique récessive (avec mutation biallélique de perte de fonction) et la transmission autosomique dominante avec mutation hétérozygote dans le domaine transmembranaire dugène DSG1 du syndrome SAM ont été établies. Dans le syndrome SAM autosomique récessif, le déficit en desmogléine 1 provoque une dermatite sévère, des allergies multiples et des troubles du métabolisme. Le professeur Fischer a présenté une méta-analyse des mutations des gènes ALOX12B et ALOXE3 identifiées dans une vaste cohorte de 224 patients atteints d’ichtyose, en 2021. Elle a souligné le rôle essentiel de la voie de synthèse des lipides dans la couche cornée et des mutations associées, en tant que fonction protectrice de la peau. En conclusion, le professeur Fischer a rappelé que d’ici 2022, plus de 50 phénotypes d’ichtyose seront connus et que la pathogenèse n’est toujours pas établie pour 15 % d’entre eux. On espère que la nouvelle technologie Whole-Genome-Sequencing (WGS), qui remplace la technologie WES, permettra l’identification génétique de mutations inconnues. Le professeur Fischer a rappelé la nécessité d’une nouvelle classification actualisée et intégrative de l’ichtyose, combinant caractéristiques cliniques et génétiques.
Après cette conférence consacrée à la génétique, le Dr Juliette Mazereeuw-Hautier, dermatologue à Paris, s’est intéressée aux principaux objectifs de la prise en charge des patients atteints d’ichtyose : amélioration des anomalies cutanées, soutien psychosocial, formation relative à la thérapie, conseils en matière de génétique et prévention des complications oculaires, auditives, douleurs et démangeaisons, infections cutanées et retards de développement physique, carence en vitamine D, anomalies des cheveux et des ongles, réactions excessives à la chaleur et au froid. Elle a présenté les recommandations européennes pour la prise en charge de l’ichtyose congénitale, publiées dans le British Journal of Dermatology en 2019, 180: 272-281. Elle a insisté sur le traitement conventionnel à base d’émollients, de kératolytiques, de corticoïdes topiques et systémiques, d’enveloppements humides dans les cas les plus sévères. Le Dr Mazereeuw-Hautier a également évoqué de nouvelles données issues d’un essai contrôlé randomisé en double aveugle chez des patients atteints d’ichtyose asymptomatique, traités par vitamine D par voie orale par rapport à l’acitrétine, dont les résultats ont été publiés dans le British Journal of Dermatology 2022. Cette étude portait sur 34 patients présentant diverses formes d’ichtyose non syndromique. Au terme de l’étude, aucune différence significative n’a été constatée entre les 2 bras de traitement en termes de sévérité et de qualité de vie des patients, et aucun effet secondaire grave n’a été recensé. La compréhension de la physiopathologie de l’ichtyose permet de conclure à la nécessité d’un traitement anti-inflammatoire ciblé. L’ichtyose n’est plus simplement considérée comme un trouble de la kératinisation, mais également comme une maladie dans laquelle la barrière cutanée altérée induit une réponse immunitaire complexe similaire à celle de la dermatite atopique et du psoriasis. Ainsi, certaines stratégies prometteuses pour le traitement de l’ichtyose consistent à inclure dans le traitement des patients atteints des agents biologiques qui inhibent les interleukines clés de la dermatite atopique et du psoriasis. Depuis 2017, plusieurs publications indiquent qu’un grand nombre d’ichtyoses présentent une activation systémique des lymphocytes T et une polarisation de Th-17 / Th-22 dans le sang des patients. Il existe une nette corrélation entre l’expression génétique accrue de la voie Th-17et la sévérité de l’ichtyose et de l’érythème cutané. Des essais cliniques sont actuellement en cours pour traiter des patients adultes atteints d’ichtyose non syndromique avec des inhibiteurs de l’interleukine 17 et de l’interleukine 12/23. Des résultats encourageants ont été publiés en février 2022 dans la revue Archives of Dermatological Research. Dans le domaine de l’ichtyose, la thérapie génique en est à un stade très précoce de développement. Il existe deux essais cliniques de phase 1/2 concernant l’ichtyose congénitale autosomique récessive (ichtyose ARCI) due à une mutation du gène responsable de la synthèse de la transglutaminase 1 (TGM1) et au syndrome de Netherton (gène SPINK5). Une nouvelle thérapie de substitution avec un inhibiteur de protéase, l’alpha1-antitrypsine recombinante locale, a également été mentionnée comme traitement potentiel du syndrome de Netherton.
Orateur : Talia Kakourou
Comptes-rendus rédigés par Dr Rémi Maghia
La transmission de la gale se fait de personne à personne par contact direct ; moins fréquemment par des objets contaminés. Le parasite meurt en dehors de son hôte humain après 24 à 72 heures. Les gales animales ne peuvent produire que des éruptions temporaires chez les humains, car leurs parasites ne peuvent pas survivre chez l’homme. La prévalence chez les enfants des pays en développement est de 5 à 10 %, elle n’est pas connue dans les pays occidentaux. Les manifestations cliniques de la gale sont une réaction d’hypersensibilité de type IV à la larve, à ses fèces et ses œufs. Le prurit survient 2 à 6 semaines après une infestation primaire, et 1 à 3 jours après une réinfestation. Chez les enfants de moins de 2 ans, on peut avoir un exanthème vésiculo-papuleux. La gale croûteuse hyperkératosique dite norvégienne se voit habituellement chez les sujets âgés, mais en cas de déficit immunitaire primaire ou secondaire, elle peut se voir parfois chez des enfants. Elle se distingue par une absence de prurit, une pullulation parasitaire, et une très grande contagiosité. Le diagnostic de gale de l’enfant se fait sur les arguments suivants. Un prurit épargnant la tête, sauf chez les nouveaux nés et très jeunes enfants. Les signes cutanés classiqueset leur topographie. L’examen direct des prélèvements cutanés obtenus par grattage. Microscopie : 100 % de spécificité, 40-90 % de sensibilité. Dermoscopie (signe du deltaplane figurant la tête du parasite au bout d’un sillon), vidéodermoscopie, microscopie confocale, OCT. PCR (un article PLoS Negl Trop Dis 2021 ). Dans le BJD 2020, on trouve des critères de consensus pour le diagnostic de gale avec un classement en 3 niveaux : A. gale confirmée, B. gale clinique, C. gale suspectée. Le diagnostic différentiel pour les nouveaux nés est : la dermite séborrhéique, l’eczéma nummulaire, la DA, l’acropustulose infantile. Pour l’enfant : la dermite de contact, la DA, un exanthème viral, l’urticaire papuleux. Pour les nodules scabieux : les mastocytomes, une histiocytose langerhansienne. La prise en charge de la gale : recommandations européennes, JEADV 2017. Les traitements recommandés sont : la perméthrine crème à 5 %, l’ivermectine per os, la lotion de benzoate de benzyle 10 à 25 %. Les traitements alternatifs : le malathion en solution aqueuse à 0.5 %, l’ivermectine lotion 1 %, la pommade au sulfure 6-33 %. Pour la gale croûteuse : un scabicide topique quotidien pendant 7 jours, puis 2 x/semaine et l’ivermectine aux jours 1, 2, 8. La perméthrine est sans danger pendant la grossesse et la lactation ; autorisée chez l’enfant à partir de 2 ans. La pommade au sulfure : permise chez le nouveau-né de moins de 2 mois. Le benzoate de benzoyle : autorisé pendant la grossesse, il peut donner des irritations de la peau. L’ivermectine per os est contre-indiquée chez les enfants de moins de 15 kg, et chez la femme enceinte ou allaitante. Tous les membres de la famille doivent être traités en même temps. Le parasite est détruit à une température > 50°. A la fin du traitement, les vêtements et les draps doivent être lavés, à haute température, puis repassés au fer chaud, ou places dans un sac plastique pendant au moins 3 jours. Les tapis doivent être aspirés. L’application de pesticides n’est pas indiquée. Et voici le « truc » surprenant de l’oratrice ! Elle conseille en cas de condition inextricable : quittez la maison pour un week-end prolongé et y faire le traitement. Au retour, le domicile sera débarrassé du parasite !... Les symptômes persistent souvent pendant 2 semaines après un traitement réussi : utiliser des dermocorticoïdes de niveau moyen. Les enfants peuvent retourner à l’école le lendemain du traitement. Les camarades de classe et les enseignants n’ont habituellement pas besoin d’être traités, à moins qu’ils présentent des symptômes. En cas de persistance des symptômes après 3 ou 4 semaines, envisager : manque de compliance au traitement, réinfection, allergie de contact au traitement, prurit psychogène, diagnostic erroné.
Orateur : Jacob Mashiah
Comptes-rendus rédigés par Dr Rémi Maghia
On pense que la teigne est l’infection mycosique la plus fréquente chez l’enfant, particulièrement entre 4 et 7 ans. L’action fongistatique du sébum expliquerait sa fréquence moindre après la puberté. La teigne est plus fréquente chez les garçons que chez les filles, ainsi que chez les immunodéprimés. Le type d’espèce prédominante varie selon les lieux géographiques. Par exemple T. tonsurans et M. canis en Amérique du Nord. En Europe, M. canis, M. audouini, T. tonsurans, T. violaceum, T. mentagrophytes. Les différences s’expliquent par les différences d’habitudes, les mouvements de population (immigration, réfugiés), les possibilités thérapeutiques locales. Les techniques pour faire le diagnostic sont : l’examen direct, la culture, la lumière de Wood, la trichoscopie, la PCR. La culture est le standard de haute spécificité et sensibilité, mais la technique est lente. La trichoscopie est un moyen rapide et peu cher, avec globalement une sensibilité et une spécificité moyennes. Les signes spécifiques trichoscopiques de teigne sont : les cheveux en virgule, en tire-bouchon, en code-morse, en zigzag, block-hairs et i-hairs. On connaît les caractéristiques de prévalence, de sensibilité, de spécificité, de valeur prédictive positive et négative de tous ces signes. La spécificité de ces signes particuliers est très bonne : 99 à 100 %. On connaît également les caractéristiques selon l’espèce. Par exemple, si les cheveux en tire-bouchon sont communs aux microsporum et trichophytons, les teignes trichophytiquesne présentent habituellement pas de cheveux en code-morse, zigzag ou en virgule. On sait également que sous-traitement, après 4 semaines certains signes trichoscopiques ont disparus (pas tous), et qu’après 12 semaines, si l’examen mycologique est négatif, il ne reste plus en trichoscopie qu’une desquamation périfolliculaire et/ou diffuse. Les « porteurs sains » : présentent une colonisation par les dermatophytes sans symptômes, source de transmission de la maladie. 32 % des familles avec un enfant infecté ont au moins un porteur sain. Ceci surtout avec les espèces anthropophiles, avec une réponse inflammatoire minimale. Le traitement de la teigne comprend : la griséofulvine, la terbinafine, l’itraconazole et le fluconazole. La griséofulvine est la première ligne de traitement depuis 40 ans. La sensibilité au médicament semblerait diminuer. Option préférable pour les infections à microsporum. La terbinafine est la seule alternative à la griséofulvine approuvée par la FDA pour les teignes (pas en France). Option préférable pour les trichophytons. L’itraconazole et le fluconazole présentent des preuves d’efficacité croissantes, peut-être moins pour le fluconazole, et demandent des traitements plus courts qu’avec la griséfuline. Le traitement topique ne peut s’envisager qu’en appoint. Shampooings au kétoconazole, au sulfide de sélénium, ou au pyrithione-zinc, permettant de diminuer le traitement systémique ou de traiter les porteurs sains.
Les mesures complémentaires
Exclusion scolaire : l’enfant avec traitement combiné peut retourner à l’école dès le lendemain, certains disent une semaine si espèce anthropophile.
Rasage du cuir chevelu : ne s’impose pas si traitement topique.
Dépistage dans la famille : traitement systémique si symptômes cliniques, shampooings antifungiques en cas de contacts asymptomatiques.
Décontamination des objets (peignes, jouets, animaux de compagnie si espèce zoophile).
Orateur : Secil Vural
Comptes-rendus rédigés par Dr Rémi Maghia
Note de l’auteur : il n’y a pas eu vraiment d’angle pédiatrique dans cette présentation.
Il existe plus de 20 espèces de leishmanies dont : tropica, major, infantum, brasiliensis, mexicana, guyanensis, panamensis . 12 millions de patients sont infectés dans le monde ; il y a chaque année un million de nouveaux patients provenant de 100 pays d’endémie. 350 millions de personnes sont à risque au niveau mondial, et avec le réchauffement climatique les zones d’endémie devraient s‘étendre de par l’expansion géographique du phlébotome.
La présentation clinique commune : d’abord une papule au site de piqure, après quelques semaines ou mois. Puis guérison spontanée après 3 à 8 semaines, laissant une cicatrice atrophique. Les lésions siègent sur les zones découvertes : centre de la face, extrémités. Dans les zones d’endémie les enfants sont plus communément touchés. Les évolutions de la LC : La LC aigue peut guérir spontanément avec cicatrice, ou sans cicatrice avec traitement. La LC chronique peut évoluer dans 2 à 5 % des cas vers une LC récidivante, vers une forme anergique diffuse (pas de guérison) dans 5 à 10 % des cas. Ou vers une LC lupoïde (guérison partielle). Dans le cas d’une LC aigue, l’évolution typique de la lésion est une papule, puis un nodule indolore avec une croûte, puis une ulcération, puis une guérison avec cicatrice atrophique. Le temps de guérison varie de 6 à 15 mois pour L. tropica à 2 à 6 mois pour L. major . La LC récidivante se présente avec des nouvelles lésions papuleuses durant ou après le processus de guérison d’une LC aigue. Les lésions peuvent persister individuellement ou coalescer sur plusieurs années. La LC chronique : les lésions initiales ne s’améliorent pas et persistent, sans ulcération, et résistent au traitement. Il y a un défaut de l’immunité cellulaire. Cela peut ressembler à un lupus vulgaire cliniquement et histologiquement. La LC diffuse : elle est liée à une immunodépression, et peut ressembler à une lèpre lépromateuse. La leishmaniose muco-cutanée est causée par certaines espèces (« L. braziliensis complex »). Elle est caractérisée par des destructions des lèvres, du palais, du septum nasalet peut conduire à des décès.
Le diagnostic se fait par la recherche directe du parasite sur prélèvement de peau sur le bord des lésions (site d’activité). La PCR est actuellement le test privilégié pour le diagnostic : sensibilité de 54 à 99 %, avec possibilité de diagnostic d’espèce. La culture sur milieu spécial est possible.
Les traitements :
Les antimoniaux pentavalents, systémiques ou en injection locale
L’amphotéricine B liposomale : efficacité, pas de résistance observée, surveillance de la fonction rénale et cardiaque. Chère malheureusement…
La miltéfosine : agent prometteur dans cette indication. Effets secondaires de bas grade : digestifs, élévation de créatinine.
La pentamidine
Autres : fluconazole, aminocidine, kétoconazole, itraconazole, terbinafine, azithromycine, zinc, rifampicine
La cryothérapie : 1 fois/semaine, double cycle de congélation de 10 à 20 secondes, 2 mm de congélation de zone saine périphérique. Haut taux de rechute. Mais la combinaison avec des injections d’antimoniaux augmente l’efficacité. Problème des cicatrices.
Le suivi de la réponse thérapeutique : une diminution des 2/3 de la taille lésionnelle après 6 semaines est considérée comme réponse au traitement, tandis qu’une diminution <1/3 conduit à changer pour un autre traitement. Le suivi post-thérapeutique : tous les 3 mois pendant un an pour surveiller une éventuelle récurrence. En cas de L. braziliensis : après un an, suivi annuel pendant 10 ans.
Orateur : Ramon Grimalt
Comptes-rendus rédigés par Dr Rémi Maghia
Les anomalies unguéales les plus fréquentes chez l’enfant sont :
Avant 2 ans : onychoschizie et leuconychies.
Après 2 ans : leuconychies et onychophagie.
L’onychoschizie est la deuxième anomalie unguéale en fréquence. Il y a une division en couches du bord libre de la tablette unguéale distale. Le phénomène est très frequent aux pouces et aux gros orteils. Bien que l’étiologie ne soit pas exactement connue, les traumatismes répétés, les bains fréquents ou l’usage de solvants sont évoqués comme facteurs prédisposants.
La leuconychie : peut se voir sous forme de stries longitudinales blanches ou de taches blanches, aux ongles de mains ou de pieds. Les causes sont multiples.
L’onychophagie
On distingue : l’onychophaghie (mordillement des ongles), de l’onychotillomanie (trituration des ongles), qui sont courantes dans l’enfance. Le taux chez l’enfant entre 7 et 10 ans est de 28 à 33 %. L’onychophagie ne devrait pas être considérée comme un simple problème cosmétique. Une étude en 2014 évaluant 450 enfants avec une histoire d’onychophagie a montré que 75 % parmi eux présentaient un déficit de l’attention et un trouble d’hyperactivité.
Les infections
Virales (verrues, péri- et surtout sous-unguéales, rendant le traitement difficile), bactériennes, fongiques.
Les maladies systémiques
La capillaroscopie peut être d’une grande aide : sans être très spécifique, elle peut constituer un signe précoce de maladie systémique
Génodermatoses
La dysplasie ectodermique pure.
La pachyonychie congénitale.
La désaxation congénitale des gros orteils.
Ongles de Terry
Leuconychie diffuse en « verre dépoli », décrite par Terry en 1954, associée avec un diagnostic de cirrhose hépatique chez 82 patients sur 100. Puis d’autres associations ont été décrites par Holzberg et al. : insuffisance cardiaque congestive chronique, diabète. Ces auteurs concluent également que des jeunes patients avec cette anomalie unguéale avaient un risque augmenté de maladie systémique. Récemment, Fawcett a relié les ongles de Terry avec l’hyperthyroïdie.
Le diagnostic différentiel des ongles de Terry se fait avec les ongles de Lindsay (half and half nails), associés à des maladies rénales chroniques, et les ongles de Muehrcke, associés à une sévère hypoalbuminémie ou en cas de médication anti néoplasique.
Traumatismes
L’hémosidérine et la mélanine peuvent avoir exactement la même apparence !
Le psoriasis
Les anomalies sont nombreuses et bien connues, et le diagnostic est aidé si on trouve des lésions de psoriasis ailleurs, en particulier bien penser à examiner le cuir chevelu.
La pelade
La prévalence des anomalies unguéales chez les enfants avec pelade a été évaluée par Tosti et al. à 46 % (126/272). Le début à l’ongle peut précéder ou suivre la chute de cheveux.
Les altérations unguéales sont : un pitting, bien régulier et superficiel, une leuconychie ponctuée, une trachyonychie-twenty nail dystrophy : 12 % des enfants (Tosti).
Orateur : Zsuzsanna Szalai
Comptes-rendus rédigés par Dr Rémi Maghia
Avec un aussi large sujet, impossible d’être exhaustif, en voici des extraits choisis et classés.
Une éruption nouvelle
Une éruption inhabituelle, ou qui ne répond pas au traitement, ou accompagnée de fièvre, de douleur articulaire, musculaire, ou d’autres symptômes, peut indiquer un problème interne ou une infection. Pour exemple :
Une « grosseur » nouvelle
Changement de couleur
Changement de texture peut être signe de:
Les signes périorificiels et alopéciques de l’acrodermatite entéropathique en sont l’exemple emblématique, avec un véritable test thérapeutique par la supplémentation en zinc qui donne une amélioration des symptômes « dramatique » en quelques jours.
L’aspect typique en « raton-laveur » de l’érythème facial du lupus érythémateux néo natal.
Orateur: Stephanie Christen-Zäch
Comptes-rendus rédigés par Dr Rémi Maghia
Urticaria Les étiologies de l’urticaire et de l’angiooedème sont nombreuses : infectieuses, allergiques, pseudo-allergiques, physiques, toxiques, cholinergiques, endogènes (auto-immune, auto-inflammatoire, endocrine, hématologique), et enfin idiopathiques.
Si l’angiooedème est isolé : déficit en inhibiteur de la C1 estérase, prise d’IEC, angiooedème bradykinique héréditaire.
Cliniquement, la forme classique se présente avec des aires de vasoconstriction autour des lésions papuleuses, sinon sous forme d’éléments figurés, ou de dermographisme, ou en petites papules diffuses en cas d’urticaire cholinergique. La particularité chez les bébés est l’urticaire géant, qui peut avoir une note hématique comme des ecchymoses, à ne pas confondre avec la maladie sérique. Les mains et les pieds sont souvent touchés.
Ne sont pas considérés comme des sous-types d’urticaire : vascularite urticarienne (fixité), maladie sérique, oedème aigu hémorragique infantile, mastocytose cutanée maculo-papuleuse, syndromes auto-inflammatoires.
On distingue :
Les sous-types d’urticaire chronique sont :
L’urticaire chronique spontanée (UCS), de causes connues ou non.
L’urticaire chronique inductible, provoquée par des causes :
La durée de l’UCS : le plus souvent de 1 à 5 ans : 50 % s’amendent dans les 6 mois, 20 % dans les 3 ans après le début.
Le bilan ne doit pas être exhaustif et coûteux : tenir compte de l’historique du patient, de l’examen clinique. Une seule exception : si suspicion d’allergie alimentaire de type I, ou l’existence de facteurs déclenchants tels que AINS.
Le traitement pharmacologique de l’UCS
Première ligne : Anti-H1 de 2ème génération à dose standard
A poursuivre quelques semaines après la résolution, à diminuer ensuite progressivement pour déterminer si un traitement d’entretien est encore à continuer.
Les anti-H1 de 2ème génération utilisés en pédiatrie sont : cétirizine, levocétirizine, loratidine, desloratadine, fexofénadine, rupatadine, bilastine
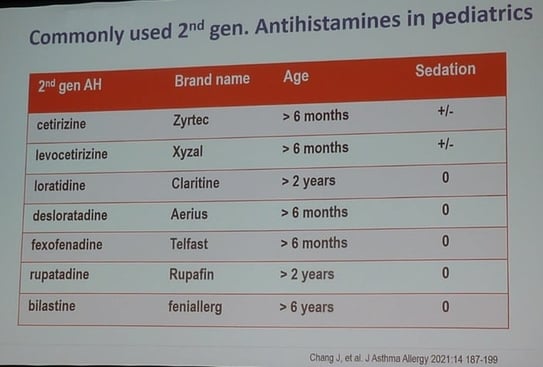
Deuxième ligne : si contrôle inadéquat après 2 à 4 semaines, ou même plus tôt si les symptômes sont intolérables : augmenter la dose jusqu’à X 4.
Troisième ligne : ajouter l’omalizumab, qui est approuvé pour l’enfant > 12 ans avec UC, et chez l’enfant avec asthme à partir de 6 ans.
Quatrième ligne : si réponse inadéquate à 6 semaines : ciclosporine, en sachant que ce traitement ne peut être poursuivi au regard de possibles conséquences rénales.
Autres modalités thérapeutiques : montélukast (anti-leucotriène), ranitidine (anti-H2), doxépine (anti-dépresseur tricyclique), corticoïdes systémiques limités à 10 jours pour des réactions aigues sévères ; éviction de l’aspirine et des AINS, facteurs d’exacerbation de l’UC.
Orateur : Christine Bodemer
Comptes-rendus rédigés par Dr Rémi Maghia
Les mastocytoses résultent d’une accumulation clonale anormale de mastocytes dans au moins un tissu (peau, tractus digestif, foie, moelle osseuse…). Le relargage de médiateurs induit un syndrome d’activation mastocytaire (McAs), comprenant urticaire, flush, douleur abdominale, diarrhée, céphalées, douleurs osseuses…
Chez les enfants, la régression spontanée de la maladie est habituelle, contrairement à l’adulte où il existe des lésions non régressives, et des formes systémiques fréquentes. Des mutations somatiques gain de fonction sont identifiées dans 85 % des mastocytoses pédiatriques. La mutation D816V du gène KIT n’est retrouvée que dans 42 % des cas chez l’enfant, contrairement à ce qui est observé chez l’adulte (90 %).
Le rôle physiopathologique de cette mutation n’est pas encore totalement clair. Les formes sporadiques (mutations acquises) sont largement supérieures aux formes familiales ; il n’existe que moins de 150 cas familiaux rapportés, dont seulement 13 avaient une mutation germinale de KIT (et jamais D816V).
Les lésions cutanées spécifiques de la mastocytose cutanée (MC) pédiatrique comprennent :
La MCMP (70 à 80 %) survient avant l’âge de 2 ans, elle comprend des lésions maculeuses ou papuleuses de couleur rouge/brun (cf. « urticaire pigmentaire »). Elle est plus ou moins diffuse, surtout située sur le tronc et les membres. Le cuir chevelu peut être atteint : d’ailleurs, la présence de bulles sur le scalp à la naissance doit faire évoquer ce diagnostic.
Le mastocytome (10 à 20 %) : il est présent surtout à la naissance ou avant 3 mois. Lésion brunâtre nodulaire, unique le plus souvent et de taille variable. Il existe des récidives fréquentes de bulles ou de desquamation superficielle.
La MC diffuse (5 %) : survenue néo-natale, infiltration diffuse ferme, décollements bulleux hémorragiques, apparence de « peau d’orange ». Risque systémique, en particulier d’anaphylaxie néo natale.
Le diagnostic de MC pédiatrique
Evolution
Prise en charge d’une MC pédiatrique
Les traitements symptomatiques, par lignes progressives :
En cas de bulles diffuses, de formes systémiques
Orateur : Anne-Sofie Halling
Comptes-rendus rédigés par Dr Rémi Maghia
The Danish patient register is known as a veritable treasure trove of raw patient data, and one that has given rise to numerous studies and articles in the
On sait que le registre danois est un véritable trésor de données brutes des patients, et qu’il est à l’origine de nombreuses études et de nombreux articles dans la littérature médicale et dermatologique.
Le système danois comprend de nombreux registres spécifiques, concernant les domaines suivants : éducation, maladies psychiatriques, prescriptions, services de santé, diabète, cancer, causes de décès, dossier médical de naissance, revenus, data bases médicales. Les registres sont reliés entre eux, chaque citoyen ayant un numéro unique ausein de tous ces registres publics.
Il faut savoir, en ce qui concerne la pédiatrie, que tout enfant danois jusqu’à l’âge de 18 ans figure dans le registre danois, le Danish National Patient Registry. On peut établir des statistiques en comparant les sujets étudiés avec des contrôles appariés selon le sexe et l’âge. Le modèle de régression de Cox est employé pour calculer le Hazard Ratio. Les variables considérées dans les modèles statistiques sont : l’âge, le sexe, les comorbidités pertinentes, les médicaments, le statut socio-économique.
Etude danoise des comorbidités de la dermatite atopique (DA)