0 professionals
Coup d’œil du congrès RADLA 2022
Coup d’œil du congrès RADLA 2022
Améliorez vos connaissances professionnelles en profitant de nombreux services exclusifs dans le domaine de la dermatologie : plus de 500 visuels de pathologies, des cas cliniques, des vidéos d’experts…
Bénéficiez d’options uniques telles que l’offre de contenus audio et de supports à proposer à vos patients.
Restez informé(e) des événements et des webinaires à venir, des dernières publications scientifiques et des innovations produit.
Vous avez déjà un compte ? Se connecter
Comptes-rendus rédigés par Dr Silvina MALDONADO Dermatologue Argentine, Josefina MARCO BONNET Dermatologue France
Sujets liés
Orateurs : Dr Ana MORDOH, Dr Francisco BRAVO, Dr Nelson LOBOS, Dr Mario MARINI, Dr Miguel MARTINEZ, Dr Leonel FIERRO, Dr Carlos SILVA, Dr Susana PUIG
Article rédigé par Dr Silvina MALDONADO
Altérations génétiques observées dans le mélanome - Dr Ana MORDOH
Le Dr Ana Mordoh nous a parlé des altérations génétiques observées dans le mélanome.
Après avoir passé en revue les différents types d’altérations génétiques (mutations ponctuelles, indels, simplifications, délétions, dérèglements, translocations), elle a précisé qu’en général, ces altérations sont somatiques et que 5 % (mélanome familier) touchent les cellules germinales. 94 % des mélanomes présentent une altération de la voie RTK/RAS (MAP kinases). En ce qui concerne la classification génétique du mélanome, on retrouve le BRAF, le RAS, le NF1 et le TRIPLE SAUVAGE. Le BRAF, le RAS et le NF1 correspondent à la voie MAP kinases, en sachant que le mélanome BRAF peut être traité par anti-oncogènes, contrairement aux mélanomes RAS et NF1, ce dernier n’étant pas suffisant pour favoriser une tumeur maligne (on constate uniquement sa présence). Le mélanome TRIPLE SAUVAGE ne porte pas la marque des dégâts dus aux UV ; il s’agit des mélanomes acrolentigineux/muqueux présentant une infiltration lymphocytaire élevée. Sur le plan pratique, chez les patients présentant des dommages solaires intermittents, dans 30 % des cas, les mélanomes apparaissent au niveau de nævi pré-existants ou de mélanocytes présentant une mutation de BRAF. Ces patients ont moins de 55 ans et possèdent de nombreux nævi au niveau du tronc et des membres ; le gène BRAF est prédominant et la charge mutationnelle est faible. Au contraire, en cas de dommages solaires chroniques, les mélanomes apparaissent au niveau de mélanocytes basaux ou épithéliaux folliculaires. Ces patients ont moins de 55 ans ; ils présentent une élastose, une kératose actinique, quelques nævi au niveau de la tête, du cou ou au dos des mains ; la charge mutationnelle est élevée et concerne les gènes NRAS, NF1, KIT et BRAF.
Les classifications du mélanome Dr Leonel Fierro
Le Dr Leonel Fierro nous a rappelé les classifications du mélanome sur le plan clinique. Il a ainsi évoqué les mélanomes amélaniques, spitzoïdes (pronostic favorable chez les moins de 10 ans), des muqueuses (architecture pagétoïde, lentigineuse ou mixte) et le nævus bleu malin, qui apparaît au niveau d’un nævus bleu cellulaire ou d’Ota, se développe dans le derme et le tissu cellulaire sous- cutané, sans toucher l’épiderme. En ce qui concerne les considérations particulières en cas de
mélanome, Le Dr Fierro a évoqué le mélanome pendant la grossesse (2,8 à 8,5 pour 100 000, après le cancer du col de l’utérus et du sein). Il a présenté un algorithme à utiliser pour le traitement chirurgical (JDDG 2016 Jun; 14(6):585-93), tout en remarquant que la grossesse ne justifie pas de retarder la prise en charge du mélanome. Enfin, il a insisté sur l’importance d’un comité de bioéthique pluridisciplinaire pour les décisions en cas de métastases. Le taux de métastases au niveau des fœtus est de 25 % et comme toujours, le pronostic dépend du stade de la maladie. Pour ce qui est du mélanome primitif multiple, cette désignation concerne uniquement les diagnostics établis au cours des trois premiers mois de la tumeur. On observe une altération de CDKN2A dans 8,3 -15 % des cas et deux tranches d’âges sont davantage touchées : de 15 à 39 ans et de 65 à 79 ans, principalement au niveau des extrémités chez les patients présentant des antécédents de nævi dysplasiques, des antécédents familiaux de mélanomes de grade 1 et un phototype clair. Le mélanome chez l’enfant est
rare. Il peut être d’origine transplacentaire, émaner de la transformation d’un NMC, être associé à une maladie génétique et apparaître au niveau d’un nævus pré-existant.
Les types de mélanomes rares sur le plan clinico-pathologique Dr Francisco Bravo
Le Dr Francisco Bravo a évoqué les types de mélanomes rares sur le plan clinico-pathologique. Le mélanome desmoplastique (< 4 %) est principalement observé chez des hommes de plus de
60 ans, au niveau de la tête et du cou. Le tableau clinique n’est pas spécifique ; 60 % des cas sont amélanotiques. Apparaissant de novo ou associés à un lentigo malin, ces mélanomes sont généralement volumineux, mais étrangement moins agressifs, en sachant que les formes pures présentent un diagnostic plus favorable que les formes mixtes. Le mélanome primitif dermique (0,8 %), impossible à distinguer des métastases sur le plan histologique, affiche un faible risque de métastase et une survie de 80 à 100 %, malgré un indice de Breslow intermédiaire de 3 mm. Le
mélanome à déviation minime équivaut à la phase de croissance verticale du mélanome, sans atopie d’origine cytologique. Le mélanome polypoïde est une variante du mélanome nodulaire qui n’est pas nécessairement pigmentée. Il peut apparaître au niveau de l’appareil respiratoire supérieur, de
l’œsophage, du rectum, du vagin, des voies biliaires. Dénué de structure génétique précise, il est très agressif et touche généralement des jeunes de 20 à 39 ans. Le mélanome verruqueux (3 %) est souvent mal diagnostiqué. Il touche les jambes chez des patientes jeunes et s’avère très agressif quand il n’est pas in situ. Le mélanocytome épithélioïde pigmenté (anciennement mélanome de type animal) présente un faible taux de récidive, une faible dissémination vers les ganglions et dissémination systémique. Un tiers de ces mélanocytomes sont d’origine congénitale et présents dès l’enfance. Le mélanome des muqueuses (1 %) est souvent diagnostiqué tardivement. Le mélanome nævoïde touche les jeunes, la zone en proximal des extrémités et du tronc et présente un comportement clairement malin. Le mélanome en nids volumineux apparaît généralement après
50 ans. Le mélanome amélanotique est difficile à diagnostiquer. Le mélanome folliculaire s’apparente à des démangeaisons dans une zone exposée au soleil. Le mélanome rhinophymoïde est difficile à diagnostiquer. Le nævus de Wiesner (BAPome) n’est pas un mélanome, mais il est généralement le signe d’un syndrome susceptible de déboucher sur différents types de cancers. Pour terminer, le Dr Bravo a décrit un mélanome acrolentigineux bilatéral très rare apparaissant simultanément des deux côtés.
Modifications récentes de la classification T (TNM) : utilité dans la prescription d’examens et de traitements Dr Mario Marini
Le Dr Mario Marini a mis en lumière les modifications récentes de la classification T (TNM) et leur utilité dans la prescription d’examens et de traitements.
Il a décrit l’importance du T pour distinguer les variantes clinico-pathologiques de la tumeur primitive et analyser la physiopathologie et les examens moléculaires. Il a expliqué qu’en réalité, seul l’indice
de Breslow et l’ulcération sont encore utilisés pour la stadification (les autres indices sont facultatifs, mais il convient malgré tout de déterminer s’ils sont élevés). Il a ensuite présenté la création de la sous-catégorie T1b (0,8-1 mm) afin de prescrire ou non l’examen des ganglions sentinelles (GS), le nombre de GS positifs permettant d’éviter des examens superflus. Il a évoqué des cas de T1a présentant une ulcération, de T1b avec ou sans ulcération et de T1a associés à des facteurs de risque (patients jeunes, antécédents, invasion lymphovasculaire, > 75 % de régression, antécédents personnels ou type neurotrope). D’où l’importance de pratiquer des examens complémentaires en fonction de la stadification, seulement en cas de tumeur avancée et de GS positifs. Très utile lorsque les ganglions ne sont pas palpables, l’échographie ne remplace pas les GS. Elle est à prescrire dans les cas suivants : une biopsie est indiquée, mais les patients ne l’effectuent pas ; la biopsie est
impossible ou n’a pas réussi sur le plan technique ; et l’exérèse ganglionnaire n’est pas effectuée dans un contexte de GS positif. Dans la pratique, la question de l’exérèse ganglionnaire ou du suivi échographique se pose au stade IV.
Imagerie et analyses de laboratoire : quand et lesquelles ? Dr Miguel Martinez
Ensuite, le Dr Miguel Martinez a parlé de l’imagerie et des analyses de laboratoire : quand et lesquelles ?
Dans le cadre du diagnostic, il convient de s’appuyer sur le tableau clinique, sur les antécédents personnels et éventuellement sur le profil moléculaire FISH (pour le diagnostic des lésions mélanocytaires équivoques).
Dans le cadre du pronostic, pour la stadification initiale et la planification du traitement, on utilise une biopsie des GS après une échographie du bassin ganglionnaire.
Dans le cadre du suivi, pour le diagnostic des récidives ou de la dissémination, il a été déterminé que ces examens ne présentent aucun bénéfice supplémentaire lors des stades initiaux (jusqu’à IIA). Aux stades IIB et IIIA, IIC et IIIB, on prescrit un scanner du crâne, du thorax et de l’abdomen (et du col, si c’est indiqué). Pour le thorax et l’abdomen, le PET-scan est possible, mais le SNC n’est pas examiné quand le patient ne présente aucun symptôme. Aux stades IIIC et IIID, on prescrit un scanner du corps entier ou un PET-scan et une RMN cérébrale. En cas de suspicion de métastases ou en présence de symptômes : PET-scan, LDH et RMN.
Patiente présentant des antécédents de mélanome (grossesse, traitement de substitution, etc.) Dr Susana Puig
Le Dr Susana Puig a évoqué une patiente présentant des antécédents de mélanome (grossesse, traitement de substitution, etc.).
Elle a souligné que le pronostic associé au mélanome ne varie pas significativement chez la femme enceinte, que cette tumeur est celle qui génère le plus de métastases au niveau du placenta et potentiellement chez le fœtus, et que dans les deux cas, l’évolution dépend du stade clinique de la maladie. En ce qui concerne le risque associé à l’immunothérapie sous anti-PD1 (nivolumab) chez la femme enceinte, ce traitement a été efficace dans quelques cas, mais il existe un risque de fausse couche jusqu’à la semaine 14, tandis qu’aux deuxième et troisième trimestres, le risque de mort in utero, d’accouchement prématuré et de mortalité infantile augmente. Toujours analyser le placenta afin d’évaluer le risque chez l’enfant. Pour ce qui est du THS, le mélanome présente des récepteurs aux œstrogènes qui peuvent stimuler sa croissance et son invasion ; des études ont montré une apparition supérieure et certaine chez la femme.
Prédiction du risque de mélanome et utilité des analyses moléculaires Dr Raul Cabrera
Le Dr Raul Cabrera a parlé de la prédiction du risque de mélanome et de l’utilité des analyses
moléculaires. Il a expliqué que 20 gènes sont associés au mélanome : certains sont très fréquents, mais présentent un risque faible ; d’autres sont rares, mais présentent un risque modéré ou élevé.
Pour prédire le risque de mélanome héréditaire, on utilise l’analyse INVITAE de préférence sur un prélèvement sanguin, ou dans la salive, un frottis buccal, de l’ADN. Pour le risque clinique de récidive et de métastase des mélanomes traités par chirurgie, par thérapie ciblée ou par immunothérapie, il est possible d’avoir recours à l’analyse MELAGENIX au niveau des biopsies et à l’analyse SKYLINE (à l’étude au sein de la clinique Mayo) ou SINGATERA au niveau des prélèvements sanguins. La prudence est toutefois de rigueur, puisque ces méthodes sont encore à l’étude ; des données plus précises seront nécessaires avant une utilisation universelle.
La prise en charge chirurgicale du mélanome primitif Dr Nelson Lobos
Le Dr Nelson Lobos nous a parlé de la prise en charge chirurgicale du mélanome primitif. Il a insisté sur le fait d’avoir recours à la biopsie excisionnelle, ou rasage profond, au niveau des cellules fusiformes à chaque fois qu’il est possible de prévoir une marge minime, afin d’établir le diagnostic ainsi que des recommandations thérapeutiques. Au niveau des extrémités, sur le plan longitudinal puis en suivant les lignes de Langer, on utilise une fermeture primaire ou secondaire. Dans certains cas, plusieurs biopsies incisionnelles sont pratiquées (visage, biopsies étendues ou faible suspicion de mélanome). L’élargissement des marges doit être décidé sur la base de l’indice de Breslow (NCCN 02/2022). Dans des cas particuliers comme le mélanome sous-unguéal, aucune donnée n’a démontré que l’amputation augmente la survie, si bien que la prise en charge est conservatrice. Face au lentigo malin, le traitement de première intention est chirurgical avec maîtrise des marges (excision large, techniques du carré, par étapes ou chirurgie de Mohs en cas de lentigo volumineux, mal défini ou présentant une micro-invasion). Ne pas utiliser les bistouris électriques.
Traitements du mélanome avancé : résultats disponibles en 2021 Dr Carlos Silva
En conclusion de ce cours, le Dr Carlos Silva a évoqué les traitements du mélanome avancé : résultats disponibles en 2021.
Il a largement passé en revue les études ayant démontré que l’association des inhibiteurs de BRAF et MEK permet une meilleure survie comparativement à chaque traitement séparément et à un placebo, sauf en cas de BRAF de type sauvage, où l’association médicamenteuse s’est avérée égale au nivolumab en monothérapie. Dans tous les cas, il n’existe pas de preuves de niveau 1 (essais randomisés de phase III) pour décider quel traitement est le plus adapté face au mélanome avec mutation de BRAF. Le choix du traitement doit être éclairé par les données des essais cliniques.
Aucune différence n’a été observée au niveau de la survie globale. La thérapie ciblée est plus efficace en termes de réponse, mais elle est aussi plus toxique (sauf l’association nivolumab + ipilimumab) et nécessite un traitement continu. Reste à déterminer s’il est préférable d’initier le traitement tôt après
la chirurgie, au stade III, ou d’opérer, puis de mettre en place un traitement au stade IV.
Orateurs : Dr Jose M. MASCARO, Dr Arnaldo ALDAMA
Article rédigé par Dr Silvina MALDONADO
Prise en charge du pemphigus vulgaire (PV) en dermatologie générale Dr Jose M. Mascaro
Dans le thème des nouveautés sur le plan des cloques et ampoules, le Dr Jose M. Mascaro a décrit la prise en charge du pemphigus vulgaire (PV) en dermatologie générale.
Le diagnostic repose sur l’évaluation clinique suggestive, les antécédents personnels compatibles, la détection d’IG (+/-C3) dans les espaces intercellulaires par IFD et la présence d’anticorps sériques (IgG anti-substance intercellulaire par IFI / anti-dsg3 [+/-Dsg1] par ELISA ou d’autres techniques).
Pour le traitement, deux étapes sont à envisager : la première a pour objectif d’induire la rémission afin de maîtriser la maladie, avant d’obtenir une consolidation ; la seconde vise à maintenir cette dernière. Pour y parvenir, le rituximab (RTX) est actuellement le traitement de première intention, en cas de PV léger (surface corporelle < 5 %, ne gênant pas l’ingestion des aliments, PDAI < 15), en monothérapie (2 perfusions de 1 g) ou en association avec la prednisone à des doses moins élevées qu’il y a quelques années (0,5 à 1 mg/kg/jour, puis baisse progressive pour un arrêt du traitement après 3 ou 4 mois). Il est également possible de prescrire la prednisone 0,5-1,5 mg/kg/jour en monothérapie ou en association avec l’azathioprine, le mycophénolate mofétil/acide mycophénolique. Face au PV modéré à sévère, entraînant des difficultés à s’alimenter ou touchant une surface corporelle > 5 % et associé à un PDAI > 15, le traitement indiqué est le rituximab 2 perfusions de 1 g associé à la prednisone 1 mg/kg/jour, puis baisse progressive pour un arrêt du traitement après 6 mois. En cas de contre-indication, ce traitement est remplacé par des corticoïdes en association avec l’AZT ou le MFM. Si la maladie est bien maîtrisée après 3-4 semaines, le traitement est poursuivi à l’identique, puis en cas de rémission complète après 6 mois, il est remplacé par le rituximab 500 mg, ou 1 g pour une maladie sévère ou si des niveaux élevés d’anticorps anti-dsg sont encore observés après 3 mois. En l’absence de rémission complète, 2 perfusions d’1 g de rituximab sont administrées à 12 et 18 mois ; le RTX 500 mg est administré chez les patients atteignant une rémission complète, mais présentant encore des anticorps anti-dsg. Lorsque la maladie n’est pas maîtrisée après 3-4 semaines et lorsque le patient a déjà reçu de la prednisone et du RTX, les corticoïdes sont augmentés à 1,5 mg/kg/jour ou en IV. Chez les patients ayant reçu uniquement de la prednisone, la dose est augmentée et du RTX ou des immunosuppresseurs sont ajoutés. Le RTX en première intention augmente le taux de rémissions complètes à 5 ans, comparativement à son utilisation en deuxième et troisième intention. À noter que les directives d’entretien pour éviter les rechutes sont mal connues ; ces directives proposent d’utiliser systématiquement le traitement à 6, 12 et 18 mois (Guidelines EADV 2020), d’utiliser à nouveau un traitement comportant de nombreux cycles ou un traitement personnalisé selon l’évolution des biomarqueurs (anticorps anti-dsg, lymphocytes CD20, lymphocytes T).
Prise en charge au long cours du pemphigus foliacé par des traitements permettant de réduire la cortisone Dr Arnaldo Aldama
En fin de journée, le Dr Arnaldo Aldama a présenté la prise en charge au long cours du pemphigus foliacé par des traitements permettant de réduire la cortisone. Les corticoïdes existent sous forme orale, parentérale, perfusions, intralésionnelle et locale. La posologie est quotidienne, divisée ou à doses alternées, les doses devant être les plus basses possibles. Par ailleurs, les corticoïdes sont associés à d’autres molécules pour réduire la dose administrée tout en maintenant la rémission. Ces autres molécules peuvent être les suivantes : AZT, MMF, RTX et éventuellement DAPS et cyclosporine. Dans les formes sévères, on prescrit des Ig 2-3 g/kg pendant 4-5 jours par mois, une plasmaphérèse ou une immunoabsorption (qui élimine 80 % des anticorps circulants, par cycles mensuels de 4-5 jours, mais très coûteux). Pour les traitements locaux : clobétasol, antibiothérapie
locale, tacrolimus. Il est également recommandé de prendre en compte le facteur environnemental, l’alimentation et la photoprotection.
Orateurs : Dr Graciela GUZMAN, Dr Natalia HERNANDEZ, Dr Lucie PUELL, Dr Ida DUARTE, Dr Juan Pedro RUSSO, Dr Ana M. GIMENEZ
Article rédigé par Dr Silvina MALDONADO
Allergènes émergents : anciens et nouveaux Dr Graciela Guzman
Le Dr Graciela Guzman a expliqué qu’il n’y a probablement pas d’allergène nouveau, mais qu’il s’agit peut-être de l'apparition de molécules davantage allergéniques que nous méconnaissons dans les nanotechnologies et leur toxicité. Ces allergènes sont présents dans des articles du quotidien utilisés dans la vie personnelle, le travail, les loisirs, le matériel médical/les implants ; depuis quelque temps, ils sont particulièrement observés dans les équipements de protection individuelle. La sensibilisation aux métaux semble associée à une prédisposition génétique via la modification du filigrane. Allergène numéro 1, le nickel est souvent présent aux côtés du cobalt et du chrome, mais aussi du palladium (dans les alliages dentaires). En plus d’être présents dans les métaux, les allergènes se retrouvent aussi dans l’alimentation, où ils sont libérés par les casseroles et autres marmites, tout en étant aussi présents dans les amandes, les noix, l’avoine et le cacao. Les femmes sont davantage touchées, au niveau du visage, du cou et des mains. Viennent ensuite les parfums et produits cosmétiques (fragrances oxydées) : le Magnolia officinalis, le linalol et le limonène, le dioléate de méthyl glucose,
les carbomères. Ceci dit, « les allergènes de l’année » restent selon elle les glucosides, les glycolipides et les alkyles présents entre autres dans un produit commercial à base de tacrolimus (ELIDEL). La menthe, le cinnamal, l’anéthol, le propolis et les métaux participent à la chéilite, la dermatite périnéale et la stomatite. Quant au dexpanthenol (B5), il est présent dans les hydratants et les produits cosmétiques. Le monoéther polyméthylique vinylique est présent dans les ostomies, tandis que l’acrylate d’isobornyle est présent dans les capteurs de glucose.
Dermatite de contact : expérience en unité dermatologique Dr Natalia Hernandez
Le Dr Natalia Hernandez nous a présenté des travaux de 5 ans, dans le cadre desquels 64,7 % des patients se sont avérés positifs à une batterie de tests standard en Europe, les responsables étant le nickel, le Fragrance mix 1, le baumier du Pérou, le Fragrance mix 2 et la méthylisothiazolinone (qui est présente dans le slime tant apprécié des enfants). Le Dr Hernandez nous a exposé des cas cliniques dans lesquels ces substances avaient provoqué une dermatite de contact au niveau de différentes parties du corps, sans qu’il soit systématiquement facile d’identifier le mécanisme par
lequel le produit incriminé entraînait cette réaction. Enfin, elle a souligné l’importance de la fréquence des résultats positifs en cas d’atopie et l’impact sur la qualité de vie.
Allergènes communs identifiés par patch-test en cas de suspicion de dermatite de contact faciale
Dr Lucie Puell
Le Dr Lucie Puell nous a parlé des différentes présentations pour orienter la suspicion clinique : les plaques bilatérales, qui touchent le front, les joues et le menton ; la présentation aérotransportée, qui touche également le cou, mais épargne le nez ; et la présentation photoallergique, qui touche également la partie antérieure du nez. Sur 1 800 enfants et adolescents étudiés, près de 70 % étaient de sexe féminin et la majorité présentait une dermatite au niveau du visage et des mains. Au niveau du visage, des alcools de laine, du nickel et du dichromate de potassium étaient détectés, tandis que sur les mains, les allergènes présents étaient, par ordre de fréquence : le nickel, le cobalt, le dichromate de potassium et les alcools de laine. Lors d’une autre étude portant sur des sujets adultes, la fréquence était très élevée au niveau des mains, tandis que le visage et le reste du corps étaient moins touchés. Les allergènes les plus impliqués étaient le nickel, le cobalt, le Fragrance mix et le chrome. Le Dr Puell a également souligné l’importance d’écarter les pathologies associées et la présence concomitante de deux formes de dermatites de contact, par exemple des présentations aérotransportées d’origine professionnelle et non professionnelle. Les professionnels de santé
réagissaient aux accélérateurs utilisés dans le caoutchouc des élastiques au niveau des masques, au formaldéhyde et aux substances adhésives comme le méthyldibromoglutaronitrile.
Implants métalliques et réaction hypersensible Dr Ida Duarte
Le Dr Ida Duarte a évoqué les implants métalliques, notamment ceux utilisés en traumatologie, pour lesquels les données sont les plus nombreuses. Parallèlement, elle a également décrit les autres
implants (gynécologiques, stimulateurs cardiaques, intravasculaires, odontologiques). Elle a ensuite présenté les deux possibilités suivantes : l’échec de l’implant est-il dû à la réaction hypersensible ou inversement ? Cette réaction prend diverses formes : érythème, eczéma, œdème, douleurs articulaires. Elle apparaît deux mois à deux ans après la chirurgie et elle est plus fréquente chez les femmes. Les critères principaux sont les suivants : apparition d’une dermatite chronique quelques semaines ou quelques mois après la pose de l’implant ; test de contact positif en ce qui concerne les composants de l’implant ; et résolution complète après retrait de l’implant. Les critères secondaires sont les suivants : dermatite résistant au traitement ; réaction systémique de DCA (dermatite de contact allergique) ; physiopathologie de DCA et test de transformation lymphoblastique positif en ce qui concerne le métal. À noter que les irritants sont le nickel (20 % de sensibilisations), le chrome (10 %) et le cobalt (10 %), qui sont présents dans presque tous les alliages de métaux :
- l’acier inoxydable (19 % chrome, 9-33 % nickel en plus du molybdène, du carbone et de l’azote) ;
- le Co-Cro-Mo (67 % chrome, 30 % cobalt, 2 % molybdène et 1 % nickel) ;
- les alliages de titane (91 % titane, 5 % aluminium, 3,9 % vadanium et 0,1 % nickel).
Autres composés : méthacrylate, peroxyde de benzoyle, N-N-dyméthyl-p-toluidine (accélérateur), garamycine et hydroquinone. Il est important de connaître ces composés, car ils influencent la conduite à tenir. Dans le cadre d’une étude, 31 patients ont effectué un test avant la chirurgie uniquement lorsqu’ils présentaient des antécédents d’allergie à des métaux (21 positifs, pour lesquels l’implant était choisi en fonction des résultats). 41 autres patients ont effectué le test lorsqu’ils présentaient des symptômes après la chirurgie : seuls 10 ont présenté un résultat positif ; chez 6 de ces patients, l’implant a été retiré, à la suite de quoi une amélioration a été observée ; les 4 autres patients ont refusé de retirer l’implant. Il est très important de préciser que le test réalisé avant la chirurgie indiquait quelles substances étaient allergènes, sans pour autant prédire l’allergie future. De même, le test effectué après la chirurgie ne signifiait pas nécessairement que la DCA était responsable de l’échec de l’implant. Lorsque l’implant ne peut pas être retiré, des corticoïdes systémiques sont prescrits pendant 21 jours, en sachant qu’une immunotolérance biologique est souvent observée à mesure que le corps s’adapte au traitement.
Écouter les patients : enseignements tirés de l’unité pour l’étude de la dermatite de contact Dr Ana M. Gimenez
Le Dr Ana M. Gimenez a expliqué qu’il est souvent difficile de démontrer objectivement la cause de la DCA, car la plupart des tests standards n’incluent pas les composés détectés lors d'un interrogatoire minutieux. Elle nous a d’ailleurs présenté des cas dans lesquels l’origine de la dermatite avait été
identifiée à l’issue d’un véritable travail d’enquête. Elle nous a parlé d’un difumarate présent dans des sachets de dessiccants placés à l’intérieur des canapés et des boîtes de chaussures, et provenant de Chine. En Europe, cette substance a déclenché une épidémie qui a conduit à demander des restrictions commerciales. Autre cas intéressant : du 2,4-dichlorophénol présent dans un bikini qui a provoqué des réactions urticariennes. Elle a également évoqué des réactions après des vaccins Moderna et Pfizer (ARNm), plus particulièrement le « bras COVID », dans le cadre duquel les patch- tests sont négatifs, mais l’intradermoréaction est positive au polyéthylène glycol. Pour terminer, elle a commenté le cas du Myolastan (tétrazepam), qui a dû être retiré du marché après des affections sévères chez le personnel d’entretien des machines, exposés à des résidus de produit en suspension dans l’air.
Prévention des dermatoses professionnelles chez les professionnels de santé dans le contexte de la pandémie de COVID-19
Dr Juan Pedro Russo
Le Dr Juan Pedro Russo nous a montré les conséquences de l’utilisation des équipements de protection individuelle (EPI) et nous a recommandé d’identifier les zones les plus exposées au contact afin de vérifier la présence de douleurs ou d’érythèmes qui ne pâlissent pas. L’objectif est de prévenir les lésions de pression en retirant les équipements après 4 heures et en appliquant une crème hydratante ou à base de silicone une heure avant le port de ces EPI. En cas d’érythème qui ne pâlit pas, appliquer un pansement hydrocolloïde. Pour prévenir l’aggravation de la rosacée : hygiène cutanée, réparation de la barrière cutanée à l’aide de produits qui ne provoquent pas de sensibilisation, sans parfum ni conservateurs, maîtrise et traitement de la réactivité vasculaire et maîtrise de la réponse inflammatoire. De même, pour la dermatite au niveau des mains, éviter une eau très chaude, préférer les solutions alcooliques sous forme de gel riche en glycérine, les hydratants riches en émollients et sans conservateurs, et les gants en vinyle/nitrite.
Orateurs : Dr Phillip TSCHANDL
Article rédigé par Dr Silvina MALDONADO
Dr Phillip Tschandl
Le Dr Phillip Tschandl nous a livré une présentation très intéressante concernant les avantages et les inconvénients de l’intelligence artificielle (IA) en dermatologie. Il a décrit différentes études qui ont finalement démontré que les algorithmes existants peuvent être très utiles, particulièrement pour l’enseignement à destination des jeunes médecins. En revanche, quand ils sont utilisés par la population générale, ils donnent lieu à des faux positifs et génèrent une grande anxiété chez les patients, tout en augmentant le coût de la santé. « La machine voit uniquement ce qu’elle connaît » : elle établit des diagnostics uniquement en fonction des données qui lui ont été fournies. Son utilisation dans la dermoscopie à l’aide de dispositifs à domicile n’est pas utile si le patient ne parvient pas à réaliser un cliché convenable de la lésion : elle est utile quand elle est utilisée par des dermatologues aguerris, mais pas quand elle est utilisée par des patients. Une étude allemande a montré que comparativement au diagnostic établi par des dermatologues expérimentés, l’utilisation de l’IA en tant que second avis produisait les même données, ce qui est très utile face aux malignités. Pour le suivi via l’imagerie et la cartographie du corps entier, l’avenir semble prometteur, comme pour la microscopie confocale. En conclusion, il apparaît clairement que l’intelligence artificielle nous facilite la vie, mais son bénéfice n’a pas été démontré par des études prospectives.
Pour terminer, le Dr Tschandl nous a invités à découvrir DERMONAUT.
Orateurs : Dr Agustina Zambernardi, Dr, Vania Diaz Perrez, Dr Ianina Massimo, Dr Ana Buongermini, Dr Claudia Suarez, Dr Cristina Carrera
Article rédigé par Dr Silvina MALDONADO
Approche face à une suspicion de pharmacodermie Dr Agustina Zambernardi
Le Dr Zambernardi a brièvement passé en revue les pharmacodermies, qu’elle a qualifiées d’« autre grande simulatrice » en raison de leus multiples formes. Elle a ensuite évoqué la stratégie pratique,
pour finalement se concentrer sur les outils actuels et en cours de développement. Pour ce qui est de la stratégie, le type de lésion prédominante a son importance afin de pouvoir envisager la physiopathogenèse : par exemple, l’urticaire évoque une réaction immédiate via des médiateurs préformés (exposition au cours des 6 dernières heures), tandis que les exanthèmes maculo- papuleux/SDRIFE (exanthème intertrigineux et flexural symétrique d’origine médicamenteuse)/en cocarde/pétéchies doivent évoquer une action à retardement (plus de 3 jours). Le Dr Zambernardi a présenté plusieurs cas cliniques, ainsi que le cheminement pour arriver à la suspicion et la confirmation du diagnostic, en évaluant systématiquement la sévérité et en agissant par rapport au diagnostic présumé, sans attendre la confirmation. Pour ce qui est de savoir s’il est intéressant d’identifier l’élément déclencheur, en sachant qu’il s’agit souvent de patients polymédiqués, elle a suggéré d’attendre 4-6 semaines après la résolution complète, et de procéder à des tests seulement lorsqu’il existe encore un doute, qu’il n’existe pas d’alternative efficace et que le rapport bénéfice/risque est favorable, en sachant que le patient doit ne prendre aucun traitement. Les outils en cours de développement sont les biomarqueurs génomiques, pronostiques et diagnostiques. Les HLA posent une difficulté : il n’est pas toujours possible de les extrapoler à toute la population ; les protéines circulantes comme les CRP ne sont pas spécifiques et les autres sont à l’étude.
DRESS (réaction d’hypersensibilité médicamenteuse se manifestant par une éosinophilie et des symptômes systémiques)
Dr Vania Diaz Perez
Le Dr Vania Diaz Perez a évoqué le DRESS (réaction d’hypersensibilité médicamenteuse se manifestant par une éosinophilie et des symptômes systémiques), qui peut être mortel et qui touche la peau et les viscères. Pour ce qui est de la pathogenèse, elle a parlé du lien avec la mise en place
de certains traitements, avant d’évoquer le métabolisme incomplet de ces traitements, l’accumulation de métabolites réactifs et la réactivation du virus de l’herpès, particulièrement le HHV6, dont la présence n’est pas une condition sine qua non, mais constitue un facteur aggravant qui entraîne un tableau prolongé et fluctuant. Il existe une prédisposition génétique, avec des mutations au niveau des gènes chargés de codifier les enzymes qui interviennent dans le métabolisme des médicaments (comme le cytochrome P450 et l’acétyltransférase). Résultat : l’accumulation du traitement ou de ses métabolites toxiques interagit avec les protéines ou peptides cellulaires, ce qui provoque des réponses immunitaires et des réactions d’hypersensibilité. Parmi les traitements concernés, le Dr Diaz Perez a plus particulièrement évoqué les anticonvulsivants, les antibiotiques, les antirétroviraux et les analgésiques/antipyrétiques. Elle a insisté sur l’apparition tardive (3 semaines après la mise en place du traitement), l’évolution prolongée pouvant durer 1 an et la période de latence plus longue que le
SSJ/le NET/la PEAG, ainsi que l’éruption constante et l’exanthème maculopapuleux sous l’effet des médicaments. Les facteurs de risque d’une évolution prolongée sont les suivants : niveaux élevés de lymphocytes basaux et d’enzymes hépatiques, réactivation de certains HHV. Les récidives sont généralement plus légères et peuvent également être dues à un traitement dont la structure est totalement différente, mais on ignore par quel mécanisme. Pour ce qui est des critères diagnostiques, elle a évoqué RegiSCAR et DIHS, en précisant que ces registres sont presque identiques, à ceci près que le DIHS inclut le HHV6. Pour ce qui est du pronostic, elle a expliqué que le taux de mortalité est de 10 %, avant d’évoquer les comorbidités et les maladies auto-immunes 1 à 2 mois après un
DRESS, en sachant qu’il existe probablement un lien avec la réactivation du HHV6. Sur le plan de
l’histopathologie, elle a mis en avant plusieurs schémas qui ne sont pas spécifiques, mais dans 50 à 60 % des cas, on observe la coexistence de deux schémas ou plus. Le traitement consiste à arrêter immédiatement le médicament en question et à administrer des corticoïdes systémiques (qui restent le principal outil thérapeutique, malgré leurs complications). Bien qu’il n’existe aucune recommandation quant à la sévérité à partir de laquelle ce traitement est indiqué, il est recommandé quand les transaminases sont multipliées par 5 ou quand d’autres organes sont touchés. Il convient par ailleurs d’envisager des soins de soutien, des IgIV, des immunosuppresseurs et du ganciclovir.
Nécrolyse épidermique toxique (NET) Dr Ianina Massimo
Le Dr Massimo nous a présenté des cas cliniques, notamment un enfant qui a développé un DRESS induit par des anticonvulsivants et qui a bien répondu au traitement, mais par la suite, alors qu’elle continuait de lui administrer le traitement, sa maman a elle-même développé une NET qui s’est avérée mortelle. Le Dr Massimo a souligné l’importance de la prise en charge précoce en réanimation, par des professionnels qualifiés, l’importance de l’état de santé antérieur, l’éviction rapide du traitement concerné, le traitement et le soutien, ainsi que la surveillance des infections.
Les pharmacodermies chez l’enfant : cas cliniques Dr Ana Buongermini
Les pédiatres voient très fréquemment des réactions indésirables médicamenteuses dans leur activité quotidienne, la peau étant l’organe touché dans 35 % des cas. Ces réactions sont majoritairement
légères et disparaissent quand le traitement responsable est retiré. Il existe toutefois des cas graves. Les mécanismes physiopathologiques et les manifestations morphologiques sont divers ; les exanthèmes sont la présentation la plus fréquente et sont compliqués à diagnostiquer chez l’enfant, car ils peuvent s’apparenter à d’autres éruptions fréquentes à ce stade de la vie, d’où le rôle
important du dermatologue.
Avancées dans l’étude des réactions indésirables cutanées graves après la prise de médicaments
Dr Claudia Suarez
Le Dr Claudia Suarez nous a parlé des avancées dans l’étude des réactions indésirables cutanées graves après la prise de médicaments, notamment le SSJ/NET, dont la pathogenèse n’est pas complètement comprise, mais qui semble être une réponse des lymphocytes T CD8+ cytotoxiques spécifiques dans le contexte du CMH de classe I. Ce phénomène entraîne une apoptose et une nécrose massive des kératinocytes, un faible niveau de lymphocytes cytotoxiques dans la peau et la présence de médiateurs solubles mesurables (biomarqueurs). Les biomarqueurs qui entraînent une APOPTOSE sont les suivants :
1) le ligand de Fas soluble, qui présente une augmentation précoce et une baisse rapide (mais qui n’augmente pas dans les réactions indésirables médicamenteuses communes) ;
2) la perforine et la granzyme B (marqueurs fiables de SSJ/NET), qui présentent une augmentation précoce dans le sérum/les vésicules et qui sont liées à la sévérité de la réaction indésirable cutanée. L’inhibition de ces biomarqueurs atténue l’effet cytotoxique des lymphocytes dans les cloques en cas de NET. C’est pourquoi ils sont une cible potentielle du traitement ;
3) la granulysine, qui présente une expression précoce et une baisse rapide. Son niveau dans le plasma et les vésicules est lié au degré de sévérité et il est associé à une perte aiguë de la vision. Ce biomarqueur peut être rapidement vérifié par chromatographie, ce qui est plus pratique ;
4) le micro-ARN (miARN) a un rôle peu clair ;
5) la galectine, qui joue un rôle à la fois pro et anti-apoptose. Son niveau sérique augmente en cas de SSJ/NET et baisse quand la maladie est traitée, ce qui permet de mesurer l’activité, mais elle n’est pas spécifique. Les biomarqueurs qui entraînent une NÉCROPTOSE sont les suivants : l’annexine
A1, cible potentielle pour le traitement et RIP3 lié à l’activité et la sévérité de la réaction, qui permet également de surveiller la réponse au traitement. Autres cytokines et biomarqueurs : HMCB1, IL15 (facteur pronostique et cible potentielle pour le traitement), IL 13, IL6, TNF alfa, IP10 et S100A2. Les biomarqueurs aident donc à comprendre la physiopathologie, ce qui est utile pour poser un diagnostic précoce, mais aussi déterminer le degré de sévérité, la réponse aux traitements et le phénotype ; ils
aident par ailleurs à développer de nouveaux traitements, en sachant qu’il peut être nécessaire de les combiner.
Ce que les dermatologues doivent savoir concernant les réactions indésirables aux nouvelles immunothérapies dans le traitement du cancer
Dr Cristina Carrera
Dans le traitement du cancer, l’immunothérapie active l’immunotolérance, et donc les « ite ». Rien qu’aux États-Unis, 50 % de la population atteinte de différents types de cancers devraient recevoir une immunothérapie. Une étude montre que 50 % des patients atteints d’un mélanome présentent une toxicité globale (durée médiane 125 jours) d’abord sur le plan gastrointestinal, puis sur le plan cutané et hépatobiliaire, entre autres, toxicité qui se maintient dans le temps. Les effets indésirables à médiation immunitaire peuvent apparaître à tout moment, même après l’arrêt du traitement. Ils touchent plus fréquemment la peau et c’est pourquoi il faut savoir les identifier. Le Dr Carrera a présenté plusieurs cas : exanthème morbiliforme/dermatite spongiotique, maladies auto-immunes du tissu conjonctif (DM, LES, SSJ, etc.), dépigmentations semblable à un vitiligo, éruptions semblables à un lichen plan, psoriasis rupioïde, dermatoses bulleuses auto-immunes induites par un anti-PD1, et sacoïdoses. Il est possible que les effets indésirables soient le signe d’un pronostic plus favorable, mais pas les formes intenses, plus sévères.
Orateurs : Dr Cristina Santana, Dr Roberto Alas, Dr Luisa Gonzalez, Dr Emerson Andrade
Article rédigé par Dr Silvina MALDONADO
Différents soins face aux cicatrices Dr Cristina Santana
Le Dr Cristina Santana nous a parlé de différents soins face aux cicatrices, soins qu’elle a passés en revue sur le plan clinique. Elle a recommandé de respecter les lignes de tension du corps, auxquelles il convient de prendre soin dès le début de la prise en charge, en informant le patient des options thérapeutiques.
Approche traditionnelle dans le traitement des cicatrices Dr Roberto Alas
Le Dr Roberto Alas a évoqué l’approche traditionnelle dans le traitement des cicatrices. Pour ce qui est de la prévention, il convient de choisir la bonne technique d’incision pour réduire la tension au niveau de la peau, en suivant les lignes de relâchement, puis d’adopter un type de suture adapté. En cas de petite cicatrice chéloïde, utiliser ensuite des infiltrations ou une pressothérapie face à une cicatrice plus importante, et enfin prescrire des adjuvants. La toxine botulique se montre efficace dans l’inhibition de l’hyperplasie cicatricielle lorsqu’elle est appliquée tout de suite après la suture (3-5 U), auquel cas elle améliore l’aspect de la cicatrice. Concernant la prise en charge à domicile, le Dr Alas suggère d’utiliser des bandes de silicone. À la question « Comment procéder pour corriger les cicatrices ? », il a évoqué les approches traditionnelles : TCA, 5-FU, TGF bêta 3, cryothérapie, laser CO2 fractionné et picolaser 532/1 064 nm, tixel (ablation thermomécanique), microneedling (électromécanique) et administration de médicaments assistée par laser. Le Dr Alas a montré
l’infiltration d’un mélange de TAC 40 % (1/3), Meso CIT K (1/3), à savoir un TFG bêta 3, inhibiteur de la voie TGF bêta/ SMAD et lidocaïne 2 % (1/3). Un autre mélange associe en proportions égales de
l’ivermectine 1 % (inhibiteur des fibroblastes) et de la lidocaïne 2 %. Ce mélange permet de répéter la procédure sans neurotoxicité associée. À noter que le Dr Alas utilise une molécule à usage
vétérinaire, car la forme injectable n’est pas disponible dans son pays. En conclusion, il a affirmé que l’association de plusieurs traitements/procédures est la meilleure option.
Cicatrices présentant une approche difficile Dr Luisa Gonzalez
Le Dr Luisa Gonzalez nous a parlé des cicatrices présentant une approche difficile, avant de passer en revue des cas cliniques.
Induction percutanée de collagène (IPC) par microneedling Dr Emerson Andrade
Le Dr Emerson Andrade a évoqué l’induction percutanée de collagène (IPC) par microneedling, qui produit une libération de plaquettes et d’érythrocytes, puis de TGF alpha 1, TGF bêta 3, PDGF, FGF et VEGF. Ce traitement entraîne une formation de pétéchies/purpura ainsi qu’une chimiotaxie qui dure plusieurs minutes, voire plusieurs jours, et une invasion de cellules inflammatoires. Il est indiqué dans les cas suivants : flaccidité, cicatrices hyperpigmentées, cicatrices d’acné, tatouages accidentels par contact avec l’asphalte, mélasma (hausse de la cinétique de multiplication des kératinocytes). Le protocole LIMA est utilisé : anesthésie à la lidocaïne liposomale 1 heure avant la procédure, aiguille modérée de 1,5 mm provoquant un érythème diffus, tous les 30 jours, au minimum deux procédures et reprise du traitement dépigmentant après 24 heures. Le Dr Andrade a également parlé d’une technique de subcision (tunnélisation dermique) face aux cicatrices d’acné et autres dépressions ; cette technique est associée à l’IPC en cas de rides profondes pour lesquelles les comblements sont
inefficaces. Le Dr Andrade nous a présenté des cas dans lesquels un microneedling profond était pratiqué après une administration de phénol 88 %. Enfin, il a évoqué l’utilisation du FRAXX multi- aiguilles dans les cas suivants : lésions rétractiles, flaccidité et pigmentation au niveau des paupières, rides pectorales et cicatrices dystrophiques post-greffe.
Orateurs : Dr Claudia Marchitelli, Dr Juanita Benedetto, Dr Mirtha Cifuentes
Article rédigé par Dr Josephina Marco Bonnet
Pathologie des muqueuses
Les Neoplasies Intra-Epitheliales Vulvaires (VIN) Dr Claudia Marchitelli
Parmi les VIN, il y a 2 groupes.
1- Les liés à l’HPV : VIN classique
a- La lésion intraépithéliale squameuse de bas grade (LSIL)
Pas de traitement, car il n’y a aucun risque de dégénérescence. Elles peuvent même disparaître en 2 à 3 ans spontanément.
b- La lésion intraépithéliale squameuse de haut grade (HSIL)
- Souvent chez des jeunes, plus fréquent
- Multifocale, avec des lésions pouvant être grisâtre, rouge, blanche, rosée et pouvant toucher la vulve, le périnée, le vagin, le col et l’anus
- L’anatomie vulvaire est respectée.
- De bon pronostic, donc il faut privilégier les traitements conservateurs (Imiquimod, laser CO2).
L’imiquimod (3 fois par semaine) peut être utilisé 16 semaines et plus, jusqu’à disparition des lésions.
2- Les liés au lichen scléreux (LS) : VIN différenciée
- Chez des patientes plus âgées
- Unifocale, blanc
- L’anatomie vulvaire est altérée.
- C’est le précurseur des carcinomes vulvaires (environ en 2 ans).
- Le traitement est chirurgical (marge de 5 mm) puis suivi clinique tous les 6 mois pendant 5 ans. Si les LS sont traités, on diminue le risque d’apparition des VIN différenciée.
Manifestations orales des maladies auto-immunes Dr Juanita Benedetto
La gingivite desquamative
- Erythème et œdème gingival léger
- Aggravée par la diminution de l’hygiène bucco-dentaire secondaire à la douleur (augmentation de la plaque dentaire, augmentation des médiateurs de l’inflammation comme TNF alpha, IL1, aggravation de la pathologie)
- Il faut distinguer les 1- GD intermittentes
· Erythèmes multiformes (lésions érythémateuses, érosives, ulcérées, à bords irréguliers, sur l’ensemble de la muqueuse) d’origine infectieuse (90 %) ou médicamenteuses
· Stomatites de contact (lésions localisées, kératinisées, érosives, lichénoïdes)
2- GD persistantes qui sont celles qui sont dues aux pathologies inflammatoires et auto immunes
· Lichen Plan ou érosif
· Pemphigus vulgaire : les lésions muqueuses sont les premières à apparaître et à disparaître. Elles sont dues à la desmogléine 3.
· Pemphigus paranéoplasique : les atteintes de la muqueuse orale sont plus sévères. On retrouve des anticorps anti-envoplakine, periplakine et des alpha 2 macroglobulines 1. Il faut rechercher des
lymphomes nom Hodgkiniens (42 %), LLC (29 %), maladie de Castleman (10 %), adénocarcinomes. 10 % n’ont pas de cancer retrouvé au moment du diagnostic.
· Pemphigoïde des muqueuses : 85 % d’atteinte buccale.
· Epidermolyse bulleuse acquise (anticorps anti collagène VII)
· GVH
· Dermatose bulleuse linéaire à IgA
Il faut faire des biopsies avec IFD, IFIF, des ELISA pour les pathologies bulleuses.
Stomatite de contact allergique Dr Mirtha Cifuentes
1- Quand évoquer une stomatite de contact ?
- S’il y a des lésions lichénoïdes ou des lésions de stomatite réfractaires aux traitements. Si la lésion est unilatérale. S’il y a des antécédents d’allergie.
- S’il y a une relation anatomique entre les lésions et un matériel suspect (contact direct ou moins d’un centimètre).
- Si les symptômes sont chronologiquement associés à l’exposition de l’allergène. 2- CAT
- Faire un test d’élimination et de réintroduction
- Pas de biopsie
- Faire des patch test, des RAST
3- Les allergènes les plus fréquents
- Les métaux présents dans les appareils, les amalgames : mercure, nickel, cuivre, zinc, chrome, cobalt, or, argent
- Les conservateurs (benzoate de sodium, propilène glycol, parabens, formaldéhyde), les antiseptiques (chlorhexidine, triclosan, peroxyde d’hydrogène), les détergents (lauril sulfate de sodium) et les blanchisseurs contenus dans les dentifrices et bains de bouche
4- Traitement
- Éviction de l’allergène. Ce n’est pas toujours facile, il faut travailler avec des équipes de dentiste. Les lésions disparaissent dans 37 à 100 % des cas.
- Localement, on peut proposer des corticoïdes locaux et du tacrolimus local.
Orateurs : Dr Meire Parada, Dr Vanessa Piquero
Article rédigé par Dr Josephina Marco Bonnet
Complications tardives des acides hyaluroniques (AH) Dr Meire Parada
Ce type de complications apparaît plus de 30 jours après l’injection d’AH.
On distingue les œdèmes, les nodules inflammatoires, les nodules non-inflammatoires, les infections, les granulomes et les biofilms.
1- L’œdème par obstruction lymphatique
C’est un œdème précoce, indolore, le plus souvent au niveau malaire suite à des injections de la vallée des larmes (environ 2 %). Afin de l’éviter, il faut interroger nos patients et ne pas injecter cette zone chez les patientes ayant un œdème palpébral le matin au lever.
2- L’œdème tardif intermittent et persistant (ETIP)
C’est un œdème tardif, matinal et inflammatoire de la paupière inférieure et de la région malaire. A la palpation, il n’y a pas de nodule. A l’échographie, il y a un aspect de panniculite.
Il faut rechercher des facteurs déclenchants comme un syndrome grippal, une infection des voies aériennes supérieurs, des sinus, une infection dentaire, un traumatisme, une infection COVID ou une vaccination anti COVID.
Le traitement consiste en l’injection de hyaluronidase, parfois échoguidée.
3- Les nodules non-inflammatoires sont le plus souvent secondaire à l’accumulation d’AH. Le traitement consiste en des massages et l’injection de hyaluronidase à l’aiguille ou à la canule. 4- Les nodules inflammatoires sont d’origine infectieuses.
- S’ils sont petits, on propose un traitement antibiotique (Clarithromycone 500mg 2x/j ou Doxycycline 100mg 2x/j ou clindamycine 600mg) et l’on réévalue le patient à 48h.
- Les nodules fluctuants, doivent être drainer et mis en culture du produit obtenu pour avoir un antibiogramme. En attendant les résultats, mise en route d’une antibiothérapie probabiliste comme vu précédemment. Si insuffisant on peut y associer dans un second temps de la hyaluronidase.
- Les nodules inflammatoires fixes doivent bénéficier d’une échographie +/-une aspiration à l’aiguille ou une biopsie au bistouri si possible ou un punch de 4mm. La biopsie permettra de voir le produit responsable, s’il y a une réaction granulomateuse, un processus allergique, une infection ou un biofilm. Le traitement associe les antibiotiques, la hyaluronidase, les corticoïdes oraux ou en intra
lésionnels (IL), 5FU (IL) et chirurge.
5- Les nodules inflammatoires et Biofilm se traite avec Clarithromycone 500mg 2x/j ou Doxycycline 100mg 2x/j pendant 10j. Si insuffisant, un traitement par Ciprofloxacine (500mg 2x/j) ou Moxifloxacine (400mg/j) peut être proposé.
6- Les granulomes.
Il faut toujours faire une biopsie, car le diagnostic est histologique. Le traitement consiste en une corticothérapie par voie orale (0,5 à 1mg/kg/j) ou en IL (5-10mg/cc) ou l’association 5FU +corticoïdes en IL (5FU 50mg/ml 0,5ml + triamcinolone 10mg/ml 0,3ml + lidocaïne 0,2ml).
Pathologies auto immune et comblement Dr Vanessa Piquero
Il y n’y a pas beaucoup de données. Il faut être prudent.
Le patient doit être informé oralement et sur son consentement éclairé des risques immunologiques des injections de comblement avec les vaccins, le COVID et les maladies auto immunes.
Il faut détecter les patients à risques de développer un syndrome inflammatoire auto-immun induit par des adjuvants (ASIA) ou des réactions inflammatoires tardives, par l’interrogatoire, la biologie et dans le futur des typages HLA. Le syndrome ASIA est déclenché chez des patients génétiquement prédisposés (HLA B8 ou DRB1). Les biomatériaux peuvent provoquer chez ces patients une réponse immune tardive, voir des réactions granulomateuses ou auto immune. Elle est aggravée par les traumatismes locaux, les infections, les vaccins, les amalgames dentaires et les menstruations.
Chez des patients à risque, le Lisinopril (inhibiteur ECA) a montré une efficacité, en diminuant les risques de réactions tardives. On peut donc le proposer en pré vaccinal, chez ces patients.
Le comblement chez ces patients doit être à la canule, avec des AH de haut poids moléculaire (moins immunogène) et en quantité peu importante.
La pathologie auto immune doit être inactive sans traitement. Des IDR sont faisables, mais elles devront être relues à 1 et 3 mois.
On pense qu’il faut attendre entre 2 à 4 semaines entre les injections AH et la vaccination anti-
COVID. Si le patient a des risques plus élevés de réactions inflammatoires, le temps d’attente doit être supérieure (4 à 8 semaines). Le traitement des complications est le même que pour les causes non-COVID.
Orateurs : Dr Bertrand Richert
Article rédigé par Dr Josephina Marco Bonnet
Dr Bertrand Richert
Il s’agit d’une dystrophie de l’ongle du gros orteil (GO), présent dès la naissance et s’aggravant sur la première année de vie. L’ongle a un aspect triangulaire, hyperkératosique, de couleur verdâtre et avec de nombreuses striations transversales. C’est indolore.
Les filles semblent plus souvent atteintes et l’ongle le plus touché est le GO droit. CAT :
- Suivre les enfants avec des photos sur 5 ans.
- Rassurer les parents, car une disparition spontanée est fréquente.
- S’il n’y a pas d’amélioration après 5 ans, une chirurgie doit être proposée. On obtient 90 % de réussite, quelque soit de degré de déviation ou l’âge de la chirurgie…
- Avertir les parents qu’il y a 10 % de non-répondeur à la chirurgie. Aucun facteur pouvant expliquer la non-réponse, n’a été mis en évidence. Il semble que les garçons soient de meilleurs répondeurs.
Orateurs : Dr Maria Teresa Molina
Article rédigé par Dr Josephina Marco Bonnet
Diététique et acne
Dr Maria Teresa Molina
L’acné est une pathologie polyfactorielle. La diète occidentale est un facteur aggravant chez certains de nos patients. Une prise en charge globale est nécessaire.
Sur le plan physiopathologique, deux acteurs expliquent l’impact de l’alimentation sur notre peau : le FoxO1 (Forhead box class O transciption factor) et mTORC1 (Mammalian target of rapamycine complex1). FoxO1 contrôle la voie de signalisation de mTORC1.
FoxO1 est présent dans les glandes sébacées et elle a une action sur l’immunité, la prolifération cellulaire, l’apoptose, la lipogénèse, l’inflammation et l’effet anti-oxydant.
mTORC1 stimule la prolifération et la différenciation cellulaire, l’hyperplasie des glandes sébacées, la lipogénèse sébacée et promeut la production de sébum. Il joue un rôle important dans le vieillissement prématuré et dans toutes les pathologies civilisationnelles (acné, obésité, résistance à
l’insuline, diabète type 2, maladie d’Alzheimer et cancer).
La diète occidentale stimule des facteurs de croissance comme l’IGF 1 (insuline grow factor 1),
l’approvisionnement en énergie cellulaire (glucose), les aminoacides (leucine), glutamine et les acides gras saturés (acide palmitique). Ces facteurs stimulent la voie mTORC1.
Trois familles alimentaires diminuent l’activité de FoxO1 et activent la voie mTORC1. Il s’agit :
- des glucides hyperglycémiants
- du lait et des produits laitiers
- des graisses saturées.
Certaines études semblent montrer que les patients atteints d’acné sévère, ont un taux de vitamine D inférieur à celui du groupe contrôle. La vitamine D joue un rôle dans la régulation des systèmes
immunitaires innés et acquis, dans la prolifération des sébocytes et des kératinocytes. Elle a également un effet anticomédonien et antioxydant.
Les prébiotiques sont des substances alimentaires composées généralement de sucres liés connus sous le vocable d'oligosaccharides et de polysaccharides à courte chaîne, qui ne se digèrent pas. Ils fermentent au niveau du tube digestif et sont un aliment pour le microbiome intestinal. Les aliments riches en prébiotiques sont les tomates, les artichauts, les oignons, l’ail, la roquette, les poireaux, les asperges, les fruits rouges, les bananes, l’avoine et les légumineuses.
Les probiotiques peuvent aussi avoir un rôle à jouer, mais pour l’instant les études sont insuffisantes.
En résumé
1- Avoir des apports caloriques équilibrés 2- Eviter les glucides raffinés
3- Eviter les apports de leucine (lait et viande) et de Glutamine (lait) 4- Eviter les aliments transformés (graisses saturées)
5- Arrêter les compléments alimentaires à base de protéines de lait (WHEY)
6- Consommer des légumes, des légumineuses, des fruits avec un index glycémique bas et des poissons riches en oméga-3
7- Consommer des inhibiteurs naturels de mTORC (thé vert, curcuma, soja, fruits rouges)
8- Consommer des probiotiques naturels (pain au levain, cacao amer, vinaigre de pomme, miso, kimchi, choucroute, kombucha)
9- Si acné sévère ou résistante, faire le dosage de la vitamine D
Microbiome cutanée et acné Dr Santos Muñoz Andrea
Le microbiome est un écosystème d’organismes invisibles qui vivent en symbiose avec nous. Il existe 4 microbiomes : le gastro-intestinal, le pulmonaire, l’urogénital et le cutané. Chaque microbiome est unique comme les empreintes.
Le microbiome cutané est composé de 1 million de bactéries par centimètre carré de peau. Il y a 10 fois plus de bactéries que de cellules et plus de 1000 espèces bactériennes qui codent 150 fois plus de gènes que le génome humain. Il a un rôle de régulation dans la réponse immunitaire et de protection vis-à-vis des germes pathologiques. Le microbiome est influencé par des facteurs
intrinsèques (génétique) et des facteurs extrinsèques (alimentation, lieu de vie, cosmétiques, soleil...).
Le microbiote intestinal peut également influencer les pathologies cutanées, en envoyer des signaux inflammatoires par voie sanguine.
Dans l’acné, les anomalies du microbiome cutané observées sont :
- La transformatiom d’un Cutibacterium (C) acnes de type II et III (peau saine) en un C. acnes de type I qui stimule la voie Th1 et TH17.
- Le Staphylocoque épidermidis diminue ce qui augmente le biofilm du C. acnes. On a donc un C. acnes plus virulent, plus résistant aux antibiotiques et une survie augmentée.
- Le Malassezia est suspecté d’avoir un rôle dans les acnés résistantes.
Quoi faire ?
1- Améliorer son alimentation pour avoir un microbiome digestif non inflammatoire (voir diète et acné). 2- Ne plus utiliser d’antibiotiques locaux pour éviter de détruire le C. acnes et éviter la formation de biofilm. Utiliser le moins possible d’antibiotiques par voie orale.
Orateurs : Dr Aimilios Lallas
Article rédigé par Dr Josephina Marco Bonnet
Dr Aimilios Lallas
La dermoscopie (DSC) des lésions pigmentées du visage est difficile, surtout dans le cas de mélanome peu évolué. En effet la présence de lésions sans structures pigmentées ou bleutées signe des mélanomes invasifs et où le diagnostic est souvent fait cliniquement.
Le Dr Lallas propose un algorithme inversé. S’il n’y a pas un des 6 signes dermoscopiques de lésions bénignes, il faut biopsier pour éliminer un mélanome débutant. Ces structures doivent être majoritaires sur la lésion.
Les signes DSC sont ;
1- Des squames : signe de kératose actinique.
2- White and wide folliculaire (follicules blancs et larges) ou des rosettes : signe de kératose actinique.
3- Erythème ou des vaisseaux réticulés : signe de kératose actinique.
4- Des lignes réticulées ou parallèles (finger prints) : signe de kératose séborrhéique (KS) ou de lentigo.
5- Une bordure nette : signe de KS ou de lentigo. 6- Critères classiques de KS (globules, etc.).
Cette méthode a été testée l'humain versus l'intelligence artificielle et l’humain a gagné. Seule limite à cet algorithme : la kératose lichénoïde.
On peut se poser la question du surdiagnostic. Cependant, un diagnostic précoce permet une prise en charge plus facile, rapide et avec un rendu cicatricielle meilleur pour nos patients.
Orateurs : Dr Henry Lim
Article rédigé par Dr Josephina Marco Bonnet
Dr Henry Lim
Le spectre de la lumière solaire atteignant la terre va des UV à l’infrarouge (IR). Plus on va vers l’IR plus les rayons pénètres en profondeur notre peau (cf. la photo). Les effets de ces rayons sont
différents en fonctions de phototypes et certains ont des effets synergiques entre eux (LV et IR ou LV et UVA).

Photoprotection of the Skin from Visible Light‒Induced Pigmentation: Current Testing Methods
Proposed Harmonization
Henry W.Lim, Indermeet Kohli, Corinne Granger, Carles Trullàs, Jaime Piquero-Casals, Mridvika Narda, Philippe Masson, Jean Krutmann, Thierry Passeron
Journal of Investigative Dermatology Volume 141, Issue 11, November 2021, Pages 2569-2576
Les effets photobiologiques de la lumière solaire sont :
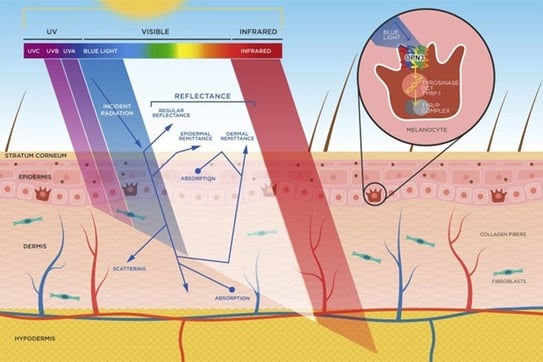
C’est la lumière violette et bleue (LB) qui est responsable des effets de la LV. Elle stimule le récepteur OPSIN 3 sur le mélanocyte, ce qui stimule la tyrosinase et ce qui provoque la pigmentation de la peau. L’UVA 1 a un effet synergique avec la LB. Ils induisent une pigmentation rapide et prolongée dans le temps chez les phototype III à VI.
Sur le plan dermatologique, la LV participe à l’apparition :
- Chez les phototypes foncés de mélasma et de l’hyperpigmentation inflammatoire (HPPI)
- Chez les phototypes clairs d’érythème
- De photodermatoses (urticaire solaire, porphyries cutanées PCT et EPP)
La LV induit des espèces réactives de l’oxygène (ROS) dans la peau et participe donc au vieillissement de la peau.
La LB des appareils électroniques n’induit pas de pigmentation cutanée.
Orateurs : Dr Jaime Piquero, Dr Ninosthka Guillén
Article rédigé par Dr Josephina Marco Bonnet
Photoprotection et hyperpigmentation Dr Jaime Piquero
Les patients de phototype foncé sont plus susceptibles de faire des troubles pigmentaires car leurs mélanosomes sont plus labiles et ils dégradent moins bien la mélanine.
Dans le mélasma on décrit 5 mécanismes physiopathologiques ;
- Activation anormale des mélanocytes
- Agrégation de mélanine et de mélanosomes dans l’épiderme et le derme
- Augmentation du nombre de mastocytes
- Présence d’élastose solaire et altération de la membrane basale
- Augmentation de la vascularisation.
LA LB et les UVA1 jouent un rôle important dans le mélasma.
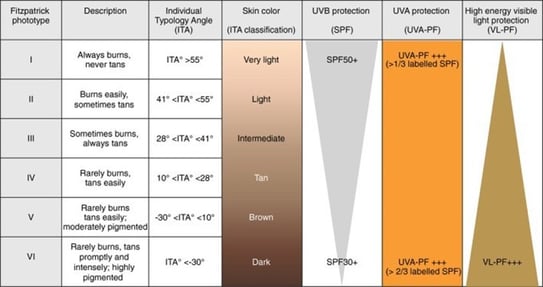
Le solaire idéal des peaux foncées :
- Aurait une formule à base d’eau (plus cosmétique et agréable)
- Ne laisserait pas de résidus blancs sur la peau
- Aurait un spectre large, avec un indice de protection en UVA haut, SPF 30 et actif contre la LV.
- Aurait des anti-oxydants pour diminuer les ROS
- Serait teinté (oxyde de fer surtout) pour protéger de la LV et camoufler les lésions
- Pourrait contenir des dépigmentants (niacinamide, dérivés de résorcinol, etc.).
On a donc besoin de d’un solaire protégeant des UVB, des UVA courts et longs et de la LV. Voici les 6 points à retenir pour choisir votre solaire :
1- Il y a peu de filtres couvrant les UVA long (>400nm) : le mexoryl 400 et le TriAsorB
2- Pour se protéger de la LV, il faut un solaire teinté à base d’oxyde de fer ou d’oxyde de zinc ou de dioxyde de titane teinté. Cela pose des problèmes d’observance, car les produits teintés ne s’adaptent pas à toutes les carnations, ils peuvent être épais et tachent les vêtements. Il n’a pas de
label permettant de connaître le degré de protection contre la LB. Cette adresse permet d’avoir une liste de photoprotecteurs contre la LB avec des indications sur les teintes disponibles (universelle, clair ou foncé) ainsi que le SFP, le prix et d’autre caractéristiques : http://dx.doi.org/10.17632/dtb4y9b684.
3- Il faut un solaire avec des antioxydants comme la niacinamide, licochalcone A, beta carotène, vitamine E, C, acide glycyrrhetinique, diethylhexyl syringylidene malonate (DESM).
4- Il faut penser à la photoprotection orale comme l’extrait de Polypodium leucotomos (PLE) qui améliore la protection contre la LV.
5- Il faut éduquer TOUS nos patients sur la photoprotection du plus clair au plus pigmenté. 6- Il faut adapter nos conseils sur les photoprotecteurs en fonction des phototypes.
Les photoptypes I à III nécessite un SPF 50, UVA 1/3 et une protection contre la LB peu importante. Alors que les phototypes IV à VI, ont besoin d’un solaire avec un SPF plus bas (30) mais couvrant les UVA 2/3(long surtout) et la LB.
Photoprotection according to skin phototype and dermatoses: practical recommendations from an expert panel
T. Passeron, H.W. Lim, C.‐L. Goh, H.Y. Kang, F. Ly, A. Morita, J. Ocampo Candiani, S. Puig, S. Schalka, L. Wei, B. Dréno and J. Krutmann J Eur Acad Dermatol Venereol. 2021 Jul; 35(7): 1460–1469
Photoprotection des zones difficiles : yeux et lèvres Dr Ninosthka Guillén
Trois notions importantes :
- Pour les yeux il faut éviter le soleil entre 8h-10h et 14h-16h. Les rayons du soleil sont parallèles aux yeux et donc plus nuisibles.
- Les lunettes solaires doivent être achetées chez un opticien car les autres peuvent dilater les pupilles et donc laisser passer plus d’UV.
- La photoprotection des lèvres doit être appliquée 6 fois par jour.
Orateurs : Dr Esther Freeman
Article rédigé par Dr Josephina Marco Bonnet
Dr Esther Freeman
Plusieurs notions m’ont paru importante.
1- La réaction cutanée la plus spécifique du vaccin est l’apparition à 7-8 jours d’un placard
inflammatoire sur le site d’injection. Il disparait spontanément en quelques jours. Il peut réapparaître lors des vaccinations de rappel mais plus rapidement (J2-J3) et disparaître plus rapidement aussi.
C’est une réaction d’hypersensibilité retardée et l’on ne sait pas à quoi réagissent les patients. 2- Il n’a eu aucun choc anaphylactique
3- Les réactions cutanées étaient plus fréquentes avec moderna.
4- 43 % des patients ayant eu un effet indésirable cutané lors de la première dose, récidivaient lors des rappels. Les récidives étaient plus précoces et moins importantes.
5- Il y a eu des COVID Toes (engelures) post vaccinal.
6- Des éruptions bulleuses ont été décrites parmi lesquelles des pemphigoïdes bulleuses (PB) confirmées biologiquement et histologiquement. Parmi les PB, 2 sous-groupes de patients sont constatés
· Des patients âgés avec une PB qui évoluaient classiquement. On pense que le vaccin à révéler des PB sous-jacente.
· Des patients jeunes ayant des PB qui disparaissaient rapidement et spontanément.
Orateurs : Dr Justin Endo
Article rédigé par Dr Josephina Marco Bonnet
Dr Justin Endo
Le prurit est un symptôme très fréquent, 78 % des plus de 65 ans s’en plaignent. Il impacte la qualité de vie, il est associé à la dépression, il perturbe le sommeil et diminue la productivité. La physiopathologie du prurit est compliquée.
L’acronyme BINDIS résume pourquoi les patients âgés se grattent :
- Barrier function decline
- Immunosenescence :la voie Th2>Th1
- Neurologic. Il peut s’agir de neuropathies centrales ou périphériques
- Drug-induced. C’est une cause peu fréquente et le plus souvent les molécules en cause sont les inhibiteurs calciques et les thiazidiques.
- Institutuionalization (gâle)
- Systemic disease (pathologies rénales, hépatiques, etc.). Ces pathologies systémiques sont le plus souvent associées entre elles.
Face à un prurit sénile, il faut faire un interrogatoire pour chercher les antécédents de pathologies générales, psychiques, neurologiques. Il faut rechercher la consommation de médicaments et alcool, s’il y a des risques d’IST et s’ils sont exposées à certaines substances dans les activités.
L’examen clinique permet de mettre en évidence :
1- Prurit avec lésions.
Il est plus facile à prendre en charge. Les causes vont de pathologies infectieuses (gale, mycose), aux pathologies inflammatoires (eczéma, psoriasis, Grover), en passant pat les lymphomes cutanées (se méfier des lésions eczématiformes des flancs), les rashs médicamenteux et les pathologies bulleuses (PB).
2- Prurit sine materia.
Il faut penser à :
- la xérose, cause la plus fréquente
- la notalgie paresthésique si le prurit est localisé
- dermographisme
- la pemphigoïde pré-bulleuse
- aux pathologies internes (rein, foie, cancer). L’incidence des cancers est peu importante et il s’agit le plus souvent d’hémopathie ou de cancer de la voie biliaire.
- aux médicaments (statines)
- la cause idiopathique.
Le bilan proposé par le Dr ENDO est le suivant :
- Recherche du sarcopte
- NFS, plaquettes, ionogramme, bilan hépato-réna, bilan thyroïdien, EPP
- Sérologie HIV si personne àrisque
- IFI et IFD
- ELISA BP 180/230.
Sur le plan thérapeutique, il propose :
- Optimiser la fonction barrière de la peau par des hydratants
- Traiter la cause s’il y en a une
- Si le prurit sine materia est localisé : topiques à base de pramoxine, menthol ou lidocaïne. Si
insuffisant des préparations à base de kétamine 0,5 % / amitriptyline 2,5 % (CI sur la muqueuse génitale).
- Pour le prurit sine materia généralisé
· Photothérapie UVB ++++ (si pas de risque de chute et pas de médicaments photosensibilisants)
· Anti histaminique non sédatif que dans le cas de dermographisme
· Gabapentine (100mg/j à utiliser avec précaution)
· Naltrexone à petite dose (1mg jusqu’à 4,5mg/j)
· Antidépresseurs à petite dose (mirtazapine 7,5 mg/j, inhibiteur sélectif de la sérotonine, antidépresseurs tricycliques)
Il n’utilise jamais car trop cher ou donne beaucoup d’effets secondaires :
- Les antihistaminiques de première génération
- Capsaicin
- Cannabis médical
- Thalidomide
- Aprepitant
Certaines molécules semblent prometteuses comme le dupilumimab, les anti JAK et le nemolizumab.
Orateurs : Dr Maria Luisa Perez Cotapos
Article rédigé par Dr Josephina Marco Bonnet
Dr Maria Luisa Perez Cotapos
Magnifique exposé photographique de toutes les modifications corporelles (body art), qui sont en vogue depuis plusieurs années et qui sont de plus en plus impressionnantes. Nous devons connaître ces tendances qui vont de pair avec certaines complications.
Ce qui a attiré mon attention c’est :
- La possibilité de faire des endocardites bactériennes sur des piercings du nombril et du mamelon.
- Le tatouage de plus en plus fréquent des conjonctives. Il n’est pas autorisé aux tatoueurs professionnels. Il est parfois utilisé par les ophtalmologues pour améliorer l’esthétique dans le cadre d’opacification de la corné, d’iridodialisis traumatique. Les risques sont importants car hors ophtalmologue, il est pratiqué sans microscope ophtalmique et sans technique d’aseptie stricte. Ont été décrit des douleurs, une vue floue, de la photophobie, dissémination de l’encre, granulomes, pénétration du globe oculaire, cataractes, décollement de rétine, endophtalmie et cécité.
- L’association tatouage et mélanome. Certains auteurs se demandent si les métabolites des pigments associés aux UV, ne provoquerait pas l’apparition de mélanome.
- Le pigment est rouge est le plus à risque d’allergie et de complication lors des détatouage
- La scarification, brûlures au fer rouge, plaies avec des métaux chauds, des agents chimiques associés à l’application de citron, dentifrice ou tout autre produit empêchant la cicatrisation sont un nouveau pan du body art. Le but étant d’obtenir une cicatrice.
- Les modifications corporelles deviennent de plus en plus extrêmes comme le tatouage des lèvres, de la langue, des langues bifides, des bijoux conjonctivaux, disparition du nombril, implants sous cutanés, l’image des dents pour qu’elles soient pointues, implants d’aimants, etc.
Le body art étant de plus en plus fréquents, les complications le seront également. Nous devons donc connaître ces nouvelles tendances. Nous devons éduquer nos patients sur les risques qu’ils prennent en ayant recourt à ces méthodes. Nous devons militer pour que ces méthodes soient réalisées par des professionnels formés, avec des produits contrôlés et de manière aseptique.


Coup d’œil du congrès EHSF 2022

Coup d’œil du congrès EADO 2022