3 professionals
Coup d’œil du congrès EADV 2024
Coup d’œil du congrès EADV 2024
Améliorez vos connaissances professionnelles en profitant de nombreux services exclusifs dans le domaine de la dermatologie : plus de 500 visuels de pathologies, des cas cliniques, des vidéos d’experts…
Bénéficiez d’options uniques telles que l’offre de contenus audio et de supports à proposer à vos patients.
Restez informé(e) des événements et des webinaires à venir, des dernières publications scientifiques et des innovations produit.
Vous avez déjà un compte ? Se connecter
Rapport rédigé par le Dr Jovan Lalosevic, M.D., Ph.D. (Dermatologue, Serbie), le Dr Nicolas Kluger, M.D., Ph.D. (Dermatologue, Finlande) et le Dr Stella Michelaki, M.D., Ph.D. (Dermatologue, Grèce)
Sujets liés
Session animée par : Prof. Kilian Eyerich et Dr Hok Bing Thio.
Conférenciers : Prof. Kilian Eyerich, Dr Hok Bing Thio, Prof. Hervé Bachelez, Dr Satveer Mahil.
Rapport rédigé par le Dr Jovan Lalosevic, M.D., Ph.D.
Intervenant : Prof. Kilian Eyerich (Fribourg)
Lors de cette session de mise à jour, la première conférence a été donnée par le professeur Eyerich, qui a commencé par définir la modification de la maladie. Afin d’influencer l’évolution de la maladie, il faut connaître les mesures objectives permettant de quantifier les résultats cliniquement significatifs. Dans le cas du psoriasis, le score PASI n’est pas un moyen valable de mesurer l’activité inflammatoire.
Même s’il était possible de mesurer l’activité de la maladie, on aurait alors besoin d’une valeur seuil pour mieux définir si l’on est parvenu à modifier l’évolution de la maladie.
Faisant référence à l’avis des spécialistes concernant les différentes définitions de la lutte contre la maladie, de la rémission et de la modification, le professeur a ajouté que tous s’accordent à dire que la guérison d’une maladie (psoriasis) constitue un effort maximal de modification de la maladie.
Tout comme des facteurs tels que l’origine ethnique, le sexe et l’âge n’ont pas d’incidence sur l’évolution de la maladie, le seul facteur qui en a une et sur lequel on peut influer est la durée de la maladie.
Dans la conférence suivante, le professeur Eyerich a expliqué que l’introduction d’une thérapie biologique lors des premiers stades du psoriasis peut prévenir l’expression de comorbidités systémiques, car, on le sait bien, l’arthrite psoriasique et les complications cardiovasculaires font partie du spectre systémique de cette maladie. En prévenant les comorbidités, on peut en fait modifier l’évolution de la maladie.
On suppose que cet effet est produit en affectant la mémoire des cellules résidentes dans les tissus. Dans la peau, ces cellules diminuent au fil du temps lorsque les patients sont traités à l’aide de produits biologiques. L’effet sur ces cellules résidentes de la mémoire tissulaire est également présent avec d’autres traitements topiques et systémiques, mais les produits biologiques, en tant que thérapie la plus efficace, sont considérés comme les plus sensibles à ce type de mécanisme de modification de la maladie.
Une autre hypothèse suggère est que le mécanisme épigénétique, sous forme de méthylation de l’ADN dans la peau lésionnelle, est normalisé dans le psoriasis nouvellement apparu par rapport aux formes chroniques en plaques.
En conclusion, un profilage plus spécifique des patients est nécessaire afin de trouver l’option thérapeutique la plus efficace ou plutôt pour obtenir un effet maximal sur la modification de l’évolution de la maladie.
Intervenant : Dr Hok Bing Thio (Rotterdam)
Dans la présentation suivante, le Dr Hok Bing Thio a évoqué les différences entre les populations de patients psoriasiques. Dans son exposé, il a indiqué qu’il n’existait aucune différence en termes de prévalence entre les hommes et les femmes, mais qu’il existait des différences en ce qui concerne l’âge d’apparition, avec une prévalence plus élevée chez les adultes que chez les enfants.
Bien que la prévalence dans la population générale soit d’environ 2 %, le Dr Bing Thio a abordé le fait que la prévalence est plus élevée dans les pays économiquement plus développés (pays à hauts revenus), en donnant des exemples de pourcentages plus élevés de patients atteints de psoriasis en Australie, en Europe et en Amérique du Nord. Une prévalence plus faible a été observée en Asie de l’Est, la prévalence la plus faible concernant Taïwan.
En dépit d’un taux de prévalence plus faible, les formes cliniques du psoriasis dans ces pays sont plus sévères, avec des scores PASI et BSA plus élevés. En outre, chez les patients à la peau foncée et les patients asiatiques, les formes cliniques sont différentes, la couleur étant plus intense que l’érythème, qui constitue la caractéristique clinique des patients à la peau claire.
Cette différence d’apparence et de gravité de la maladie peut s’expliquer par la variance de l’expression des allèles de l’antigène leucocytaire humain dans certains groupes ethniques. Par exemple, dans les cas de HLA Cw6, la population générale présente l’expression la plus fréquente. Cependant, dans les cas de HLA Cw1, plus fréquents dans la population asiatique, il y a une incidence plus élevée de psoriasis pustuleux et érythrodermique. Ces différences au niveau de l’expression des gènes entraînent une réponse variable au traitement systémique qu’il convient également de prendre en compte. Outre l’expression des gènes, les déclencheurs du psoriasis peuvent être influencés par la situation géographique (environnement) d’un groupe ethnique particulier, mais aussi par son mode de vie (type d’alimentation, mode de vie, stress).
Les différences de régime alimentaire font varier le microbiome, de sorte que certaines préférences alimentaires peuvent induire une dysbiose et provoquer une inflammation légère mais chronique dans le psoriasis.
Le Dr Bing Thio a ensuite émis l’hypothèse qu’il existe des différences dans l’immunométabolisme, et plus particulièrement dans l’activité mitochondriale, entre les différentes populations, ce qui constitue un facteur important dans l’exacerbation du psoriasis. Il s’est ensuite concentré sur les médicaments susceptibles de moduler l’activité mitochondriale, tels que la metformine et le sémaglutide, et a cité des exemples d’amélioration du psoriasis chez un patient traité par ozempic.
Dans les dernières diapositives de son exposé, il a souligné l’importance de la pollution atmosphérique et son action sur le psoriasis qui modifie également l’activité mitochondriale.
En résumé, on peut donc conclure que les gènes, l’épigénétique, le microbiome et les mitochondries (plus la pollution) sont les principaux facteurs qui ont une incidence sur le psoriasis, mais avec des différences d’expression entre les groupes ethniques.
Intervenant : Prof. Hervé Bachelez (Paris)
Dans son introduction, le Pr Bachelez a émis l’hypothèse de l’existence d’un lien entre le psoriasis en plaques et le psoriasis en pustules. Le fait que près de la moitié des patients atteints de psoriasis pustuleux généralisé avaient déjà souffert de psoriasis en plaques chronique a permis d’établir un lien évident. La même association a été observée chez les patients atteints de psoriasis palmo-plantaire, de psoriasis vulgaire et d’arthrite psoriasique.
Plus précisément, la première association d’expression génique a été établie avec les mutations avec gain de fonction du gène CARD14, qui constituaient des « points névralgiques » chez plus de 60 % des patients atteints de psoriasis vulgaire, de pityriasis rubra pilaire et de psoriasis pustuleux généralisé. Dans les cas de mutations de CARD 14, des éruptions cutanées spontanées de type psoriasis apparaissent en raison d’une réponse accrue des kératinocytes à l’IL17A. Les patients présentant ce type de mutations peuvent également bénéficier de traitements biologiques à base de sécukinumab et d’ustekinumab.
Les mutations de perte de fonction de l’IL36 sont principalement observées dans le psoriasis pustuleux généralisé, mais pas dans le psoriasis en plaques. Par conséquent, les patients atteints de psoriasis pustuleux généralisé qui présentent des mutations de l’IL36 n’ont pas d’antécédents de psoriasis en plaques chronique.
Bien que la la première hypothèse du Pr Bachelez consistait à dire que le psoriasis pustuleux dépendait soit de la voie IL17A, soit de la voie IL36 uniquement, il a toutefois ajouté que cette hypothèse était totalement erronée. Il existe vingt voies immunologiques différentes qui sont les mêmes dans le psoriasis en plaques et le psoriasis en pustules, mais le degré de régulation diffère considérablement entre les deux. Dans sa présentation, le professeur a mis en avant la réponse induite par l’interféron de type I qui s’exprime dans un pourcentage élevé, plus particulièrement dans la pustulose palmo-plantaire, mais également dans le psoriasis vulgaire. Avec cette réponse dominante, les patients sont plus résistants à tout type de thérapie biologique et de thérapie à petites molécules, à l’exception des inhibiteurs de JAK1/TYC2.
Cette approche peut être confirmée par les études menées sur des patients recevant du spésolimab, où moins de 50 % d’entre eux ont vu leurs pustules disparaître complètement, ce qui permet de conclure que le psoriasis pustuleux n’est pas une maladie due uniquement à l’IL36.
Enfin, il a conclu que nous avons besoin de plus de connaissances sur l’expression des gènes et les causes de l’inflammation, ce qui soulève la question de savoir s’il faut modifier la taxonomie (endotype différent des lésions pustuleuses), ouvrant ainsi la voie à davantage d’approches de médecine de précision.
Intervenant : Dr Satveer Mahil (Londres)
La dernière présentation de la session a été animée par le Dr Satveer Mahil, qui a expliqué de quelle manière il est possible de personnaliser le traitement pour chaque patient, grâce à des informations basées sur des données qui favorisent la prévention, un traitement ciblé et un meilleur pronostic à long terme.
Le concept d’une approche individualisée consiste à explorer le potentiel des biomarqueurs de chaque patient qui peuvent avoir un rôle prédictif dans l’évaluation du risque de maladie grave, donnant ainsi la possibilité d’introduire rapidement un traitement ciblé et donc une thérapie idéale.
La dernière partie de la présentation s’est concentrée sur la durabilité des thérapies modernes, plus particulièrement des produits biologiques, sur la base de données réelles. Les effets du traitement biologique devraient être basés sur certains biomarqueurs, mais aucun n’a été identifié comme suffisant pour être utilisé dans la pratique clinique quotidienne. L’un des facteurs permettant de prédire la réponse au traitement est la concentration sérique du médicament. Dans le cas de l’adalimumab, les concentrations du médicament à 4 semaines peuvent prédire la réponse à 6 mois. Grâce à ces résultats, il est possible de prédire la concentration d’adalimumab nécessaire à 4 semaines de traitement pour obtenir une réponse PASI 75 (intervalle thérapeutique de 3,2 à 7 μg/L), afin d’accéder aux directives cliniques et à la pratique concrète.
Outre les biomarqueurs, les scores de risque polygéniques peuvent également avoir une incidence sur la gravité de la maladie, cette dernière étant influencée par l’âge précoce d’apparition, l’obésité, le tabagisme et la consommation d’alcool.
La présentation comprenait des données montrant qu’une intervention précoce avec le guselkumab améliore les résultats lorsqu’on compare le psoriasis de courte durée (<2 ans) à celui de longue durée (>2 ans). Les résultats montrent également qu’une intervention précoce peut conduire à des réductions de doses tout en maintenant les résultats obtenus jusque là. Tous ces éléments plaident en faveur de l’étude qui sera prochainement menée au Royaume-Uni, visant à réduire la charge médicamenteuse à long terme pour les patients. L’essai pourrait permettre d’individualiser la posologie pour chaque patient.
Conférenciers : Prof. Assoc. Marieke Seyger, Pr Amy Paller, Dr Joan Garcías Ladaria, Dr Peter Hoeger.
Compte rendu rédigé par le Dr Jovan Lalosevic, M.D., Ph.D.
Intervenante : Prof. Assoc. Marieke Seyger (Nimègue)
La conférence comprenait une brève introduction au diagnostic différentiel possible du psoriasis pédiatrique et le professeur Seyger nous a donné quelques indices sur les signes cutanés possibles susceptibles d’orienter vers un meilleur diagnostic du psoriasis. Elle a inclus les 7 critères de signes prédictifs (Burden-The et al. Étude DIPSOC, Br J Dermatol 2022), qui sont les suivants :
La présentation suivante, portant sur les mises à jour en matière de traitement topique du psoriasis pédiatrique, a passé en revue les stéroïdes topiques, les inhibiteurs de la calcineurine et le calcipotriol utilisés auparavant, mais a également évoqué de nouvelles options thérapeutiques sous la forme de crème roflumilast (inhibiteur de la PDE-4) à 0,3 % et de tapinarof (modulateur de l’AhR) à 1 %, qui ont montré des résultats prometteurs (Lie et al, Pediatric Drugs 2024). Le professeur Seyger a également souligné que le ditranol/antraline peut avoir un effet significatif sur le psoriasis pédiatrique, mais que l’observance constitue le principal problème de cette option thérapeutique (Aoki et al, Dermatol Clinics 2024).
Les opinions des patients, des parents et des médecins peuvent différer. Les personnes extérieures au corps médicales veulent un traitement rapide et sans danger offrant une résolution complète de la lésion cutanée, alors que le personnel médical est moins strict sur les critères concernant l’efficacité du traitement prescrit.
Les médicaments systémiques disponibles pour le psoriasis pédiatrique comprennent les rétinoïdes, la cyclosporine A et le méthotrexate (Bruins et al, Acta Derm Venereol, 2022), qui peuvent donner une réponse PASI 75 chez près de 50 % des patients traités. L’aprémilast est un nouveau médicament disponible pour le traitement du psoriasis pédiatrique, donnant des résultats similaires au traitement systémique conventionnel (Fiorello et al, J Am Acad Dermatol, 2024).
Tous les médicaments biologiques disponibles pour le psoriasis pédiatrique sont indiqués à partir de 6 ans, à l’exception de l’étanercept, qui peut être utilisé à partir de 4 ans.
Les produits biologiques offrent une réponse beaucoup plus efficace, la majorité des patients atteignant un PASI 75, 90 et même environ un tiers atteignant un PASI 100 (Bodemer et al. JEADV 2020). En outre, ils sont plus efficaces et plus sûrs que le méthotrexate (Sun H et al, Pediatric Dermatol, 2022).
Les médicaments actuellement en essai de phase III pour le psoriasis pédiatrique sont le certolizumab, le guselkumab, le risankizumab, le tildrakizumab, le bimékizumab et le deucravacitinib oral (www.clinicaltrials.gov).
Enfin, la professeure a exposé ses données sur les facteurs présents chez les patients pédiatriques qui présentent un plus grand risque de psoriasis sévère et ont donc potentiellement besoin d’un traitement systémique (à son avis, d’abord avec le méthotrexate, puis avec les produits biologiques), à savoir le sexe masculin, l’atteinte des ongles et l’obésité.
Intervenante : Prof. Amy Paller, MD, MS (Chicago)
Nous savons que les stéroïdes topiques sont la pierre angulaire du traitement topique de la dermatite atopique. La variable dans la prise en charge des patients atteints de DA légère à modérée est le traitement d’entretien, soit en passant à un stéroïde topique moins puissant, soit en appliquant un traitement proactif 2 à 3 fois par semaine à base de stéroïdes topiques ou d’inhibiteurs topiques de la calcineurine. Plus récemment, les inhibiteurs topiques de PD4 nous ont offert une option thérapeutique sûre et efficace des zones plus sensibles avec le crisabolol à 2 % comme premier produit développé et, par la suite, le roflumilast à 0,15 % comme traitement topique approuvé par la FDA dans la DA. Les nouveaux traitements topiques incluent le ruxolitinib à 1,5 % (inhibiteur de JAK), qui a montré son efficacité dans la DA modérée (Boguniewicz et al, Ann Allergy Asthma Immunol 2018).
Les anti-inflammatoires non stéroïdiens topiques sont de plus en plus utilisés et les inhibiteurs topiques de la calcineurine ont bientôt 20 ans, sachant que le risque de développement d’un lymphome, que l’on craignait auparavant, est dorénavant considéré comme infiniment faible.
Le Pr Paller a poursuivi en évoquant l’efficacité du roflumilast à 0,15 % chez les patients âgés de plus de 6 ans, soulignant que même s’il s’agit d’une crème, elle ne provoque pas d’irritation comme c’était le cas avec le crisaborole (Eichenfield et al, présenté à l’ACAAI 2023).
La crème à base de tapinarof à 1 % (agoniste du récepteur des hydrocarbures aryliques) a montré son efficacité dans deux essais de phase III (ADORING 1 et 2), avec de légers effets indésirables, principalement dans le spectre de la folliculite.
Pour les patients nécessitant un traitement systémique, on recourt au dupilumab en première intention dans les pays où il est disponible (Butata, Paller, Ann Allergy Asthma Immunol 2022). Dans les pays où il n’est pas disponible, les patients doivent être traités par méthotrexate, la cyclosporine A, azathioprine, mycophénolate mofétil, avec ajout d’un traitement UVB à bande étroite lorsque cette combinaison est possible.
Les traitements biologiques nouveaux et anticipés comprennent les inhibiteurs de l’IL13 (tralokinumab, lebrikizumab), similaires au dupilumab mais ayant potentiellement une incidence de conjonctivite plus faible ; les inhibiteurs de l’IL31R (némolizumab), axés sur le segment prurigineux de la maladie (doit être combiné avec des stéroïdes topiques) ; l’inhibiteur de l’OX40L (amlitélimab), qui agit sur les cellules présentatrices de l’antigène.
Suite à sa présentation, la professeure Paller a déclaré qu’elle passe généralement d’un médicament systémique à un autre dans les 2 mois suivant le traitement et, lorsqu’il s'agit de déterminer quand et si l’intervalle de traitement doit être prolongé ou si la dose doit être réduite, elle a souligné que le patient doit être « bien portant » pendant au moins un an. Un commentaire a également été fait concernant la douleur liée à l’administration des injections, notamment en raison du volume du médicament, indiquant qu’il était essentiel de former les professionnels aux technique d’administration adéquate afin de limiter les douleurs indésirables.
Pour éviter les injections, il est possible d’utiliser des inhibiteurs de JAK systémiques, l’upadacitinib, le baricitinib et l’abrocitinib. Ils sont aussi efficaces que les produits biologiques, agissent rapidement et efficacement sur le prurit et permettent de prendre en charge efficacement les poussées. Leur principal problème réside dans le profil de sécurité, avec des exigences de laboratoire fréquentes, des neutropénies et des scénarios d’hypercoagulabilité. En général, ils ont une immunosuppression plus large par rapport aux produits biologiques et ne constituent donc pas le premier choix pour le traitement systémique.
Intervenant : Dr Joan Garcías Ladaria (Majorque)
L’hidradénite suppurée (HS) se définit par la présence de « lésions typiques » (papules, nodules, sinus drainants) touchant des régions spécifiques (sites de flexion) avec 2 poussées ou plus sur une période de 6 mois. Il existe deux pics d’incidence, chez les enfants atteignant la puberté (10 à 12 ans) et chez les adultes vers l’âge de 25 ans, avec un second pic vers l’âge de 40 ans.
Principal problème : l’hidradénite suppurée est une maladie sous-diagnostiquée dans de nombreux pays à travers le monde et la plupart des patients pédiatriques ne sont diagnostiqués qu’à l’âge adulte. Le délai approximatif de diagnostic chez les patients pédiatriques est d’environ 2 ans, et un délai de plus d’un an est associé à une maladie plus sévère/disséminée (Liu-Wong et al, JAMA Dermatol 2021). L’occlusion folliculaire et les lésions folliculaires sont au cœur de la pathogenèse de la maladie.
Dans l’HS pédiatrique, la comorbidité la plus fréquente est la trisomie 21 (2,7 à 5 % des cas), avec une prédominance féminine et une forte association avec la résistance à l’insuline, l’obésité, le tabagisme et les déséquilibres hormonaux (puberté précoce et SOPK).
Contrairement à d’autres maladies inflammatoires chroniques, l’âge précoce d’apparition n’est pas corrélé à une maladie plus grave (Krueger et al, Br J Dermatol 2024).
Il n’existe pas de protocoles thérapeutiques universellement acceptés dans l’HS pédiatrique, les cliniciens utilisent donc des protocoles thérapeutiques développés pour les adultes. Le but du traitement est de soulager les symptômes et de prévenir la progression de la maladie. Cependant, on peut conseiller des mesures générales, consistant notamment à limiter les frottements, éviter le rasage de près et réduire le poids corporel si nécessaire. Le traitement repose sur une combinaison d’interventions médicales et chirurgicales.
L’échelle de Hurley est utilisée pour évaluer la gravité et la prise en charge de la maladie (principalement une échelle chirurgicale). D’autres (IHS4) prennent en compte différents aspects cliniques de la lésion (folliculaire ou inflammatoire) (Zouboulis et al. Dtsch Dermatol Ges, 2024, Martorelli et al. J Eur Acad Dermatol 2020).
Le traitement de l’HS pédiatrique doit s’appuyer sur le phénotype des lésions, qu’elles soient folliculaires ou inflammatoires (Melgosa-Ramos et al Actas Dermosifiliogr. 2024). Les patients avec un phénotype mixte sont de meilleurs candidats au traitement biologique pour obtenir une rémission de la maladie.
Les considérations particulières dans le traitement de l’HS pédiatrique doivent inclure l’utilisation de tétracyclines (après l’âge de 8 ans), le finastéride chez les filles avant la ménarche, l’isotrétinoïne en cas d’acné concomitante, et le sécukinumab peut être essayé comme solution hors AMM chez les enfants de plus de 6 ans.
Enfin, le Dr Garcia Ladaria a conclu que l’HS pédiatrique est le reflet de l’HS chez l’adulte et nécessite une approche holistique, afin de traiter l’inflammation, d’identifier les comorbidités et de limiter les facteurs aggravants.
Intervenant : Dr Peter Hoeger (Hambourg)
Les nouveau-nés ont le même nombre de glandes sébacées que les adultes, mais elles sont réparties sur une plus petite surface. Elles sont également plus visibles lors du premier mois de vie en raison de la stimulation androgénique maternelle, familièrement connue sous le nom de mini-puberté.
Le spectre des troubles acnéiformes chez les enfants prépubères comprend :
Les enfants prépubères peuvent présenter des affections de type rosacée, dont la plus fréquente est la dermatite périorale qui, dans la majorité des cas, est causée par des stéroïdes topiques ou l’utilisation de dentifrices fluorés.
Une autre affection de type rosacée est le granulome idiopathique aseptique de la face, souvent associé à d’autres affections de type rosacée. Cette pathologie a un taux élevé de résolution spontanée. Elle peut être traitée à l’aide d’antibiotiques anti-inflammatoires oraux. La rosacée généralisée avec manifestations ophtalmiques est rare et doit être traitée comme chez les patients adultes.
Modérateur : Prof. Diamant Thaçi.
Conférenciers : Prof. Sonja Ständer, Dr Sarina Elmariah et Dr Andrew Pink.
Compte rendu rédigé par le Dr Jovan Lalosevic, M.D., Ph.D.
L’objectif principal de toute thérapie est de soulager les douleurs du patient et de limiter les démangeaisons, qu’il s’agisse de prurigo nodulaire ou de dermatite atopique.
Parmi les outils qui peuvent nous aider dans cette tâche figurent les échelles unidimensionnelles d’intensité des démangeaisons, l’échelle d'évaluation numérique étant l’une des plus précises (Stander et al, J Dtsch Dermatol Ges, 2022).
Est considéré comme une réduction significative selon l’échelle d’évaluation numérique des démangeaisons :
L’une des principales attentes de chaque patient est la diminution rapide des démangeaisons, et plus de 50 % de tous les patients atteints de prurigo nodulaire espèrent que cela se produise au cours du premier mois d’introduction du traitement.
Lorsque l’on examine le consensus des experts sur la prise en charge du prurigo nodulaire, on peut voir qu’il comprend les éléments suivants :
ainsi que les médicaments neuromodulateurs systémiques tels que la gabapentine, les antidépresseurs et les médicaments immunomodulateurs systémiques tels que le méthotrexate, l’azathioprine, la cyclosporine A et, ces dernières années, les inhibiteurs systémiques de JAK, le dupilumab et un nouveau médicament prometteur, un inhibiteur de la signalisation de l’IL-31.
Jusqu’à présent, la plupart des patients atteints de prurigo nodulaire n’étaient pas satisfaits du traitement prescrit. Les nouveaux traitements qui s’avèrent efficaces pour limiter les démangeaisons et les nodules sont le dupilumab (IL4/IL13) et le némolizumab (IL31a) (approuvé par la FDA).
La dermatite atopique (DA) est une maladie chronique et multifactorielle dans laquelle le prurit est un élément clé, et qui s’accompagne souvent de douleurs dans la plupart des formes modérées à sévères. Dans ce type de cas, on s’oriente toujours vers un traitement immunomodulateur systémique.
Le nouvel arsenal thérapeutique comprend des agents biologiques ou des inhibiteurs systémiques de JAK. Le dupilumab est l’un des premiers produits biologiques largement utilisés et efficaces dans la DA, avec des études récentes montrant l’efficacité du tralokinumab, du lébrikizumab et du némolizumab en association avec des stéroïdes topiques et/ou des inhibiteurs topiques de la calcineurine. À l’autre bout du spectre, le développement des inhibiteurs de JAK offre des effets encore plus importants sur le prurit, l’abrocitinib, l’upadicitinib et le baricitinib montrant une réelle efficacité dans la réduction de 4 points des démangeaisons sur l’échelle NRS.
Dans la seule étude comparative portant sur l'upadacitinib par rapport au dupilumab (Blauvelt et al, JAMA Dermatol, 2021) chez des adultes atteints de dermatite atopique modérée à sévère, l’upadacitinib a montré une action sur l’éclat de la peau et un soulagement des démangeaisons supérieurs et plus rapides avec une sécurité tolérable.
Session animée par : Dr Vincenzo Bettoli, Dr Lajos Kemeny.
Conférenciers : Dr Nicolas Kluger, Dr Layos Kemeny, Dr Vincenzo Bettoli, Dr Margarita Larralde.
Compte rendu rédigé par le Dr Jovan Lalosevic, M.D., Ph.D.
Intervenant : Dr Nicolas Kluger (Helsinki)
Les personnes transgenres sous hormonothérapie masculinisante subissent un large éventail d’effets dermatologiques lors de l’initiation et du maintien du traitement à base de testostérone. L’hormonothérapie a pour rôle d’inverser ou de réduire les caractéristiques sexuelles physiques du sexe assigné à la naissance et d’améliorer et de renforcer les caractéristiques du sexe exprimé, et ces thérapies s’appliquent aux patients transgenres et non conformes au genre. L’acné est l’un des effets secondaires les plus fréquents chez de nombreux patients transmasculins recevant de la testostérone. L’acné peut aggraver l’image corporelle et la santé mentale et a un impact significatif sur la qualité de vie des patients transgenres.
Il est important de parler de la maladie avec les patients de façon neutre, en utilisant des termes qui ne sont pas susceptibles de déclencher une dysmorphie de genre (poitrine, organes génitaux).
Le traitement doit être identique à celui des patientes cisgenres, en tenant compte du risque de grossesse chez les patientes transgenres.
Intervenant : Dr Layos Kemeny (Szeged)
La première question posée par le Pr Kemeny lors de sa présentation fur la suivante : existe-t-il un besoin non satisfait en matière de nouveaux traitements ? Même s’il existe des solutions thérapeutiques très efficaces, les patients souhaitent un traitement à action rapide et qui agit sur le long terme sans rechute ni cicatrices.
Les nouvelles thérapies pourraient inclure des cibles telles que les cytokines pro-inflammatoires.
Les souches de Cutibacterium acnes peuvent induire différentes réponses TH17 dans la peau (Agak et al, JID 2018). Tout cela conduit à se demander quelles cytokines peuvent réellement être ciblées, notamment l’IL1bêta, l’IL17A et le TNF alpha.
Les essais cliniques n’ont pas montré une efficacité sur le blocage des cytokines pro-inflammatoires par des anticorps dans le cas de l’IL1bêta et de l’IL17. Cependant, l’efficacité des anti-TNF, IL-13/23 et IL-23 a été démontrée dans les rapports de cas d’acné et de syndromes associés à l’acné.
La question qui se pose est de savoir si ces cas sont réellement de l’acné, ou bien alors un type d’hidradénite suppurée de la face (type conglobé).
L’autre façon d’agir sur la pathogenèse de l’acné consiste à moduler C. acnes vers les souches non acnéiques, soit en neutralisant les anticorps anti- CAMP, soit en le maîtrisant à l’aide d’autres bactéries (Karoglan et al, Act Derm venreol 2019, Labeer et al, Cell Resp Medicine 2022). La dernière tentative en date concerne la phagothérapie topique sur modèle murin (Rimon et al, Nat Commun 2023).
En fin de compte, aucun produit biologique n’est approuvé pour le traitement de l’acné. En cas d’acné résistante au traitement, il faut envisager une HS. Pour l’acné sévère résistante au traitement, avec ou sans syndromes d’acné, on peut tenter de bloquer le TNF-alpha, l’IL-17 ou l’IL-23. La modulation du microbiome cutané pourrait être un nouveau moyen d’améliorer l’acné.
Intervenant : Dr Vincenzo Bettoli (Ferrara)
La définition d’une faible dose est variable. La définition courante consiste à dire qu’une faible dose est inférieure à la dose standard (dans le cas de l’isotrétinoïne, elle est de 0,5 à 1 mg/kg). Une faible dose peut également être considérée comme étant inférieure à la dose la plus élevée qu’un patient donné peut tolérer (la dose qu’un patient peut tolérer sans effets secondaires).
L’isotrétinoïne à faible dose peut être administrée en continu ou par intermittence (jours et semaines alternés). Le traitement peut commencer par une faible dose suivie d’une augmentation progressive jusqu’à atteindre la dose maximale tolérée, ou il peut commencer par une dose élevée puis être réduit jusqu’à atteindre une faible dose en raison d’une faible tolérance aux effets secondaires.
Chaque patient a un métabolisme et une biodisponibilité différents pour les médicaments, donc les patients développeront des effets secondaires (la chéilite étant la plus fréquente) en fonction de leur dépendance personnelle à la dose.
Les patients sous traitement peuvent connaître des poussées, qui sont souvent liées à une dose trop élevée pour eux. Des études montrent qu’en commençant par une faible dose et en augmentant jusqu’à atteindre la dose maximale tolérée, on réduit significativement la fréquence des poussées sévères (Bettoli et al. Dermatology, 2009). La dose doit être augmentée chaque semaine, jusqu’à parvenir à une augmentation de 10 mg par jour. Ce schéma posologique a démontré son efficacité tout en minimisant les effets secondaires du traitement.
Malgré la plus faible incidence d’effets secondaires, l’isotrétinoïne à faible dose est mieux tolérée, tout aussi efficace à long terme, et il est plus facile de réaliser des procédures telles que les peelings ou les lasers sous traitement.
L’isotrétinoïne orale à faible dose a ses inconvénients, les femmes doivent notamment utiliser une contraception plus longtemps et mettent plus de temps à voir disparaître leur acné.
Les rechutes sont plus fréquentes avec l’isotrétinoïne à faible dose, mais certains patients en connaissent plus fréquemment, notamment dans les cas suivants :
Enfin, le Dr Bettoli nous a donné sa préférence en matière de traitement :
Intervenante : Dr Margarita Larralde (Buenos Aires)
Le traitement de l’acné par photothérapie peut se diviser en deux catégories : le traitement des lésions actives (LPI et PDT) et le traitement des séquelles de l’acné (CO2, Q-switch, LPI). Les mécanismes d’action des thérapies basée sur la lumière peuvent être les suivants :
La lumière pulsée intense améliore l’acné inflammatoire et diminue la taille et le nombre des glandes sébacées en induisant des dommages phototoxiques directs, qui réduisent leur densité ainsi que la production de sébum. Elle peut également exercer un effet anti-inflammatoire en régulant à la baisse le facteur de nécrose tumorale et en régulant à la hausse la signalisation du facteur de croissance transformant bêta-1. La LPI corrige également la dilatation vasculaire, entraînant ainsi une réduction de l’érythème dans l’acné inflammatoire.
Un nouveau dispositif lumineux qui a été utilisé pour les lésions inflammatoires légères à sévères est doté d’une longueur d’onde laser à diode de 1726 nm qui agit par photothermolyse sélective des glandes sébacées. Il est associé à un refroidissement pré-, parallèle (lors de l’apport d’énergie) et post-procédure des structures dermiques superficielles de l’épiderme pour assurer la sécurité et un minimum d’inconfort pour le patient.
Un autre dispositif pouvant être utilisé à des fins thérapeutiques combine la technologie du vide et de la lumière à large bande. L’aspiration en profondeur nettoie le pore en extrayant la matière sébacée bloquée. La lumière à large bande cible les porphyrines, détruit la bactérie C. acnes, réduit la production de sébum ainsi que l’érythème et les modifications pigmentaires associées à l’acné.
Le laser fractionné Q-switch à 1064 nm est souvent utilisé pour traiter les cicatrices d’acné.
Conclusion :
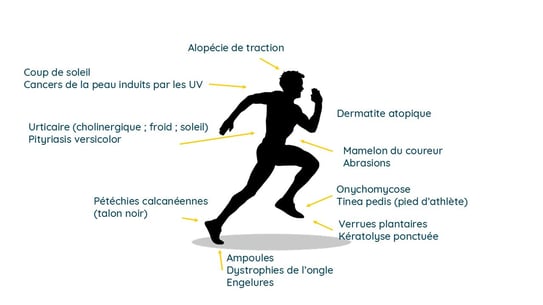
Intervenante : Dr Karina Polak, M.D. (Katowice, Pologne) Kozik A et al. Lésions cutanées chez les coureurs - revue systématique. e-poster 1883
En cette année olympique, on s’attendait à ce que le congrès de l’EADV soit l’occasion de parler de sport.
J’ai été très heureux de constater que l’équipe polonaise de Katowice avait procédé à un examen exhaustif des problèmes de peau susceptibles d’affecter les coureurs. Les coureurs peuvent être victimes d’un grand nombre d’altérations dermatologiques.
Il s’agit principalement de :
Les stratégies de prévention passent par une formation adéquate des coureurs, l’utilisation de tissus qui évacuent l’humidité, l’application de produits anti-frottement, une bonne hygiène, l’application de crème solaire et l’attention portée aux conditions environnementales afin d’atténuer ces risques.
Intervenant : Dr Bruno Halioua (Paris, France)
Skayem C et al. Recours aux magnétiseurs et aux guérisseurs traditionnels par les personnes souffrant de maladies de peau : une étude mondiale - Projet ALL. e-poster 3447
Musa BS et al. Utilisation de médicaments non conventionnels chez les patients adultes en dermatologie fréquentant un établissement tertiaire dans le nord de la Tanzanie. e-poster 2740
Fikri C et al. Pustulose exanthématique aiguë localisée induite par un médicament topique à base de plantes. e-poster 0243
El Fekih I et al. Syndrome DRESS chez un sujet chinois induit par la phytothérapie chinoise. e-poster 0290
On sait que certains patients peuvent choisir de se tourner vers les médecines « alternatives » ou « complémentaires » afin de traiter leurs maladies chroniques.
Les guérisseurs et les magnétiseurs font partie de ces guérisseurs alternatifs qui prétendent agir sur les champs énergétiques d’une personne afin d’améliorer sa santé. Une enquête mondiale, couvrant 20 pays et un échantillon représentatif de la population générale de chaque pays, a recruté 50552 personnes, dont 35 % (n=17627) souffraient au minimum d’une maladie de peau. Parmi les personnes interrogées, les chercheurs ont analysé une population de 12485 personnes pour les besoins de cette étude. Les principales affections cutanées étaient l’acné (35,6 %), la dermatite atopique (DA, 20,1 %), le psoriasis (7,9 %), la rosacée (3,9 %), le vitiligo (1,4 %) et l’hidradénite suppurée (HS, 0,8 %). Les chercheurs ont constaté que 3,1 % des personnes interrogées déclaraient avoir consulté des magnétiseurs ou des guérisseurs traditionnels pour traiter leur maladie. Le recours aux magnétiseurs/guérisseurs était plus fréquente chez les jeunes et les citadins. La prévalence la plus élevée a été observée en Inde (8 %), aux Émirats arabes unis (5,2 %), en Afrique du Sud (4,9 %), en Chine (4 %), au Kenya (3,6 %), en Corée du Sud (3,5 %) et... en France (3,4 %). En Europe, la prévalence était de 2 %. Les patients atteints de vitiligo et d’HS étaient les plus susceptibles de consulter des magnétiseurs/guérisseurs. Heureusement, dans la plupart des cas, le recours à un guérisseur n’a pas interféré avec la prise en charge médicale (66,3 %).
Il est à noter que les patients atteints de vitiligo et d’HS sont ceux qui se tournent le plus vers ces guérisseurs alternatifs. L’explication réside très probablement dans le fait qu’il n’existe jusqu’à présent aucune thérapie véritablement efficace pour traiter ces maladies à la résistance notoire. Avec les progrès thérapeutiques, les patients pourraient cesser d’aller voir ces guérisseurs.
Un deuxième poster abordait des questions similaires dans le nord de la Tanzanie. Une étude monocentrique a montré que 35,5 % des personnes interrogées (sur 414) avaient consulté un prestataire de soins médicaux alternatifs pour l’acné (64,7 %), le psoriasis (63,6 %), la DA (52,3 %), les troubles de la pigmentation (47,8 %) et les troubles vésiculeux (43 %). La médecine alternative englobe la médecine traditionnelle africaine et les remèdes maison.
Cependant, les médicaments alternatifs tels que la phytothérapie peuvent être à l’origine d’effets secondaires cutanés plus ou moins graves. Ceci a été illustré, d’une part, par un cas de pustulose exanthématique aiguë localisée autolimitée liée à l’application de Capparis spinosa pour traiter une sciatalgie sur une jambe et une hanche et, d’autre part, par un cas de syndrome DRESS ayant entraîné l’hospitalisation du patient et des soins de soutien à l’aide de corticostéroïdes systémiques après l’application et la prise orale d’une préparation à base de plantes médicinales chinoises contenant 23 ingrédients différents !
Jain S et al. Caractériser les disparités dans les publications en dermatologie : une analyse bibliométrique des tendances concernant la paternité des documents. e-poster 1888
Les auteurs issus de pays à revenu faible ou moyen (PRFM) sont sous-représentés dans la littérature médicale. Cependant, ils appartiennent à des pays qui partagent la plus grande charge de morbidité dermatologique. Les auteurs apprécient de publier dans des revues à fort impact afin d’établir des relations scientifiques et de montrer leur productivité académique, en vue d’une promotion universitaire.
Les auteurs américains ont entrepris une analyse bibliométrique afin d’évaluer les 6 meilleures revues de dermatologie sur la base du facteur d’impact (FI) cité et de la recherche de publications, entre 2018 et 2023. Ils ont extrait les publications d’auteurs à revenu faible, faible et moyen et moyen/élevé.
Au cours des six dernières années, seuls 12 % des publications dans les revues de dermatologie les plus prestigieuses incluaient au moins un auteur issu des PRFM. Dans moins de 10 % des publications, l’auteur issu des PRFM occupait un poste élevé ou de premier plan. Les pays les plus représentés sont la Chine, le Brésil, la Turquie et le Mexique. Les auteurs issus des PRFM étaient moins susceptibles d’être cités comme premier ou principal auteur.
On observe une prédominance de la Chine, de l’Inde et du Brésil.
Les explications de ces divergences et de la sous-représentation des auteurs issus des PRFM dans les revues à fort impact sont les suivantes :
Intervenant : Dr Nicolas Kluger (Helsinki, Finlande)
Le tatouage est de plus en plus populaire. Avec près de 20 % des adultes arborant au moins un tatouage, le risque associé aux grains de beauté soulève un certain nombre de questions. Tatouer sur une lésion mélanocytaire peut déclencher des modifications cliniques et histologiques traumatisantes qui donneront lieu à une excision et une analyse pour écarter la possibilité d’une tumeur maligne. Les tatouages de grande taille peuvent compromettre la surveillance adéquate des patients présentant un syndrome du grain de beauté atypique ou de nombreux grains de beauté. La dermoscopie peut s’avérer complexe en raison de la superposition des mélanocytes et des pigments de tatouage.
Heureusement, le développement d’un mélanome reste rare et est encore considéré à ce jour comme un événement fortuit. Dans près de 80 % des cas, le mélanome se développe de novo à l’intérieur des tatouages. Heureusement, toutes les lésions pigmentées à l’intérieur d’un tatouage ne sont pas des mélanomes. Des cas de kératoses séborrhéiques, de verrues et de naevus de Spitz ont été décrits. La principale règle de bon sens consiste à éviter de se faire tatouer sur des lésions pigmentées. De plus, en règle générale, un tatouage ne doit pas être réalisé sur une lésion préexistante sans que celle-ci ait fait l’objet d'un diagnostic. Bien entendu, la cicatrice chirurgicale d’un mélanome ne doit jamais être tatouée afin de faciliter la surveillance clinique. En cas de doute, la séance de tatouage doit être reportée, ou le client doit choisir un autre emplacement pour son tatouage, et il convient alors de consulter un médecin généraliste ou un dermatologue. La formation des tatoueurs joue également un rôle important. Ces derniers doivent savoir que l’on ne tatoue pas sur des lésions cutanées sans évaluation médicale. Ils doivent laisser des espaces lorsqu’ils tatouent à proximité d’une lésion et laisser environ 0,5 à 1 cm autour de chaque naevus. La question du rôle des tatoueurs dans le dépistage du mélanome reste ouverte, mais elle comporte également des limites éthiques qu’il convient de prendre en compte.
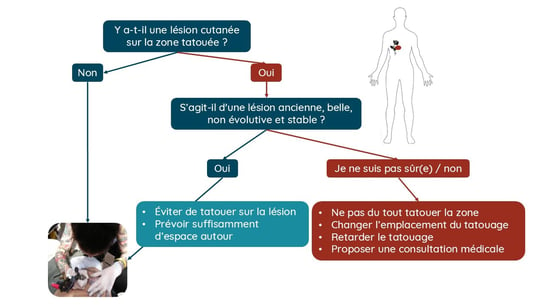
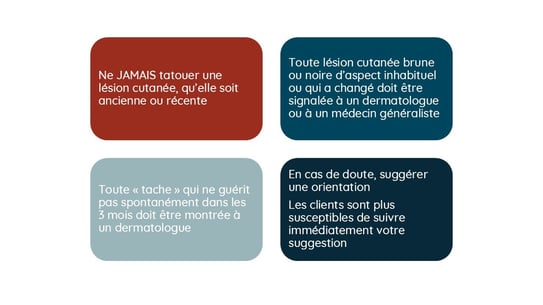
Figure 2. Suggestion (a) d’un algorithme décisionnel et (b) de points clés pour le tatoueur en cas de lésion sur la zone prévue pour un tatouage
Loubaris Z et al. Alopécie de traction consécutive au port d’un masque à oxygène chez un enfant : compte rendu de cas. e-poster 2164
Sharma A, et al. Alopécie de traction dans la population pédiatrique sikh. e-poster 2020
Phiske M et al. Alopécie triangulaire congénitale avec atteinte des sourcils et des paupières inférieures : une association rare et jamais signalée jusqu’à présent. e-poster 2056
Mansour Billah L et al. Sisaipho : une manifestation rare de l’alopécie areata. e-poster 2177
Pappa G et al. Alopécie areata dans une répartition de modèles : redéfinition de la pelade sous une nouvelle perspective pathogénique. e-poster 2104
Plusieurs posters ont mentionné des présentations cliniques surprenantes de certains troubles capillaires.
Loubaris et al. de Rabat, au Maroc, ont rapporté le cas d’une fillette de 2 ans qui avait développé une alopécie au niveau des régions occipitales et temporales. Elle présentait également des taches brunâtres sur les joues et le nez correspondant au port du masque. Les antécédents médicaux ont révélé qu’elle portait un masque à oxygène à haute concentration depuis une semaine en raison d’une broncho-alvéolite. Les auteurs ont conclu au rôle du masque à oxygène dans la survenue de l’alopécie et ont diagnostiqué une alopécie de traction (AT). Aucune biopsie n’a été réalisée et l’évolution du trouble capillaire n’est pas connue.
Le sikhisme est une religion monothéiste fondée au XVè siècle dans la région du Pendjab, en Inde. Dans le sikhisme, les cheveux non coupés sont considérés comme un symbole de dévotion et de respect pour la création divine. Les Sikhs gardent leurs cheveux longs, ont tendance à les attacher en un chignon serré au niveau du vertex et les couvrent au moyen d’un turban. Ce style de coiffure permanent est à l’origine de l’AT chez les Sikhs adultes. Dans un poster du Royaume-Uni, les auteurs ont rapporté deux cas pédiatriques d’AT chez des garçons sikhs âgés de 14 ans, présentant une récession notable de la ligne fronto-temporale des cheveux et un signe de la frange. Il a été conseillé aux parents d’éviter de maintenir les cheveux en chignon serré pendant de longues périodes, de les laisser détachés aussi souvent que possible, libres ou en chignon ou queue de cheval lâche. On peut recourir au minoxidil local à 2 ou 5 % afin de stimuler la repousse.
La pelade sisaipho (« ophiasis » épelé à l’envers, ou ophiasis inversus) est une variante clinique rare de l’alopécie areata (AA), qui a été décrite pour la première fois en 1996. Elle se présente comme une chute des cheveux au niveau du cuir chevelu épargnant les zones temporales et occipitales, avec une possible extension centrifuge. On peut facilement la confondre avec l’alopécie androgénétique, à tel point que certains auteurs, comme Pappa et al., ont suggéré de renommer cette présentation clinique « alopécie areata à répartition masculine ou féminine » pour faciliter l’identification de cette manifestation rare.
L’atteinte des sourcils et des cils est peu fréquente. À l’inverse, la trachyonychie et les comorbidités seraient plus fréquentes chez ces patients.
Enfin, Phiske et al. de Mumbai, en Inde, ont rapporté le cas d’une fillette de 8 ans qui présentait une alopécie triangulaire congénitale bilatérale associée à une perte des cils de la paupière inférieure et à une chute par plaques des deux sourcils.
Jachiet M et al. Dupilumab chez les patients adultes atteints de prurigo nodulaire modéré à sévère : résultats du suivi en situation réelle après 6 mois du programme d’accès précoce français. e-poster 3056
Harrison K et al. Le dupilumab est efficace chez les patients atteints de prurigo nodulaire, quels que soient leurs antécédents de comorbidités atopiques : résultats regroupés de deux essais de phase III (LIBERTY-PN PRIME et PRIME2). e-poster 3076
Le prurigo nodulaire (PN) est une affection cutanée caractérisée par des nodules ou des bosses qui provoquent d’intenses démangeaisons. Elle est souvent causée par un grattage chronique dû à de fortes démangeaisons et a un impact notable sur la qualité de vie. Le dupilumab, un antagoniste de l’IL-4/IL-13, a été approuvé dans le traitement du PN modéré (>20 nodules) à sévère (>100 nodules). En France, une autorisation d’accès précoce a permis la prescription du dupilumab à l’automne 2022. Un poster mentionnait les résultats de 155 patients ayant reçu 600 mg de dupilumab par voie sous-cutanée (injection initiale) puis 300 mg toutes les deux semaines. Les données démographiques, les caractéristiques de la maladie, l’efficacité et la sécurité ont été évaluées.
L’âge moyen de la cohorte était de 62,8 ans, avec 60 % de femmes. 72 % des patients présentaient des comorbidités de tout type, mais seuls 17 % présentaient des comorbidités atopiques (asthme, dermatite atopique, conjonctivite). Le dupilumab n’a été interrompu que dans 11 % des cas.
Au total, près de 40 % et 73,5 % des patients ont obtenu un score IGA PN-S* de 0 à 1, à 3 mois et 6 mois, respectivement. En ce qui concerne l’intensité des démangeaisons, le score WI-NRS (Worst Itch Numeric Rating Scale)** était initialement de 7,1 et a baissé à 3,5 et 2,8, à 3 mois et 6 mois, respectivement, soit un changement relatif par rapport aux valeurs initiales qui étaient de -46,8 % et -50,2 %, respectivement. La qualité de vie s’est améliorée, comme le montre le DLQI, de 6,5 points et 8,4 points, à 3 et 6 mois, respectivement.
Les effets indésirables les plus fréquemment rapportés étaient des maux de tête et un prurit (6,8 % chacun).
L’amélioration des résultats cliniques et du profil de sécurité du dupilumab étaient cohérents avec les études précédentes.
Il convient de noter qu’une analyse groupée de deux études de phase III portant sur l’efficacité du dupilumab (LIBERTY-PN PRIME et PRIME 2) a montré que les antécédents de dermatite atopique n’avaient aucune incidence sur les résultats.
* Le score IGA PN-S varie de 0 (clair, aucun nodule) à 1 (presque clair, ≤5 nodules), 2 (léger, 6 à 19 nodules), 3 (modéré, 20 à 99 nodules) et 4 (grave, ≥100 nodules).
** L'échelle d’évaluation numérique des pires démangeaisons (WI-NRS) est un questionnaire à choix unique, rempli par le patient, conçu pour mesurer les « pires démangeaisons » qu’un individu puisse ressentir (c’est-à-dire le degré d’intensité des démangeaisons) au cours des dernières 24 heures sur une échelle d’évaluation en 11 points (où 0 représente « aucune démangeaison » et 10 « les pires démangeaisons imaginables »).
Barbarot S et al. La supplémentation maternelle en prébiotiques pendant la grossesse régule la colonisation du microbiote des enfants à haut risque, mais ne prévient pas la dermatite atopique à un an. Essai contrôlé, randomisé, multicentrique PREGRALL
ETFAD - Groupe de travail européen sur la dermatite atopique
L’étude PREGRALL est un essai prospectif randomisé français portant sur l’efficacité d’un prébiotique dans la prévention primaire du développement de la dermatite atopique (DA) chez les nourrissons âgés d’un an.
Un prébiotique est un sucre non digéré qui stimule la croissance ou l’activité des bactéries intestinales bénéfiques. Les prébiotiques ont des effets directs sur les cellules épithéliales et immunitaires, mais aussi des effets indirects via une augmentation des bactéries Bifidobacteria et Lactobacillus. Des études sur l’animal ont montré que l’administration de prébiotiques aux mères enceintes protège la progéniture des allergies alimentaires.
L’hypothèse de l’étude PREGRALL suggère que la prise de prébiotiques pendant la grossesse modulerait le système immunitaire du fœtus et réduirait le risque de développer une DA chez l’enfant. Cependant, on sait que la prise de prébiotiques après la naissance n’a aucun effet sur la prévention de la DA.
Cette étude randomisée incluait 376 femmes enceintes à risque de DA réparties en 2 groupes : un groupe placebo (PBO) et un groupe recevant le prébiotique à partir de 20 semaines de gestation jusqu’à l’accouchement (188 patientes par groupe). Le critère d’évaluation principal était la prévalence de la DA à l’âge d’un an.
Il n’existait aucune différence entre les deux groupes, ni en termes de prévalence à 1 an (environ 20 % dans les deux groupes) ni en termes de sévérité de la DA. Il n’existait pas non plus de différence selon que le bébé était né par voie basse ou par césarienne, selon le mode d’allaitement ou les allergies. Il y a cependant bien eu une modification du microbiote maternel, qui a été transmise à l’enfant au début de sa vie.
Il semble que le prébiotique utilisé dans cette étude n’ait aucun effet sur la prévention de la DA à court terme. L’étude a désormais pour objectif d’observer la prévalence de l’asthme à 5 ans.
Le Pr Brigitte Dréno de Nantes (France) a évoqué son expérience avec la spironolactone dans le traitement de l’acné. La spironolactone (SPL) fait partie des médicaments actuellement en vogue, pouvant être administrés aux patients souffrant d’acné.
La SPL est un stéroïde synthétique 17-lactone qui agit comme un antagoniste du récepteur de l’aldostérone, un diurétique épargneur de potassium et un anti-androgène qui cible le sébocyte, inhibe la testostérone, la dihydrotestostérone ainsi que la 5-alpha réductase, et augmente la SHBG (globuline liant les hormones sexuelles).
La SPL est utilisée à faible dose dans l’acné, soit entre 50 et 150 mg par jour, au cours d’un repas contenant des graisses. Les patients présentant des lésions inflammatoires et ayant déjà été traités par isotrétinoïne répondent mieux au traitement, tandis que ceux ayant eu recours à une contraception à activité androgénique intrinsèque de progestatif n’ont pas répondu au traitement.
Le Pr Dréno a fourni des données rassurantes concernant la sécurité et la tolérance. Les effets indésirables de la SPL sont liés à la dose. La SPL n’est pas associé à un risque d’hyperkaliémie lorsqu’elle est prescrite à des patients âgés de 15 à 45 ans. Elle n’est pas non plus associée à un risque accru d’événements thromboemboliques, de tumeurs du sein ou de l’utérus ou d’hypotension.
Les meilleures indications pour les patients souffrant d’acné sont celles les suivantes :
Les patients souffrant d’hyperandrogénie centrale comme l’hirsutisme et l’alopécie ne sont pas une bonne indication pour la SPL.
Un essai randomisé récent en double aveugle comparant la doxycycline au PBO 5 %, pendant 3 mois suivi du PBO seul et de la SPL 150 mg/jour + PBO, pendant 6 mois a montré que la SPL
était 1,37 fois plus efficace à 4 mois et significativement plus à 6 mois que la doxycycline. Cependant, la doxycycline s’est avérée efficace plus rapidement.
Les effets indésirables étaient faibles, y compris la dysménorrhée.
De manière générale, il existe un ensemble de preuves pour étayer le recours à la SPL dans l’acné chez la femme. Il s’agit d’une alternative à l’isotrétinoïne. La SPL peut également améliorer l’acné prépubère, mais dans une moindre mesure que chez l’adulte.
Il est également important de ne pas interrompre brutalement le traitement, mais de diminuer la dose de 25 mg après 6 mois.
Intervenant : Dr Aaron Mangold (Scottsdale, États-Unis)
Le deucravacitinib dans le traitement du lichen plan pilaire - analyse intermédiaire.
Mahmoudi et al. Efficacité et sécurité du tofacitinib, un inhibiteur oral de Janus kinase, dans le traitement des adultes atteints de lichen plan pilaire : Essai randomisé contrôlé par placebo. e-poster 2064
Lofti et al. Le plasma riche en plaquettes, un nouveau traitement efficace du lichen plan pilaire : essai clinique randomisé contrôlé en aveugle. e-poster 2066
Le lichen plan pilaire (LPP) est une alopécie cicatricielle à médiation lymphocytaire difficile à prendre en charge et sans traitement efficace. L’étiologie et les cicatrices sont mal comprises.
Les traitements de première intention comprennent les corticostéroïdes locaux et intralésionnels, suivis de l’hydroxychloroquine, ou les traitements systémiques comme la cyclosporine, le mycophénolate mofétil ou le méthotrexate.
Dans le lichen plan cutané, les voies de l’interféron de type I et de type II sont considérées comme accessibles aux inhibiteurs de JAK. De plus, les cellules Th17 pourraient jouer un rôle dans le processus.
Le Dr Aaron Mangold a présenté les résultats intermédiaires d’une petite étude en ouvert à un seul bras visant à évaluer la sécurité et l’efficacité du deucravacitinib, un inhibiteur de TYK2, chez les adultes de plus de 18 ans présentant un LPP actif confirmé par biopsie. La posologie était de 6 mg deux fois par jour. Le score PGA, l’indice d’activité du lichen plan pilaire (LPPAI) et d’autres mesures secondaires, telles que le DLQI et l’évaluation des démangeaisons ou du Skindex ont été analysés. Le point final de l’étude est prévu à 24 semaines, mais seuls les résultats intermédiaires à 12 et 16 semaines ont été présentés.
Dix patients ont été inclus avec un âge moyen de 61,4 ans, 70 % de femmes, toutes blanches. La durée moyenne de la maladie était de 6,4 ans.
Par rapport aux valeurs initiales, on a observé une nette amélioration du LPPAI, avec une baisse de 3,8 à 1,6 (amélioration de 60 %) et 1,2 (amélioration de 70 %), aux semaines 12 et 16, respectivement. Le score PGA s’est également amélioré à la semaine 12 et à la semaine 16. Le deucravacitinib a été bien toléré, sans événement indésirable grave lié au médicament et sans interruption du traitement. 70 % des patients avaient de l’acné. Le deucravacitinib a amélioré l’activité de la maladie et le PGA dans une petite cohorte de patients aux semaines 12 et 16. Une amélioration est visible au bout de 3 à 4 mois. Des études comparatives supplémentaires sont nécessaires pour mieux évaluer la sécurité et l’efficacité.
Un essai randomisé multicentrique en double aveugle contrôlé par placebo réalisé à Téhéran, en Iran, a inclus 37 patients (26 femmes, âge moyen 45 ans) et a tenté d’évaluer la sécurité et l’efficacité d’un inhibiteur de JAK, le tofacitinib. Cependant, l’étude a eu lieu entre 2020 et 2022 et a clairement été impactée par la COVID-19, principalement dans le groupe placebo.
Une autre étude menée en Iran a comparé un corticostéroïde très puissant (clobétasol) avec du plasma riche en plaquettes (PRP) associé au clobétasol chez 24 participants. Il est intéressant de noter que le groupe PRP a obtenu de meilleurs résultats concernant le LPPAI et la satisfaction des patients. Les deux traitements ont été bien tolérés. Les mécanismes d’action du PRP dans le LPP sont inconnus. Les hypothèses de travail suggèrent notamment une stimulation des cellules souches du follicule pileux et une réduction de l’inflammation. Cependant, les résultats publiés concernant le PRP dans le LPP sont mitigés. Le PRP peut être intéressant, mais des données plus solides sont nécessaires pour définir sa place dans l’arsenal contre le LPP.
Intervenante : Dr Martina L Porter (Boston, États-Unis)
Une crème au ruxolitinib dans l’hidradénite suppurée légère à modérée : données à 32 semaines d’une étude de phase II randomisée.
L’hidradénite suppurée (HS) est une maladie cutanée inflammatoire invalidante caractérisée par des nodules douloureux, un drainage et des cicatrices au niveau des plis cutanés. L’adalimumab injectable et le sécukinumab sont actuellement les deux produits biologiques approuvés pour le traitement de l’HS. La dérégulation des voies de signalisation dépendantes de la Janus kinase (JAK) est impliquée dans l’HS, ouvrant ainsi la possibilité d’explorer l’efficacité des inhibiteurs de JAK.
Porter et al. ont rapporté les résultats d’une étude de phase II portant sur une crème au ruxolitinib 1,5 %, un inhibiteur de JAK1 et JAK2, deux fois par jour dans l’HS légère à modérée.
69 adultes atteints d’HS au stade de Hurley I/II (âge moyen 29 ans, principalement des femmes, sans tunnels drainants, et un nombre total d’abcès et de nodules inflammatoires de 3 à 10 (AN count, moyenne de 5,4) ont été randomisés de manière égale selon un rapport 1:1 à 1,5 % de crème au ruxolitinib ou au véhicule (placebo) pour un traitement continu de 16 semaines deux fois par jour, après quoi tous les patients ont appliqué la crème au ruxolitinib deux fois au besoin (AN count ≥1 et/ou score Pain NRS ≥1) au cours d’une extension en ouvert (OLE) de 16 semaines. L’efficacité a été évaluée par :
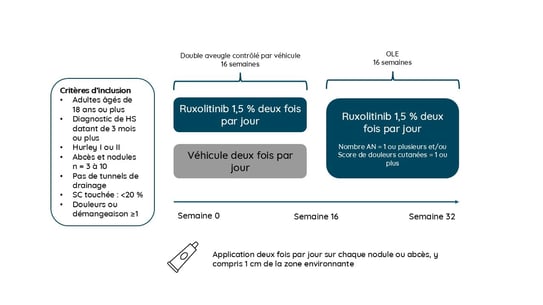
Les résultats sont résumés comme suit :
la variation des valeurs initiales de l’AN count était de près de -3,95 à la semaine 32. La proportion de patients atteignant AN50, AN75, AN90 et AN100 était de 79 %, 54 %, 21 % et 21 % et 81 %, 67 %, 19 % et 19 %, aux semaines 16 et 32, respectivement. Plus de 80 % des patients ont obtenu un HiSCR 50 à la semaine 32. Le ruxolitinib a été très bien toléré.
L’application de crème au ruxolitinib 1,5 % jusqu’à la semaine 32 de la période de l’étude OLE a entraîné une persistance ou une amélioration des signes cliniques de l’HS et a été généralement bien tolérée. La crème au ruxolitinib peut constituer une nouvelle approche pour répondre à un besoin médical non satisfait dans le traitement de l’HS plus légère.
Intervenante : Dr Ayelet Rishpon (Tel Aviv, Israël)
Problèmes de peau dans la population transgenre
Intervenant : Dr Nicolas Kluger (Helsinki, Finlande)
Prise en charge de l’acné chez les personnes transgenres
Le nombre de personnes ayant des problèmes d’identité de genre à la recherche d’une aide professionnelle a considérablement augmenté au cours de la dernière décennie. Aux États-Unis, 1,3 M d’adultes s’identifient comme transgenres (Tg, 0,5 %) et dans l’UE, ils sont environ 1,5 M (Amnesty International, 2015). Les personnes transféminines (TGF) sont des personnes assignées à un sexe masculin à la naissance et ayant une identité de genre suivant le spectre féminin (y compris les femmes transgenres ainsi que des personnes non binaires). Les personnes transmasculines (TGM) sont des personnes assignées à un sexe féminin à la naissance et ayant une identité de genre suivant le spectre masculin (y compris les hommes transgenres ainsi que des personnes non binaires).
Les patients Tg peuvent être réticents à consulter un médecin car ils craignent d’être jugés et stigmatisés. En outre, les prestataires de soins de santé peuvent ne pas se sentir à l’aise dans la prise en charge des patients Tg en raison du manque de formation et de connaissances. En dermatologie, les patients Tg peuvent éviter l’examen cutané (pour les grains de beauté par exemple). Par conséquent, il est nécessaire de créer un environnement inclusif en publiant des déclarations de non-discrimination, en proposant des toilettes non sexistes, en utilisant un langage non sexiste, etc.
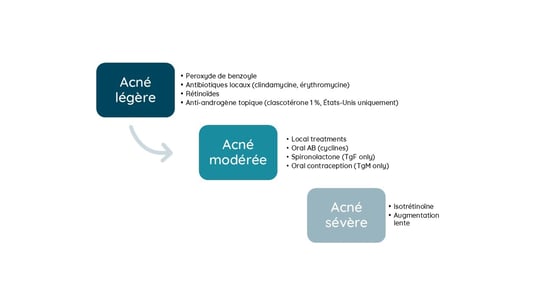
L’acné concerne 80 % des TGM présentant des problèmes de peau. Dans 70 % des cas, l’acné est associée à un apport en testostérone, sa prévalence globale est d’environ 26 %, avec un délai de 12 mois suivant l’initiation de la testostérone. Les facteurs de risque d’acné comprennent le jeune âge lors de l’hormonothérapie, l’IMC, les niveaux de testostérone, le tabagisme.
Les TGM développent une acné hormonale dans des endroits similaires à d’autres formes d’acné androgéno-dépendante : sur le tiers inférieur du visage, la poitrine, le haut des bras et le dos. L’acné fulminans est rare et peut survenir avec une augmentation de la testostérone. L’acné de binder est une forme d’acné spécifique du tronc liée au port d’un vêtement compressif pour aplatir la poitrine chez les TGM.
La prise en charge de l’acné chez les patients TGM est très proche de celle des patients cisgenres selon la gravité. Les spécificités sont notamment :
La deuxième complication dermatologique est la chute des cheveux commune (éviter de dire chute des cheveux « masculine » ou « féminine »). La chute des cheveux est plus fréquente chez les TGM en raison de la testostérone, avec une apparition retardée après la prise de testostérone. Elle peut être souhaitée ou non. Le minoxidil par voie orale ou topique peut être administré pour aux deux Tg, à raison de 2,5 mg pour les TGM et de 1,25 pour les TGF. Le finastéride et le dutastéride peuvent être utilisés car ils ne font pas baisser le taux de testostérone sérique. Certains recommandent d’attendre 2 à 5 ans pour permettre le développement de caractéristiques sexuelles secondaires. Il faut envisager la gynécomastie, la diminution de la libido et la dépression chez les TGM, mais cela reste discutable. La spironolactone fonctionne bien chez les TGF. Elle est toutefois contre-indiquée chez les TGM. Il existe d’autres traitements tels que le PRP, la greffe de cheveux et l’avancement de la racine des cheveux chez les TGF.
Enfin, chez les TGF, les poils du visage et du corps peuvent être traités par épilation au laser et électrolyse. Chez les TGM, le minoxidil topique peut être utilisé pour améliorer la croissance des poils du visage.
Le rôle complémentaire du dermatologue dans la transition de genre inclut notamment :
Intervenant : Dr Thibault Mahevas (Paris, France)
Le syndrome VEXAS (Vacuoles, Enzyme E1, liée à l’X, Auto-inflammatoire, à mutation Somatique) est une maladie auto-inflammatoire grave récemment découverte en 2020. Le syndrome VEXAS est consécutif à l’acquisition d’une mutation somatique du gène de l’enzyme activant l’ubiquitine 1 (UBA1) dans la lignée myéloïde. Il existe 3 mutations principales de la perte de fonction de UBA1 (c.121A > G ; c.122T >C ; c121A >C) qui provoquent une accumulation de protéines, déclenchant ainsi un stress cellulaire et l’activation des voies immunitaires. Depuis sa première description en 2020, environ 300 cas ont été décrits.
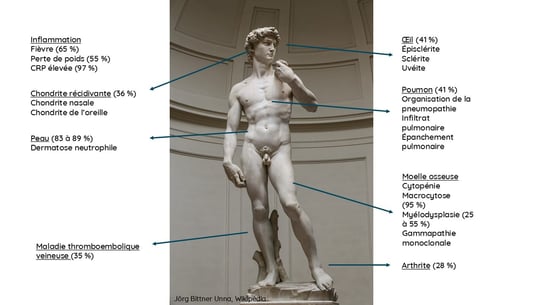
VEXAS survient chez l’homme dans 95 % des cas (car la maladie est liée à l’X), avec un âge moyen de 68 ans, et combine une inflammation systémique, des manifestations hématologiques et une inflammation des organes cibles, dont l’atteinte cutanée semble être la plus fréquente (85 %) et souvent la première.
L’atteinte hématologique incluait : cytopénie, macrocytose (95 %), myélodysplasie (25 à 55 %) et gammopathie monoclonale.
Inflammation : fièvre (65 %), perte de poids (55 %) et CRP élevée (97 %)
Autres manifestations possibles : chondrite récidivante, inflammation oculaire, inflammation pulmonaire, arthrite et risque accru de thromboembolie.
Il est intéressant de noter que 20 ans avant son individualisation, Camille Frances et Jean-Charles Piette de La Pitié Salpêtrière à Paris avaient passé en revue les manifestations dermatologiques de 200 patients atteints de chondrite récidivante et constaté que les manifestations cutanées lors de la chondrite récidivante chez l’homme étaient associées de manière significative à un risque de myélodysplasie. Il est fort probable que ce sous-ensemble de patients ait présenté un syndrome VEXAS.
Les manifestations cutanées du syndrome VEXAS sont hétérogènes mais fréquentes (83 à 89 %) et peuvent également constituer la première manifestation du syndrome. Le diagnostic de VEXAS doit être envisagé en présence d’une éruption cutanée constituée de multiples (>10) maculopapules et nodules inflammatoires roses ou rouges, plus rarement des pustules, localisés sur le tronc et les membres, parfois sur le visage, en particulier s’ils sont associés à des lésions arciformes observées dans un tiers des cas, chez des patients de plus de 50 ans présentant des signes d’inflammation systémique ou organique, ou des anomalies hématologiques. Parmi les autres symptômes, citons le livedo, le phénomène de pathergie, la pseudo-cellulite et l’œdème périorbitaire. Le phénotype clinique et l’infiltrat histologique varient en fonction du génotype et des variants aminoacides.
L’analyse histologique des lésions cutanées du VEXAS révèle un infiltrat de dermatose neutrophile typique, mais du type histiocytoïde du syndrome de Sweet, riche en cellules myéloïdes immatures, souvent associé à une leucocytoclasie avec ou sans vascularite.
Le concept de Myelodysplasia cutis illustre le processus où des cellules non plastiques à différents stades de différenciation peuvent s’infiltrer dans la peau alors qu’un patient avait des cellules du syndrome myélodysplasique dans le sang. Ces patients présentent une tendance à la corticorésistance et un risque plus élevé de leucémie myéloïde aiguë.
Des études très récentes ont montré que la peau des patients atteints de VEXAS et de la Myelodysplasia cutis sont toutes deux marquées par l’activation des voies inflammatoires liées à la signalisation des cytokines, en particulier la signalisation des interférons.
La prise en charge actuelle du syndrome VEXAS repose sur les corticostéroïdes oraux en traitement de première ligne, sachant qu’il existe une corticodépendance. En l’absence de myélodysplasie, les inhibiteurs de JAK (ruxolitinib), le tocilizumab et l’azacitidine constituent la 2è et la 3è ligne de traitement. En cas de myélodysplasie, il faut envisager une allogreffe de moelle osseuse ou de l’azacitidine.
VEXAS est un syndrome hémato-auto-inflammatoire lié à l’hématopoïèse clonale et au concept de myelodysplasia cutis. La prise en charge future pourrait reposer sur le ciblage de la voie de l’interféron.
Session animée par : Dr Giovanni Damiani, Ph.D. et Prof. Lisa Beck
Conférenciers : Prof. Lisa Beck, Dr Christoph Schlapbach, Marc Vocanson, Dr Giovanni Damiani, Ph.D.
Rapport rédigé par le Dr Stella Michelaki, M.D., Ph.D.
Intervenante : Prof. Lisa Beck (Rochester, États-Unis)
Points à retenir :
Le Dr Beck a commencé par décrire les principales caractéristiques de la DA, notamment l’inflammation, les démangeaisons, les anomalies de la barrière cutanée et les anomalies microbiennes, que nous découvrirons plus en détail au cours de cette séance passionnante.
Selon elle, il est probable que l’avenir nous apportera des réponses et permettra des recherches plus approfondies concernant les énigmes dermatologiques suivantes :
Le réseau de recherche sur la dermatite atopique a étudié environ 1000 patients, âgés de 1 à 80 ans, répartis en groupes de patients staphylocoques positifs et staphylocoques négatifs, sur la base des résultats de laboratoire. Le groupe staphylocoques négatifs était négatif dans la peau lésionnelle et non lésionnelle ; la DA étant cependant plus sévère dans les lésions à culture positive. En outre, les patients à staphylocoques positifs présentaient une polarisation systémique beaucoup plus marquée en faveur d’une immunité de type 2. On a également demandé aux patients s’ils avaient des antécédents d’infections à staphylocoque ayant nécessité un traitement antibiotique. Ces antécédents étaient plus nombreux chez les patients à staphylocoques positifs, mais le groupe de patients à culture négative présentait également des valeurs élevées à cet égard.
Le Dr Beck a ensuite évoqué les recherches visant à déterminer si des cultures positives de staphylocoques déterminaient un dysfonctionnement de la barrière cutanée. Le dispositif Aquaflex (un appareil de mesure de la perte insensible en eau ou PIE) a été utilisé chez des patients à staphylocoques négatifs, ne souffrant pas de DA, sur différents sites cutanés, et chez des patients atteints de DA. Le groupe staphylocoques positifs-a montré un dysfonctionnement plus important de la barrière cutanée dans la peau non lésionnelle.
Une autre étude fascinante faisant appel à la méthode d’analyse de la couche cornée (Simpson et al.) utilise 20 bandes adhésives et, après chacune des 5 bandes séquentielles, la PIE est de nouveau mesurée. Là encore, la plus importante altération de la barrière cutanée a été observée chez les patients dont la culture était positive.
Le Dr Beck a poursuivi en évoquant les recherches utilisant des méthodes moléculaires(Kong et al.), qui montrent que la concentration de S. aureus à la surface de la peau est en corrélation avec les poussées de la maladie. L’abondance relative des bactéries non staphylocoques était marquée par rapport aux espèces de staphylocoques spécifiques. Les témoins sains présentaient une faible concentration de S. aureus, tandis que les patients atteints de DA présentaient des degrés variables de S. aureus, mais lors des poussées, ce pourcentage augmentaient chez les patients atteints de DA.
Des études métagénomiques (Kong et al.) indiquent que, lors des poussées de DA, une seule souche est présente à la surface de la peau. Ces souches ont été étudiées sur l’épithélium de souris, qui est devenu hyperplasique et a présenté une réponse inflammatoire Th2 et Th17.
Un article portant sur la réparation du ligament croisé antérieur (LCA) a étudié les facteurs susceptibles d’accroître le risque d’infection, et le rapport de cotes le plus élevé a été observé chez les patients atteints de DA (Kawata M et al.).
L’abondance de S. aureus entraîne des altérations du microbiome (lorsqu’une espèce bactérienne s’accroît, d’autres sont affectées et peuvent diminuer, ce qui entraîne des modifications du microbiome).
Dans le cadre d’études récentes, 100 % des patients atteints de DA modérée à sévère ont montré une colonisation par S. aureus selon des méthodes moléculaires, alors que des études cliniques en laboratoire ont montré que 45 à 95 % des patients atteints de DA étaient colonisés par S. aureus (Simpson EL et al., Byrd AL et al., Bin L et al.).
En outre, les patients dont le S. aureus était cultivable présentaient une mutation Th2 plus importante, une maladie plus sévère et un dysfonctionnement de la barrière cutanée plus important, et étaient associés à des complications virales telles que l’eczéma herpétique.
Une autre étude intéressante a suivi environ 3000 patients afin d’évaluer la sévérité de la maladie sur une période de 3 mois (positivité des cultures de staphylocoques et sévérité selon le score de Rajka et Langeland) (Simpson et al.). L’étude regroupait peau non lésionnelle à staphylocoques positifs, peau lésionnelle à staphylocoques positifs et staphylocoques présents à la fois sur la peau lésionnelle et sur la peau non lésionnelle. Une augmentation des staphylocoques cultivables a été observée sur tous les sites.
Il a également été démontré que jusqu’à 60 % des patients atteints de DA pouvant être cultivés avaient des antécédents positifs de S. aureus sous traitement antibiotique.
À sa surface, S. aureus exprime des molécules d’adhésion destinées à se lier aux protéines de la plaie. Les patients atteints de DA présentent une expression plus élevée de ces protéines. Par conséquent, leur peau devient plus propice à la fixation de S. aureus (Paller A et al., Deng L et al.).
S. aureus produit également des toxines et des protéases susceptibles de provoquer la mort des kératinocytes ou des cellules épithéliales, de perturber la barrière cutanée, etc. Récemment, on a découvert que la protéase V8 pouvait activer les terminaisons nerveuses de la peau (mécanisme PAR1), provoquant ainsi des démangeaisons.
S. aureus libère des molécules qui induisent une solide réponse immunitaire innée. S. aureus produit des super-antigènes, dont certains altèrent l’immunité de type 2.
Le Dr Beck a ensuite fait la distinction entre les bonnes et les mauvaises bactéries.
S. aureus.
S. hominis libère des peptides qui éliminent S. aureus sans nuire aux autres bactéries commensales.
Une petite cohorte suisse (Meylan et al.) a étudié des cultures de S. aureus issus d’écouvillons axillaires à différents stades jusqu’à l’âge de 2 ans. Les participants ayant effectivement développé la DA présentaient une colonisation plus importante par S. aureus , et une catégorie en particulier présentait un risque élevé (nourrissons ayant au moins un parent atteint de DA). Il est intéressant de noter que 2 mois avant le diagnostic, les patients atteints de DA présentaient déjà une colonisation accrue par S. aureus . Cette étude suggère donc que S. aureus intervient avant l’apparition de la maladie.
Une étude irlandaise sur le microbiome a montré que la colonisation par des staphylocoques commensaux ( staphylocoques à coagulase négative) pouvait réduire le risque de DA (Kennedy et al.). Contrairement à l’étude précédente mentionnée ci-dessus, on n’a pas constaté d’augmentation de S. aureus avant la maladie.
Le Dr Beck a poursuit son exposé en se demandant si l’inflammation de type 2 des défauts épithéliaux pourrait favoriser la colonisation par S. aureus. Si des cytokines Th2 (4 et 13 principalement étudiées) sont présentes, elles peuvent contrecarrer la « bonne » réponse bactérienne (Th17). L’inflammation Th2 entraîne également des modifications des lipides, une réduction des PAM et, enfin, une augmentation de l’expression des molécules liées à l’adhérence de S. aureus.
On a suggéré le rôle de défauts épithéliaux pour expliquer la prédominance des staphylocoques, tels que le pH alcalin, l’augmentation de la teneur en sodium, la réduction de la réponse immunitaire innée de l’épithélium, le cycle démangeaisons/grattage.
Actuellement, il n’existe aucun traitement destiné à cibler spécifiquement S. aureus. Les antibiotiques systémiques peuvent éliminer à la fois les bactéries pathogènes et les bonnes bactéries. Le goudron de houille peut réduire le nombre de staphylocoques et augmenter la concentration des Cutibacterium. Les corticostéroïdes topiques réduisent la concentration de S. aureus. Le Dr Beck a expliqué que les UVB à bande étroite n’ont pas d’effets manifestes sur l’abondance de S. aureus. Enfin, la bactériothérapie constitue une nouvelle évolution prometteuse, tandis que l’essai mené sur S. hominis (à lire prochainement) et l’étude sur Roseomonas mucosa n’ont pas atteint le critère d’évaluation primaire et ne sont plus poursuivis.
Les probiotiques oraux semblent réduire le risque de DA, mais il n’a pas été démontré qu’ils pouvaient l’améliorer une fois la maladie déclarée.
Une étude de cohorte sur les bains de blanchiment, publiée dans une revue pédiatrique en 2009, a montré qu’ils étaient bénéfiques dans la DA. Depuis lors, de nombreuses publications ont montré que les bains de blanchiment n’ont aucun effet sur S. aureus. Une étude ouverte chez des adultes atteints de DA légère à sévère a montré une amélioration clinique sur les démangeaisons et le sommeil (Huang JT et al., Stolarczyk A et al.).
Le Dr Beck a ensuite abordé la question des produits biologiques, en commençant par le dupilumab (anticorps monoclonal bloquant les IL4 et IL13). Une étude de cohorte pédiatrique a montré(Paller AS et al.) que le groupe dupilumab présentait un risque plus faible d’infections cutanées non virales. Un essai contrôlé, randomisé, en double aveugle, d’une durée de 6 semaines, a été menu sur un groupe dupilumab par rapport à un groupe placebo. L’abondance des staphylocoques (mesurée par PCR) a chuté de manière significative au bout de 3 jours et a continué de diminuer jusqu’à environ 4 semaines, puis l’étude s’est poursuivie sous la forme d’un essai ouvert où le groupe placebo a montré une baisse significative et où les bactéries ont chuté jusqu’à 16 semaines. L’effet maximal semble avoir été atteint à 16 semaines.
Les diminutions de S. aureus sont en corrélation avec les améliorations de la sévérité de la DA (Simpson E et al.).
Le tralokinumab (anti-IL13) réduit la colonisation cutanée par S. aureus (Beck L et al.). Cette étude porte sur l’abondance mesurée par PCR à 16 semaines.
Le dupilumab entraîne une diminution de l’abondance de S. aureus dans la peau atteinte de DA, mais pas la ciclosporine (Hartmann J. et al.). TREAT Germany (un registre de patients atteints de DA traités par voie systémique) a étudié des patients atteints de DA, après 3 mois de traitement par ciclosporine ou dupilumab, ainsi que l’abondance relative de S. aureus. On a constaté que la baisse était plus marquée dans le groupe traité par dupilumab que dans le groupe traité par cyclosporine. Cependant, l’amélioration clinique était similaire dans les deux groupes.
Le Dr Beck a conclu sa conférence en soulignant que S. aureus joue un rôle clé dans le microbiome de la peau atteinte de DA.
Intervenant : Prof. Dr Christoph Schlapbach (Berne, Suisse)
Points à retenir :
Le Dr Schlapbach a commencé par évoquer les mécanismes immunitaires et les biomarqueurs impliqués dans la DA. Les défauts de la barrière cutanée et la dysbiose microbienne conduisent à l’activation de l’immunité innée, impliquant les cellules de Langerhans, les cellules dendritiques et les kératinocytes. Des cytokines sont alors libérées, ce qui finit par mener à l’activation de l’immunité adaptative dans le derme, principalement des cellules Th2, qui entraînent l’expression de l’IL13, de l’IL22 et d’autres, qui renvoient ensuite un signal aux kératinocytes. L’aggravation des défauts de la barrière cutanée, l’hyperprolifération et le prurit apparaissent.
En bloquant les cytokines qui se trouvent en aval des cellules Th2, la DA s’améliore de manière significative. Cependant, l’action en amont des cellules Th2 n’est pas encore totalement comprise. Les essais portant sur l’IL33 ont échoué. Il n’a pas non plus été prouvé que la TSLP en était un facteur déterminant.
Le Dr Schlapbach a brièvement évoqué le psoriasis, en rappelant le phénomène de Koebner : alarmines, IL37 activant les pDC, INF de type 1 activant les cellules dendritiques (DC), qui conduisent ensuite à la libération d’IL23, activant les Th17, qui induisent à leur tour la production d’IL17, laquelle finit par provoquer la maladie. Par conséquent, le blocage de l’IL23 dans ce cas est une cible clé dans le traitement du psoriasis. Le Dr Schlapbach se demande pourquoi le blocage de l’IL23 est si efficace dans le traitement du psoriasis. Pour étudier cette question, il faut prendre en compte les sous-populations de cellules Th17. Les souris et les études translationnelles permettent de comprendre que les sous-populations sont réparties en 1) conventionnelles (qui expriment l’IL17, l’IL10) et 2) pathogènes (qui expriment l’IL17, l’INFγ, le GM-CSF), et dépendent de l’IL23 pour l’activation. Le blocage de l’IL17 et de l’IL23 améliore la DA. Les infections à Candida sont beaucoup plus fréquentes en cas d’inhibition de l’IL17. Cela s’explique par le fait que le blocage de l’IL17 l’empêche de pénétrer dans les cellules T conventionnelles et pathogènes, ce qui a pour effet d’interrompre la réponse immunitaire antibactérienne. Le blocage de l’IL23 bloque de façon sélective l’IL17 provenant de la sous-population pathogène et autorise l’IL17 provenant de la sous-population conventionnelle, ce qui offre une protection contre les infections.
Le Dr Schlapbach a suggéré qu’il existe des cellules Th2 conventionnelles (IL4, IL23) et pathogènes (IL13, IL5, IL22, IL9R, IL17RB, PPARγ). Les cellules Th2 spécifiques de l’allergène possèdent ce phénotype pathogène.
Le Dr Schlapbach a ensuite évoqué les biomarqueurs de la DA. L’International Eczema Council a dressé la liste des biomarqueurs présents dans la peau et le sang des patients atteints de DA. La question de l’IL18 est abordée, car il s’agit d’un biomarqueur potentiel surprenant. Le Dr Schlapbach note que l’IL18 favorise la réponse immunitaire de type 1 et la production d’INFγ par les cellules NK et Th1. Des études ont montré que les variantes du gène IL18R sont fortement associées au risque de développement de la DA. Il a été question d’une étude GWAS sur un diagramme de Manhattan. La filaggrine et les variantes génétiques de l’IL13 sont associées à la DA.
Une étude suggérant que l’IL18 est un biomarqueur de la DA est en cours d’analyse. Les patients ont été recrutés dès la naissance, des bandelettes pour les biomarqueurs immunitaires et cutanés ont été examinées à 2 mois, puis le suivi s’est poursuivi jusqu’à l’âge de 2 ans dans le but d’enregistrer si les participants ont développé la DA et à quel degré de sévérité. Le rapport de risque utilisant les biomarqueurs a été estimé. Si des niveaux élevés d’IL18 sont observés sur la peau à l’âge de 2 mois, le risque de DA modérée à sévère est multiplié par trois.
Une étude de Zhang et al. portant sur des patients atteints de DA et de psoriasis à différents degrés de gravité, a analysé des biopsies de peau et des échantillons de sang et a procédé à une recherche d’ARN unicellulaire, à une analyse de la clonalité des cellules T et à une recherche du groupe de cellules T le plus approprié pour les patients atteints de DA. Les cellules Th2 expriment des niveaux élevés d’IL22, d’IL13, de GATA3, d’IL17RB, d’IL9R et d’IL18R1.
Une étude a examiné des cellules T provenant d’individus atteints ou non de DA et les a incubées avec diverses cytokines pour lesquelles ces cellules exprimaient un récepteur. On a pu constater que seule l’IL9 pouvait réguler à la hausse les récepteurs IL18R sur ces cellules T (Schärli et al.).
Des échantillons de sang de patients atteints ou non de DA ont été examinés (Schärli et al.). Les niveaux d’IL18 dans le sang périphérique ont été évalués, les patients atteints de DA présentant des niveaux plus élevés. L’incubation du sang des participants non atteints de DA avec de l’IL9 permet de réguler l’IL18R à la hausse.
Le Dr Schlapbach note que l’IL9 et l’IL18 induisent la sécrétion d’IL13 par les cellules pTh2 dans la DA.
Une autre étude fascinante (Schärli et al., en cours de révision) portait sur des biopsies lésionnelles issues de sites atteints de DA active. Les biopsies ont été divisées en 4 parties : 2 groupes pour l’incubation (48h) avec la protéine de liaison IL18 et 2 groupes témoins, puis la production de cytokines a été évaluée (analyse multiplex des protéines et de la sécrétion de cytokines). Le blocage de la signalisation de l’IL18 a montré sa capacité à réduire la production d’IL13 et d’IL22 dans les surnageants.
Une étude utilisant des bandes adhésives (peau lésionnelle et non lésionnelle) chez des patients présentant des poussées de DA ainsi que des biopsies a montré une corrélation entre le niveau de protéine épidermique de l’IL18 et le niveau d’ARN dermique des cytokines. Des niveaux élevés d’IL18 dans l’épiderme se traduisent par des niveaux élevés d’ARN IL13 dans le derme, ce qui est également le cas pour l’IL22, mais pas pour l’IL4 (Schärli et al., en révision).
Des études transcriptomiques spatiales sur la peau lésionnelle et non lésionnelle ont montré que l’expression de l’IL13 était principalement observée dans le derme supérieur et l’épiderme inférieur de la peau lésionnelle. Les analyses de groupe ont montré une corrélation entre les chiffres du groupe IL13 et ceux des groupes IL18R1 et IL18RAP, ce qui suggère un lien fonctionnel entre les deux.
Intervenant : Marc Vocanson
Points à retenir :
Marc Vocanson a débuté sa conférence en soulignant l’importance de la DA, qui touche 15 % de la population pédiatrique et représente 1 % de l’ensemble des maladies professionnelles. Les lésions cutanées sont induites par le recrutement et l’activation de cellules T spécifiques à l’allergène. Les allergènes peuvent être des produits chimiques ou des protéines. De nombreuses personnes sont exposées à des allergènes environnementaux, mais peu d’entre elles développent une maladie.
Il a ensuite abordé la question de la sensibilisation, représentée par le schéma explicite ci-dessous :
Figure 1. L’importance de l’effet de l’exposome externe sur les barrières épithéliales de la peau, des poumons et de l’intestin (Z C Sozener et al., Allergy 2022).
Marc Vocanson distingue les caractéristiques primaires des allergènes, telles que la taille, la lipophilie, la réactivité des protéines et les fonctions enzymatiques. Les réactions immunitaires sont également influencées par les conditions d’exposition, les facteurs environnementaux, les gènes et le rayonnement UV.
Marc Vocanson a expliqué de quelle manière le rayonnement UV peut influer sur le processus de sensibilisation. Une étude réalisée par Granstein et al. en 1983 a montré que lorsque des souris étaient exposées aux UVB trois jours avant l’induction de la réaction allergique standard à un haptène, l’exposition aux UVB réduisait considérablement l’apparition d’une réaction allergique. Les chercheurs ont collaboré avec l’équipe du Prof. Peter Wolf pour étudier la manière dont le microbiome cutané module l’effet du rayonnement UV sur la réponse cellulaire et l’immunité (Patra et al.). Des études sur les souris ont exploré la relation entre le microbiome cutané et l’immunosuppression induite par les UV. On a constaté qu’un microbiome déficient entraînait une immunosuppression accrue induite par les UVB et une tolérance au DNFB (Vijay Kumar Patra et al.).
L’acide urocanique (UCA) constitue un sujet de recherche intéressant, car on le trouve généralement dans la couche cornée. Dans son isoforme trans, il se transforme en trans-UCA et, sous l’effet des UV, il s’isomérise en cis-UCA. Marc Vocanson souligne que les inhibiteurs topiques de l’urocanase peuvent modérer le métabolisme bactérien. En outre, les traitements par cis-UCA et UVB peuvent également entraîner des modifications bactériennes. Le trans-UCA et le cis-UCA jouent tous deux un rôle important, notamment en tant qu’écrans solaires naturels, facteurs d’hydratation naturelle, et contribuent à maintenir le pH de la peau. Le Cis-UCA possède de puissantes propriétés anti-inflammatoires et immunosuppressives (PH Hart et al.). Marc Vocanson suggère que les expositions aux UV-B et au cis-UCA entraînent une restructuration transitoire des communautés bactériennes. Il est intéressant de noter que les inhibiteurs topiques de l’urocanase modulent le métabolisme des bactéries. Les deux traitements, par cis-UCA et UVB, ont montré un remodelage des phyla et des espèces de bactéries (Patra et al.). Des études sur les souris suggèrent que la raréfaction locale des bactéries cutanées augmente la réponse immunitaire médiée par le cis-UCA et conduit donc à une tolérance accrue au DNFB.
Marc Vocanson a conclu en mentionnant que le fait d’éliminer les bactéries cutanées avant l’exposition aux UV peut améliorer l’efficacité globale des traitements de photothérapie.
Intervenant : Dr Giovanni Damiani, Ph.D. (Milan, Italie)
Points à retenir :
Le Dr Damiani a mentionné les critères existants dans la DA : les critères de Hanifin et Rajka, les critères de l’UK working party et les critères de Millenium, leur hétérogénéité semble se refléter sur la théorie de la marche atopique.
« Syndrome chronique résultant d’une interaction dysfonctionnelle entre les épithéliums dérivés de l’ectoderme et de l’endoderme et l’environnement extérieur (exposome), caractérisé principalement par des manifestations dermatologiques (eczéma), respiratoires (asthme, rhinite), oculaires (conjonctivite) et gastro-intestinales (allergies alimentaires) » (Kubo M., et al.).
Même si la DA n’est pas mortelle, elle impacte fortement la qualité de vie.
Le Dr Damiani a indiqué que la progression linéaire de la maladie atopique est partiellement rejetée, au profit d’une interaction plus complexe entre la génétique et l’environnement.
50 % de la population pédiatrique n’évolue pas de la DA vers des symptômes respiratoires et gastro-intestinaux (Maiello N., et al. Children 2022). En outre, la théorie classique de la marche atopique surestime largement les comorbidités allergiques, en particulier les comorbidités gastro-intestinales.
Récemment, un large éventail de comorbidités a été regroupé dans le mnémonique VINDICTATE-P (Silveberg NB et al.) :
Le Dr Damiani suggère que, pour comprendre les comorbidités et les mesures d’association, nous devons être conscients des différences entre le risque relatif (RR), le rapport des cotes (OR) et le rapport de risques (HR). Il précise ensuite que le terme comorbidité désigne la présence de maladies ou d’états pathologiques simultanés chez un même patient. Toutefois, ce terme ne renseigne pas sur le lien entre la cause et l’effet, et ne donne aucune information quant à la sévérité. La cooccurrence ne renseigne pas sur l’apparition des entités. Enfin, la sévérité n’est pas prise en compte lorsque l’on utilise ce terme, d’où la nécessité de l’utiliser avec prudence dans la pratique clinique, comme le souligne le Dr Damiani.
Afin d’interpréter les comorbidités statistiquement significatives, il faut être conscients du laps de temps sur lequel on évalue la concomitance de 2 conditions ou plus et de la séquence de la maladie, qui peut avoir de graves conséquences sur le pronostic et le traitement.
On parle de comorbidité lorsqu’il existe une maladie supplémentaire liée à la maladie de référence chez un patient.
En ce qui concerne les comorbidités et l’étiologie, le Dr Damiani indique qu’il est important d’examiner la présence ou non d’une association étiologique, d’une causalité directe, de facteurs de risque associés, d’une hétérogénéité et, enfin, de s’assurer que la maladie est indépendante des facteurs de risque (Koskinen M et al.).
La multimorbidité est un autre terme utile, qui décrit la situation d’un même patient souffrant de plusieurs maladies (au moins 5).
Le poids de la morbidité est définie comme l’impact global des maladies chez un patient, en tenant compte de leur sévérité.
La complexité du patient correspond à l’impact global des maladies sur ce patient, en tenant compte de leur sévérité et d’autres facteurs liés à la santé (Valderes JM. et al.).
Dans cette conférence, les comorbidités sont présentées comme un moyen potentiel de présenter la complexité. Les comorbidités et le mode de vie sont également fortement corrélés (Solomon I et al.).
Les termes de prévention secondaire (prévention des récidives) et tertiaire (pour atténuer l’impact de la maladie actuelle) ont également été expliqués.
Le Dr Damiani a expliqué de quelle manière les modificateurs de la maladie peuvent modifier les comorbidités, en indiquant par exemple que le dupilumab peut réduire de 37 % le risque d’apparition de nouvelles allergies, et a souligné l’importance d’obtenir de nouvelles données pour les futurs médicaments (Geba GB et al.).
Session animée par : Prof. Tilo Biedermann et Prof. Emma Guttman-Yassky
Conférenciers : Prof.Emma Guttman-Yassky, Dr Tilo Biedermann, Dr Phyllis I. Spuls et Dr Robert Bissonnette
Rapport rédigé par le Dr Stella Michelaki, M.D., Ph.D.
Points à retenir :
Intervenante : Prof. Emma Guttman-Yassky, MD, Ph.D. (New York, États-Unis)
Le professeur Guttman a débuté la session en indiquant que la DA évolue vers une médecine personnalisée et a expliqué qu’il fallait connaître les différences entre les divers phénotypes, en particulier le nouveau phénotype émergent, la DA de l’adulte.
La DA est l’affection cutanée inflammatoire la plus courante, avec une prévalence de 20 % au cours de la vie et une charge de morbidité qui affecte la vie quotidienne de diverses manières. Entre 5 et 8,1 % des adultes dans les pays développés présenteront une DA.
Le professeur Guttman-Yassky note que la DA de l’adulte apparaît pour la première fois à l’âge adulte. Il existe un important besoin non satisfait de thérapies ciblant spécifiquement la DA de l’adulte. Elle se caractérise par des aspects cliniques et épidémiologiques uniques par rapport à la DA d’apparition pédiatrique qui persiste plus tard à l’âge adulte. Auparavant, on pensait que les adultes atteints de DA avaient la maladie depuis l’enfance. Cependant, cette idée est fausse. La proportion d’adultes souffrant de DA de l’adulte varie entre 25 et 50 %. Le Dr Guttman a indiqué que l’apparition de la DA est bien répartie dans les tranches d’âge supérieures.
Chez 85 % des enfants atteints de DA, la maladie apparaît avant l’âge de 5 ans. Dans 20 à 50 % des cas de DA pédiatrique, la maladie se poursuit à l’âge adulte. La persistance de la maladie est plus probable lorsque les facteurs suivants sont présents : apparition plus tardive, durée plus longue, sévérité plus élevée.
Les facteurs de risque de persistance sont les suivants : maladie de longue durée, apparition tardive, sévérité accrue.
Le professeur Guttman-Yassky explique que la DA de l’adulte présente un phénotype clinique distinct. Les présentations cliniques atypiques sont plus fréquentes (prurigo nodulaire, eczéma nummulaire, eczéma folliculaire). Elle est plus fréquemment associée à des vésicules et des nodules et à la perte du tiers externe des sourcils, désigné en clinique sous le nom de signe de Hertoghe (plus fréquent dans cette population de patients). Il est intéressant de noter que la DA de l’adulte est moins associée à la xérose et au prurit que la DA pédiatrique.
Il est fréquent d’observer un eczéma diffus. Il peut se manifester au niveau péri-oculaire. Le visage, le cou, le cuir chevelu, les mains et les pieds sont d’autres sites de présentation possibles.
Les études montrent que la DA de l’adulte est davantage associée aux facteurs de risque du tabagisme et présente moins de comorbidités atopiques personnelles et familiales que la DA pédiatrique. D’autres études intéressantes présentées au cours de la session nous apprennent que la DA pédiatrique et la DA de l’adulte ont en commun une dysrégulation des gènes immunitaires.
Le professeur Guttman-Yassky a présenté les principaux diagnostics différentiels de la DA de l’adulte :
Notons que, dans certains cas, il faut envisager une biopsie afin de poser un diagnostic.
L’exposition à la pollution, l’alimentation et le stress peuvent avoir un impact différent sur l’évolution de la DA.
La DA est un ensemble d’endophénotypes (polarisation immunitaire/barrière épidermique/phénotypes cliniques : DA européenne, DA asiatique, DA afro-américaine, DA pédiatrique, psoriasis).
L’intervenante a ensuite souligné que tous les sous-types de DA ont en commun l’activation des Th2. Les différents phénotypes de DA peuvent nécessiter un ciblage supplémentaire des cytokines.
Les Th2 et Th22 définissent le phénotype central de la DA dans tous les groupes d’âge (Renert-Yuval et al.).
Lorsque l’atopie apparaît chez le nourrisson, l’IL5, l’IL33 et l’IL17 sont des facteurs clés. Chez l’adulte, en revanche, on observe beaucoup plus de Th17, ce qui marque la chronicité de la maladie.
Une étude visant à étudier les différences moléculaires dans la peau et le sang a été menée auprès d’adultes de plus de 20 ans présentant une DA modérée à sévère, avec un début de la maladie datant de plus de 20 ans, un SCORAD de 25 et plus, un IGA de 3 et plus, des antécédents personnels de DA ou d’atopie, ce qui a été considéré comme un critère d’exclusion. Pour le groupe pédiatrique, les critères étaient les mêmes et les participants devaient avoir déclaré la maladie avant l’âge de 10 ans. Des témoins sains ont été associés aux patients. Les analyses suivantes ont été réalisées : séquençage de l’ARN de la peau, immunohistochimie, test multiplex Olink proseek et RT-PCR pour les marqueurs cutanés. La cohorte DA de l’adulte présentait des taux plus élevés d’hypertension, de diabète et d’hypercholestérolémie. Le groupe pédiatrique a présenté une hyperplasie plus importante, un épaississement de l’épiderme, une augmentation de la kératine 16 et des infiltrats plus importants dans la peau lésionnelle et non lésionnelle. Dans le transcriptome global de la peau, une forte activation immunitaire a été observée dans les deux groupes de DA, mais le groupe pédiatrique lésionnel présentait une inflammation plus importante, alors que le groupe non lésionnel était plus sujet à l’inflammation dans le groupe DA de l’adulte. Les deux groupes de patients atteints de DA présentaient une dérèglement des gènes immunitaires. Les voies Th2 et Th22 ont été dérégulées dans les deux groupes DA. Cependant, la DA de l’adulte a montré une plus grande prédominance des Th1. Dans le groupe DA pédiatrique, une plus grande proportion de Th17 a été signalée. L’altération de la barrière épidermique est beaucoup plus importante chez l’enfant (Facheris, Guttman-Yassky et al.).
L’expression de nombreux gènes immunitaires est en corrélation avec la sévérité de la maladie dans les deux phénotypes.
L’analyse protéique du sérum a montré que les marqueurs cardiovasculaires et liés à l’athérosclérose étaient beaucoup plus élevés dans le groupe atteint de DA de l’adulte.
De plus, les biomarqueurs sanguins étaient en corrélation avec le SCORAD. Dans la DA de l’adulte et la DA pédiatrique, les marqueurs inflammatoires et cardiovasculaires sont en corrélation positive avec la sévérité de la maladie (SCORAD) (DA pédiatrique : TSLP, IL4R...).
Les biomarqueurs Th1 sont en corrélation avec la peau et le sérum dans la DA de l’adulte.
Le professeur Guttman-Yassky a conclu en notant que la DA de l’adulte présente une inflammation systémique plus élevée et une augmentation des marqueurs cardiovasculaires avec une plus forte augmentation des Th1 dans la peau. Il est important d’en tenir compte, car certains traitements peuvent cibler uniquement les Th2, en particulier lorsque les patients présentent une atopie au niveau du visage.
Points à retenir :
Intervenant : Prof. Tilo Biedermann, MD (Munich, Allemagne)
Points à retenir :
Ces dernières années, le nombre d’entrées dans PubMed sur le thème de la DA et du microbiome a fortement augmenté. Les recherches se sont principalement concentrées sur le rôle du microbiome dans la pathogenèse de la DA, sur le rôle de la barrière cutanée et de l’immunité, ainsi que sur la prévention et les traitements.
Le professeur Biedermann a débuté sa conférence par un aperçu de la pathogenèse de la DA et de l’importance de la normalisation de la fonction barrière, de la peau sèche et de l’inflammation de type 2, ainsi que de la modulation du microbiome dans la DA. On observe en effet une augmentation de la sensibilisation aux allergies alimentaires. En cas de mutation de la filaggrine, la probabilité d’allergie aux arachides est élevée. Lorsque l’inflammation de type 2 survient, la filaggrine diminue. À l’inverse, il existe une interdépendance entre la réponse immunitaire et le dysfonctionnement de la barrière cutanée (Brough et al.).
Les cytokines, IL4, IL13 peuvent être ciblées et sont susceptibles de réduire la fonction barrière (Howell et al.).
Les réponses immunitaires de type 17 et de type 1 sont perturbées. Les cytokines de type 2 peuvent supprimer l’IL23, en particulier dans la phase initiale. Cependant, la prolifération de S. aureus induit une immunité de type 3. Une intervention ciblée supprime l’inflammation de type 2 et permet de restaurer les protéines qui favorisent la fonction barrière et la réactivité des peptides antimicrobiens.
Le Dr Biedermann se réfère à la recherche de HH Kong et al. de 2012 qui a montré que le microbiome constitue la base de la DA. Le traitement de la maladie a permis de rétablir la diversité.
Une étude de Callewaert et al. sur le dupilumab et le microbiome est ensuite évoquée. Cette étude a montré que l’utilisation de ce traitement permettait de réduire considérablement la quantité de S. aureus et de rétablir la diversité.
Il est ensuite question d’une étude fascinante sur le tralokinumab, S. aureus et la fonction barrière. L’inhibition de l’IL13 a permis de réduire la quantité de S. aureus et d’augmenter la diversité du microbiote (Beck LA et al.).
Il existe une interdépendance évidente entre la DA et la dysbiose microbienne (Eyerich S et al.).
Le Dr Biedermann a ensuite évoqué les mutations de la filaggrine (Clausen ML et al.) Des études ont montré qu’en cas de mutation, la probabilité d’une augmentation de la quantité de S. aureus sur la peau est significativement plus élevée dans les lésions cutanées.
Hölge et al. ont induit une dysbiose sur la peau de souris afin d’identifier les conséquences de la dysbiose microbienne sur la peau dans la DA précoce. Il est intéressant de noter que les cellules productrices d’IL4 et d’IL13 sont régulées très tôt après l’application de S. aureus.
Enfin, le professeur Biedermann a classé les concepts d’intervention selon trois niveaux : a. restauration de la barrière cutanée, b. réduction de l’inflammation et c. modulation microbienne directe.
Une étude portant sur l’utilisation d’émollients dans la DA et la composition du microbiome(Glatz M et al.) a montré une plus grande diversité lorsque l’émollient est bien appliqué sur la peau. L’utilisation d’émollients semble donc modifier la composition de l’agrégation. Toutefois, le Dr Biedermann note que les « grandes » études visant à démontrer le pouvoir des émollients sur la prévention de la DA n’ont pas été couronnées de succès.
En outre, les ligands des bactéries peuvent induire une immunité, mais en même temps, certains ligands sont également des médiateurs des réponses de tolérance. Pourrait-on l’utiliser pour moduler l’inflammation ?
Des études ont exploré l’idée d’utiliser les « bonnes » bactéries comme stratégie thérapeutique (Gueniche et al.) avec un groupe appliquant la crème verum V. filiformis contre un groupe placebo, en traitement d’un mois pour la DA légère, et montré une différence très significative entre l’émollient et le groupe traité par placebo.
Les bactéries non pathogènes qui atténuent l’inflammation de la DA induisent des cellules dendritiques productrices d’IL10 et des cellules TR1 régulatrices (Voltz et al., J Invest Dermatol 2014). Il s’agit d’une autre façon d’illustrer la manière dont les bactéries peuvent réduire l’inflammation.
La Roseomonas mucosa a été isolée et placée dans la peau atteinte de DA et une réduction de la sévérité de la maladie a été observée (Myles IA et al.). Ensuite, dans le cadre d’un essai en double aveugle contrôlé par placebo, la recherche s’est approfondie et a malheureusement été interrompue, car elle n’a pas réussi à atteindre son objectif principal qui consistait à réduire le score EASI de 50 % (Tham et al.).
Une étude a été menée sur des traitements à base d’endolysine pour lutter contre S. aureus (de Wit J et al.). Elle a permis de démontrer une réduction de la DA et de l’inflammation de la peau. La recherche s’est ensuite orientée vers une étude en double aveugle qui n’a pas non plus réussi à démontrer une supériorité par rapport au placebo.
L’inflammation de type 2 persiste et n’est pas réduite, simplement en limitant la prolifération de S. aureus.
Des souches de S. hominis ont été étudiées en vue de développer des antibiotiques ciblant directement S. aureus, notamment en combinaison avec des peptides antimicrobiens (Nakatsuji et al.).
De futures recherches sur la prévention et la rechute de la DA sont prévues.
Intervenante : Dr Phyllis I. Spuls, MD, Ph.D. (Amstelveen, Pays-Bas)
Points à retenir :
Le professeur Spuls a débuté cette session en évoquant les principales caractéristiques de la DA, une maladie chronique non contagieuse qui a un impact sur les patients et la société. Chez l’enfant, la prévalence est de 20 % et chez l’adulte de 10 % (GADO 2022).
La DA présente un large éventail de manifestations, notamment : érythème, squames, gonflement, papules rouges, vésicules, exsudation, excoriations et lichénification. Il importe donc d’utiliser des critères de diagnostic validés. Il n’existe aucun consensus validé concernant les critères de diagnostic à utiliser en contexte clinique et de recherche.
Une revue systématique réalisée en 2008 a révélé l’existence de 10 critères diagnostiques différents (Brenningmeijer et al.). Cette revue systématique a été répétée en 2024(Muster et al.) et 28 critères distincts ont été relevés. Le professeur Spuls indique que les critères les plus utilisés sont ceux de Hanfin et Rajka et qu’ils ont la meilleure sensibilité.
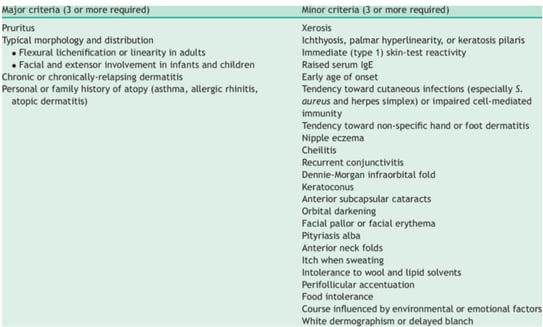
Figure 2. Critères de Hanfin et Rajka (Hanifin & Rajka, Acta Derm Venereol 1980)
Les critères du UK working party sont les plus spécifiques et les plus validés :

Figure 3. Critères du UK working party (Williams, BJD 1994)
Le professeur Spuls a souligné la nécessité de parvenir à un consensus sur les critères de diagnostic, qui doivent être fiables et reproductibles en clinique et en recherche, afin d’améliorer la prise en charge des patients atteints de DA.
Ce point est particulièrement important car il est essentiel pour pouvoir faire la distinction avec d’autres maladies.
Les diagnostics différentiels sont les suivants :
Il est important d’être bien informé sur les différents phénotypes, les présentations de couleur de peau, les distributions et les diverses caractéristiques cliniques.
Les phénotypes de la DA sont les suivants :
Le professeur Spuls a présenté une revue systématique sur les phénotypes (Bosma et al.), où le phénotype est défini comme un sous-groupe de patients atteints de DA. L’étude portait uniquement sur les phénotypes cliniques. (Le professeur Spuls a mentionné l’existence de près de 200 articles portant uniquement sur les phénotypes cliniques). Il est essentiel de parvenir à un consensus.
Il importe d’utiliser également des ensembles de résultats de base afin d’évaluer le traitement. Le travail de homeforeczema.org est brièvement évoqué. Il s’agit d’un exemple d’outil pouvant être utilisé pour mettre en commun et analyser les données, réduisant ainsi les recherches superflues.
L’échelle permettant de coter la surface et la sévérité de l’eczéma (EASI) est un outil pratique, facile à utiliser et validé, mais il est chronophage et peut ne pas être l’idéal pour les phototypes IV à VI.
La ligne directrice 2023 de l’EDF, qui commence par les traitements de base, encourage l’éducation des patients. Par exemple, ces derniers devraient être informés des facteurs déclencheurs de la DA, tels que les cosmétiques, les infections, les influences saisonnières et le stress. Ils doivent être informés de l’étiologie de la DA (génétique, environnement, dysfonctionnement de la barrière cutanée, modifications du microbiome, dysfonctionnement immunitaire). Ensuite, on procède à des bains quotidiens et brefs entre 27 à 30 °C pour éliminer les croûtes et les bactéries. Les bains de blanchiment peuvent réduire l’impétiginisation. Les émollients doivent être utilisés selon la méthode « soak and seal » (trempage et scellement), afin de prévenir les poussées et d’améliorer les symptômes.
Le professeur Spuls a présenté une revue Cochrane (Singleton et al.) qui résume les interventions pédagogiques et montre que l’éducation contribue à améliorer l’évolution de la DA.
Le professeur Spuls a indiqué qu’à l’heure actuelle, tous les produits ne sont pas disponibles aux Pays-Bas (tacrolimus), de sorte que les stéroïdes topiques restent un outil nécessaire.
(Silverberg et al.), (Nakagawa et al.)
Des études intéressantes ont été menées sur l’utilisation de traitements topiques dans la DA (notamment une méta-analyse du réseau Cochrane ainsi qu’une revue systématique et une méta-analyse d’essais randomisés) (S J Lax et al.), incluant 45 846 participants sur 291 études. On signale toutefois que cette étude a été menée principalement dans des pays à revenu élevé, surtout auprès de populations blanches. Seules 31 études se limitaient aux enfants de moins de 12 ans. 68 % des études ont été financées par l’industrie. Le traitement a duré entre 7 jours et 5 ans, mais la médiane de participation à l’essai a été de 21 à 28 jours. Ainsi, la méta-analyse en réseau n’est possible que pour les résultats à court terme, ce qui est contradictoire lorsque l’on parle de maladies chroniques telles que la DA. Cette étude Cochrane portait sur les corticostéroïdes topiques, les inhibiteurs topiques de la calcineurine, les inhibiteurs de la phosphodiestérase 4, les inhibiteurs de JAK, les activateurs des récepteurs d’aryl hydrocarbone et d’autres produits topiques, les comparateurs étant d’autres agents anti-inflammatoires et des véhicules. Le professeur Spuls a indiqué que l’existence de biais était élevée, principalement en raison des préoccupations concernant les rapports sélectifs. Les agents les plus efficaces étaient les corticostéroïdes topiques puissants, les inhibiteurs de JAK et le tacrolimus à 0,1 %. Les moins efficaces étaient les corticostéroïdes légers, les inhibiteurs de la PDE4 et le tapinarof à 1 %. Le professeur Spuls a noté qu’il manquait des informations concernant les effets secondaires.
Une comparaison entre la revue Cochrane et les lignes directrices est utile, mais des données vivantes seraient plus utiles en vue d’une analyse plus approfondie.
Le traitement par UV est recommandé chez l’adulte (NB-UVB, UVA1), mais il est généralement empirique et il existe peu de données factuelles.
Le professeur Spuls explique que les UVB ont des effets immunomodulateurs (suppression de l’immunité cellulaire, activation de l’action antimicrobienne innée à ), provoquent un épaississement de la couche cornée (rendant le patient moins sensible aux agents pathogènes) et, enfin, ont un effet anti-prurigineux (car ils induisent l’apoptose, inhibent les cellules de Langerhans et peuvent moduler la production de cytokines).
La dose initiale est fonction de la dose minimale d’érythème (MED) ou du phototype cutané de Fitzpatrick.
Les traitements ont lieu 2 à 5 fois par semaine. Il s’agit d’un traitement relativement bon marché, qui constitue donc une bonne option, en particulier pour certains groupes de patients.
Le professeur Spuls a posé les questions suivantes : quelle est la fréquence du traitement par UV dans la DA ? Est-il efficace et sera-t-il utilisé à l’avenir ? Une enquête(Vermeulen et al.), portant sur 229 dermatologues dans 30 pays européens, a révélé que 84,7 % des cliniciens prescrivent le traitement par UV (80,9 % en première intention [NBUVB] et 21,6 % en deuxième intention [PUVA]). Toutefois, il s’agit d’un cas où l’expérience est opposée à la preuve.
Une enquête (Steyn et al.), menée sur 114 participants, dans 27 pays européens, a révélé que le traitement NB-UVB était le plus souvent disponible, suivi de la PUVA et de l’UVA1. Dans 17 % des pays, des traitements NB-UVB à domicile étaient disponibles. Toutefois, on note qu’il existe de grandes variations en ce qui concerne la prescription et la pratique.
Une revue systématique (Garritsen et al.) a montré une préférence pour NB-UVB et UVA1.
Une revue Cochrane plus récente (Musters et al.) a ensuite classé les patients en deux catégories : ceux qui reçoivent une photothérapie à court terme ( moins de 16 semaines) et ceux qui reçoivent une photothérapie à long terme (plus de 16 semaines). 32 contrôles randomisés ont été inclus, portant sur la DA modérée à sévère et se concentrant sur le phototype de Fitzpatrick II - IV, le plus souvent. Le traitement NB-UVB a été le plus souvent signalé, suivi du BB-UVB, puis du PUVA, et enfin de l’UVA1. Le faible degré de fiabilité des résultats et le risque de biais ont été mentionnés. Après 12 semaines, le groupe NB-UVB a montré une plus grande amélioration des signes cliniques.
Le professeur Spuls décrit les effets indésirables, notamment les réactions phototoxiques, les irritations, les brûlures, les surinfections bactériennes, l’aggravation de l’eczéma et l’eczéma herpétique.
Une étude soumise par Knöps et al. porte sur l’efficacité et la sécurité de la combinaison de la photothérapie et des topiques dans le traitement de l’eczéma atopique. Elle comprend 29 cas consignés sur les topiques et le traitement UV, et seulement 1 rapport (Tzung et al.) concernant l’efficacité (tacrolimus + UVB, et la combinaison semble plus efficace que la monothérapie). Les préoccupations concernant le risque de biais ont donc été soulignées, mais aucune conclusion n’a été établie concernant l’efficacité et la sécurité.
Le professeur Spuls a ensuite évoqué une étude en cours aux Pays-Bas sur le NB-UVB, qui inclut de nombreux centres. L’essai BRONTE a également été mentionné (Drucker A et al.) (Cohorte canadienne sur la DA pour l’immunologie translationnelle et l’imagerie, essai contrôlé randomisé Nested BROadbandvd NarrowbandphotoTherapy for Eczemarandized controlled trial).
Ils sont principalement regroupés en traitements conventionnels, biologiques, inhibiteurs de JAK et anticorps monoclonaux.
Le professeur Spuls a rappelé que les médecins devaient d’abord tenir compte des comorbidités, de la co-médication, du désir d’enfant ou de l’allaitement, des infections, etc.
Les maladies de la surface oculaire sont fréquentes et il existe un consensus d’experts sur la prise en charge des troubles de la surface oculaire liés au dupilumab chez les patients atteints de DA (Achten et al.).
Pour la conception, la grossesse et l’allaitement, il existe des directives (Vestergaard et al.) que professeur Spuls suggère de mettre à jour. Les options pour ce groupe particulier de patients comprennent les topiques, la thérapie UV, la ciclosporine, la prednisone, et il existe des utilisations potentielles pour l’azathioprine et le dupilumab.
Le Prof. Spuls s’appuie sur la « carte d’aide à la décision » publiée et disponible (Vermeulen et al.).
Une méta-analyse en réseau sur les traitements systémiques utilisées dans la DA (Drucker et al.) comprend 98 études.
En outre, il est nécessaire d’étudier davantage les traitements conventionnels. (Flohr et al. ont étudié l’efficacité de la ciclosporine par rapport au méthotrexate chez les enfants et les jeunes patients atteints de DA. Les deux traitements ont apporté une amélioration importante à la semaine 12, mais le méthotrexate s’est avéré supérieur à long terme).
Le professeur Spuls a indiqué que le méthotrexate est largement utilisé dans la DA. Une étude systématique a montré qu’il n’existait pas de système posologique cohérent, ce qui souligne le risque d’une utilisation sous-optimale de l’agent (sous-dosage, inefficacité). Sous-dosage = inefficacité, surdosage = risque d’effets indésirables. Un schéma posologique consensuel international pour l’adulte et l’enfant atteints de DA a été suggéré : dose initiale de 15 mg/semaine, dose maximale de 25 mg/semaine. Enfin, aucune dose test n’est nécessaire avant le début du traitement (Caron et al.).
Intervenant : Dr Robert Bissonnette, MD, FRCPC (Montréal, Canada)
Points à retenir :
Le Dr Bissonnette a commencé par rappeler qu’aux États-Unis, il existe actuellement de nouveaux traitements de la DA,qui ne sont pas encore disponibles dans l’Union européenne. Le ruxolitinib et le roflumilast sont autorisés aux États-Unis pour la DA, tandis que le tapinarof est autorisé aux États-Unis et au Japon pour le traitement du psoriasis. Il a également précisé que les essais cliniques concernant la catégorie de médicaments susmentionnée ont été réalisés dans des contextes et sur des populations de patients très différents, de sorte qu’il n’est pas scientifiquement prudent de comparer ces agents et les résultats de leurs essais cliniques. Par exemple, les études sur le ruxolitinib ont été mennées sur des adultes et celles sur le tapinarof sur des enfants. Les études sur le ruxolitinib et le roflumilast se sont concentrés sur la DA légère à modérée, tandis que celle sur le tapinarof a exclu les cas légers.
Le ruxolitinib est un inhibiteur de JAK sous forme de crème qui est approuvé en Europe pour le vitiligo et aux États-Unis pour le vitiligo et la DA (dès l’âge de 12 ans). Sous forme de comprimés oraux, il est approuvé par l’EMA pour le traitement de la myélofibrose, de la polycythemia vera et de la maladie du greffon contre l’hôte. Il s’agit d’un médicament qui pénètre dans la peau. Une amélioration statistiquement significative du prurit a été constatée par rapport au placebo, l’effet maximal ayant été observé dans les deux semaines (Papp et al.).
Une étude réalisée sur un seul centre a utilisé le ruxolitinib en ouvert et on a constaté que les démangeaisons disparaissaient dans les 15 minutes suivant l’application (Bissonnette et al.).
Le roflumilast est un inhibiteur de la PDE4 sous forme de comprimé. La formulation en comprimés est approuvée par la FDA pour le maintien de la BPCO chez les patients souffrant d’exacerbations. Une crème à 0,3 % a été approuvée aux États-Unis et au Canada pour le psoriasis, mais les études sur la DA ont été menées avec une crème à 0,15 %. Une étude récente (mars 2024) sur le roflumilast chez des enfants de 2 à 5 ans a donné des résultats similaires (Eichenfield et al.).
En ce qui concerne les démangeaisons, dès le premier jour, une amélioration a été constatée et en l’espace de deux semaines environ, la majeure partie de l’efficacité a été observée (Simpson et al.).
En termes de sécurité, une légère augmentation a été observée pour les maux de tête, les nausées, les diarrhées et les vomissements (chez environ 1 patient sur 50) (Simpson et al.).
Le tapinarof, une découverte canadienne, est un agoniste AhR sous forme de crème, qui est approuvé aux États-Unis pour le psoriasis et en Chine (sous le nom de Benvitimod). Il augmente le taux de protéines de la barrière ainsi que la production de céramides et diminue la production de cytokines.
En termes d’effets indésirables, on a pu noter des événements folliculaires (folliculite avec pus, pouvant parfois se présenter comme une kératose pilaire) et des maux de tête (durant généralement 1 jour) (Silverberg et al., Bissonnette et al.).
Dans les études sur le psoriasis, lorsque la maladie est éliminée, les patients la voient en moyenne réapparaître au bout de 115 jours, généralement sur des sites limités (Strober et al.). Le Dr Bissonnette suggère donc que lorsque les patients se sentent mieux, les cliniciens peuvent recommander d’arrêter le médicament et de réexaminer la question en cas de réapparition des symptômes. Les données relatives à la DA seront publiées prochainement.
Le lebrikizumab est un anticorps monoclonal anti-IL13 approuvé pour les patients atteints de DA âgés de plus de 12 ans, à raison de 500 mg par voie sous-cutanée pendant les semaines 0 et 2. Par la suite, la posologie est de 250 mg par voie orale jusqu’à la semaine 16. La dose d’entretien est de 250 mg toutes les 4 semaines. Une amélioration significative a été constatée à la semaine 16. La conjonctivite a été notée comme effet indésirable (Silverberg et al.).
Le némolizumab est un anticorps monoclonal anti-IL31R, approuvé aux États-Unis pour le traitement du prurigo nodulaire et, en ce qui concerne la DA, des essais de phase III ont été réalisés. Cet essai a été réalisé à l’aide d’un TCS. En ce qui concerne le prurit, une amélioration a été constatée au bout d’une semaine et il a continué à diminuer pendant 16 semaines. En termes d’effets indésirables, on a pu constater un œdème périphérique, des membres, bilatéral, et un œdème du visage (Silverberg et al.).
Le Dr Bissonnette a ensuite abordé la question de l’OX40 et du ligand de l’OX40 dans la DA (Guttman-Yassky et al.).
Le développement de traitements à base de cette substance thérapeutique suscite un grand intérêt. Après l’activation des cellules T, OX40 est exprimé, ce qui est important pour la survie et la prolifération de ces cellules.
Le telazorlimab est un anticorps monoclonal anti-OX40, dont nous savons désormais qu’il peut permettre un contrôle à long terme de la maladie sans médicaments. L’objectif principal, à la dose la plus élevée par rapport au placebo, a été atteint à la semaine 16, dans le cadre de l’essai de phase II. L’efficacité maximale n’a pas été atteinte à la semaine 16, mais une amélioration de la maladie a été constatée à la semaine 52 et s’est maintenue pendant 12 semaines (Rewerska et al.).
Le rocatinlimab est un autre anticorps monoclonal anti-OX40, qui peut induire une toxicité cellulaire dépendante des anticorps au niveau des cellules T. Lors de la phase II, la dose maximale était de 300 mg/2 semaines par rapport au placebo. En cas d’arrêt de la posologie, l’efficacité s’est maintenue pendant environ 20 semaines. En ce qui concerne les effets indésirables, des cas de pyrexie, de frissons et d’ulcères aphteux ont été signalés (Guttman-Yasky et al.).
Le Dr Bissonnette a partagé de nouvelles données sur la phase III de l’essai sur le rocatinlimab (Rocket Horizon, répondeurs à l’étude à la semaine 24). En termes d’EASI75 au moment de l’atteinte de l’objectif final primaire, 32,8 % de patients traités contre 13,7 % pour le placebo et en termes de vIGA-AD 0/1 traités : 19,3 % de réponse contre 6,6 % pour le groupe placebo. Le Dr Bissonnette a noté qu’il ne pense pas que l’efficacité maximale soit atteinte à la semaine 24.
L’amlitelimab est un anticorps monoclonal anti-OX40L. OX-40L est exprimé sur les cellules présentatrices d’antigènes. L’étude de phase II comprenait différentes doses pendant 24 semaines. Le critère d’évaluation principal de l’étude EASI75 a débuté à la semaine 8 et était significatif à la semaine 24. Lors de l’exploration des 24 semaines sans traitement, l’IGA 0/1 maintenu était de 71,9 % et l’EASI75 de 69,0 % pour ceux qui ont poursuivi le traitement et les participants qui ont arrêté le traitement pendant 6 mois, ont montré un IGA0/1 à 57,0 % et un EASI75 à 61,6 %. Par conséquent, si le patient a atteint l’IGA 0/1, puis que le traitement est arrêté, plus de la moitié des patients continueront à présenter l’IGA 0/1 après 24 semaines. En termes d’effets indésirables, aucune différence majeure n’a été observée entre les participants sous traitement actif et les participants sous placebo (Weddinger et al.).
Session animée par : Dr Vincenzo Bettoli, MD et Prof. Dr Klaus Fritz
Conférenciers : Dr Vincenzo Bettoli, MD, Dr Øystein Grimstad, Ph.D., Prof. Klaus Fritz, Prof. Dr Klaus
Rapport rédigé par le Dr Stella Michelaki, M.D., Ph.D.
Intervenant : Dr Vincenzo Bettoli (Ferrara, Italie)
Points à retenir :
Les cicatrices d’acné peuvent résulter de la rupture d’un abcès périfolliculaire et d’une cicatrisation pathologique. La pathogenèse de la formation des cicatrices est multifactorielle. Le contenu des abcès est bien délimité. La réparation survient normalement dans les 7 à 10 jours, mais une nouvelle rupture peut se produire, entraînant une encapsulation, un abcès plus profond et, par conséquent, une inflammation plus importante pouvant mener à une cicatrisation inadéquate et provoquer la formation d’une cicatrice. Les fibroblastes sont responsables du remodelage de la matrice. Ils libèrent des métalloprotéases qui dégradent la matrice extracellulaire.
L’aspect atrophique de la peau est dû à la contraction superficielle qui fait suite à la réparation des parties plus profondes. En outre, les recherches ont suggéré que la surexpression du facteur de croissance transformant bêta 1 (TGFβ1) provoque une dégradation accrue de la matrice extracellulaire et limite la prolifération des kératinocytes, en particulier chez les patients sensibles (Berman B et al.). L’aspect atrophique des cicatrices d’acné est dû à la destruction irréversible des glandes sébacées. L’activation de l’IL-2 et de l’IL-10 a également été associée au mécanisme de formation des cicatrices. Les plasmocytes et les lymphocytes B participent à la formation de l’infiltrat. Parmi les cicatrices d’acné typiques, on peut citer les cicatrices en relief, les cicatrices atrophiques, les cicatrices en pic à glace, les cicatrices de roulement et les cicatrices de wagon couvert. Les cicatrices de type « super wagon couvert » sont définies comme des cicatrices d’une taille supérieure à 4 mm (Jacob et al.). Dans le cas des cicatrices d’acné papuleuses, on observe une fibrose périfolliculaire et une destruction des fibres élastiques.
Le Dr Bettoli a expliqué que la sévérité et la durée de l’inflammation sont des facteurs clés dans la formation des cicatrices. Des études ont montré un lien entre la persistance de la présentation de l’antigène, l’inflammation retardée et la cicatrisation. Les cicatrices moins marquées sont généralement associées à une réponse marquée des lymphocytes T et à une inflammation intense et de plus courte durée. Pour prévenir l’apparition des cicatrices, il est important de traiter agressivement pour éviter les séquelles de la maladie (cicatrices, érythème, hyperpigmentation) et les rechutes, comme l’a fait remarquer le Dr Bettoli.
Sur le plan statistique, des études ont mis en évidence l’impact des cicatrices chez les patients souffrant d’acné, car il s’agit d’un véritable problème esthétique chez au moins 22 % d’entre eux (Layton AM et al.). Les études mentionnées décrivent un risque accru de suicide et de dépression chez les patients souffrant d’acné (Rossi AB et al., Cotteril JA et al.). 95 % des patients présentent des cicatrices d’acné au niveau du visage (hommes/femmes). Au niveau du tronc, les cicatrices touchent généralement davantage les hommes. Le Dr Bettoli a également indiqué que des lésions d’acné similaires peuvent produire des cicatrices d’acné très différentes en fonction de l’endroit où elles se situent. On observe généralement des cicatrices en pic à glace sur le visage et des élastoses hypertrophiques et périfolliculaires dans le dos.
Le Dr Bettoli a ensuite abordé les facteurs de risque, tels que la sévérité de l’acné, les antécédents familiaux de cicatrices d’acné et le comportement d’excoriation associé aux cicatrices.
Il a également évoqué les types de cicatrices et les traitements recommandés. Pour les cicatrices en pic à glace, le traitement a pour objectif de réaliser une stimulation profonde et focale du collagène. Les traitements les plus efficaces sont l’excision à l’emporte-pièce avec suture et le TCA Cross à 100 %. On a constaté que les cicatrices de roulement étaient celles qui répondaient le mieux au resurfaçage fractionné au CO2 et Erbium-YAG ou au resurfaçage non ablatif répété. Les cicatrices de type wagon couvert répondent mieux au traitement par excision à l’emporte-pièce suivie d’une surélévation à l’emporte-pièce. Les traitements peuvent être multiples et les patients doivent être informés qu’ils n’obtiendront qu’un certain pourcentage d'amélioration. Les données sur le traitement des cicatrices papuleuses sont limitées et une étude publiée fait état d’un traitement réussi au laser Erbium- YAG (Jennings et al., Lee SJ).
Le Dr Bettoli a souligné que la classification des cicatrices d’acné est complexe, même pour les spécialistes de l’acné.
Une étude intéressante (Sewon et al.) a été évoquée concernant la classification des cicatrices d’acné atrophiques. Cette étude a permis de conclure que les cicatrices d’acné atrophiques doivent être classées dans la catégorie des cicatrices en pic à glace lorsqu’elles mesurent moins de 2 mm, 2 à 4 mm et plus de 4 mm. On conseille donc de considérer la taille comme la principale caractéristique pour l’identification des systèmes de classification des cicatrices.
Une autre étude prospective sur l’évolution des cicatrices a ensuite été présentée (Tan et al.). Cette étude a conclu que 19,9 % des patients avaient signalé une résolution du problème.
Une étude de Dréno et al. visait à évaluer l’efficacité d’un gel à 0,3 % d’adapalène et 2,5 % de peroxyde de benzoyle sur la formation des cicatrices atrophiques. Il s’agit d’un traitement efficace de l’acné vulgaire modérée à sévère et d’un moyen efficace pour réduire les cicatrices existantes, 24 semaines après le traitement.
Le Dr Bettoli a expliqué que l’adapalène permet de réduire l’inflammation en réduisant l’activité des TLR. L’adapalène à 0,3 % favorise la synthèse du collagène.
Une étude multicentrique, randomisée, en double aveugle et contrôlée par véhicule a évalué l’efficacité et la sécurité de la crème au trifarotène dans la prévention des cicatrices d’acné. L’utilisation d’une crème de trifarotène à 50 μg/g par jour (Schleicher et al.) a montré une réduction statistiquement significative du nombre total de cicatrices atrophiques induites par l’acné.
Intervenant : Dr Øystein Grimstad, Ph.D. (Tromsø, Norvège)
Points à retenir :
Le Dr Grimstad a commencé par évoquer les lignes directrices concernant le traitement des cicatrices pathologiques (mise à jour et déclaration de position du groupe d’experts brésilien GREMCIQ datant de 2020). Les glucocorticoïdes (triamcinolone) font l’objet d’un consensus clair pour le traitement des cicatrices hypertrophiques et chéloïdes par injections intralésionnelles. Dans le cas des cicatrices hypertrophiques et chéloïdes, il est recommandé d’associer la triamcinolone à la cryochirurgie. Le 5-Fluorouracil est recommandé pour le traitement des cicatrices hypertrophiques et chéloïdes réfractaires(hors indication). Notons également qu’il n’existe pas de recommandation pour le vérapamil.
L’absence de lignes directrices internationales actualisées est liée à de nombreux facteurs tels que l’hétérogénéité des cicatrices et des chéloïdes, le moment du traitement, le manque d’homogénéité des interventions, etc.
Le Dr Grimstad a ensuite parlé d’une étude exploratoire sur les méthodes d’injection pour l’administration intralésionnelle de corticostéroïdes pour les chéloïdes (Yin et al.). Cette étude a révélé que la dose maximale par séance variait entre 20 et 80 mg, et que la posologie par cm2 était comprise entre 1 et 20 mg. Les mesures des résultats varient, de la hauteur à la surface, en passant par l’échelle de Vancouver pour les cicatrices.
Pour comprendre la pathogenèse des cicatrices pathologiques, on doit prendre en compte : le rôle des cellules immunitaires (mastocytes, macrophages, cellules T régulatrices, cellules dendritiques), le processus aberrant de cicatrisation (inflammation prolongée, dérèglement des fibroblastes et surproduction de collagène, remodelage anormal de la matrice extracellulaire), les voies de signalisation impliquées (TGFβ/Smad, JAK/STAT, MAPK, PI3K/AKT) et enfin le rôle de la génétique (polymorphisme de l’IL-6, mutations des récepteurs du TGFβ).
Le Dr Grimstad a ensuite énuméré les principaux traitements utilisés pour les cicatrices chéloïdes et hypertrophiques :
| Inhibiteurs de l’ECA : captopril, énalapril, losartan | Agents anti-allergiques : tranilast |
| Médicaments antisens : TGFβ1-antisens, SMAD3 antisens, hTERT antisens | Cytokines antivirales : interférons |
| Bloqueurs des canaux Ca2+ : vérapamil | Chimiothérapie : bléomycine, camptothécine, 5-Fluorouracile, mitomycine C, paclitaxel, tamoxifène |
| Enzymes : collagénase, hyaluronidase | Vitamines : A, D3, E |
| Immunomodulateurs : tacrolimus, pimecrolimus | Abs monoclonaux : dupilumab, αTGFβ1, αVEGFA |
| Neurotoxines : toxine botulique de type A et E | Vasodilatateurs périphériques : pentoxifylline |
| Prodrogue photosensibilisante : acide 5-aminolévulinique | Extraits végétaux : aloe vera, thé vert, extraits d’oignon, shikonine |
| Statines : pravastatine | Stéroïdes : acétonide de triamcinolone, dexaméthasone, acétate d’hydrocortisone, méthylprednisolone |
Il existe de nombreuses options pour les applications d’injection intralésionnelle, y compris les applications topiques, les patchs, les dispositifs sans aiguille, l’injection par jet pneumatique, l’injection assistée par laser fractionné, le micro-aiguilletage avant médicament, les patchs à micro-aiguilles, l’électroporation à micro-aiguilles.
Une revue systématique fascinante sur la récurrence et les complications liée à l’injection péri-opératoire de stéroïdes dans les chéloïdes (Zhang et al.) suggère qu’il faudrait effectuer des séances de TCA de 20 à 40 mg/ml toutes les 4 semaines, 1 à 2 semaines après l’intervention.
Un essai randomisé en simple aveugle a comparé les injections intralésionnelles de triamcinolone et de vérapamil-triamcinolone dans les chéloïdes (Haghani-Dogahe et al.) (TCA 40 mg/ml contre TCA 40 mg/ml + vérapamil 2,5 mg/ml). Les conclusions ont mis en évidence les avantages du vérapamil, le groupe de traitement combiné ayant connu une plus grande efficacité sur les chéloïdes.
Le traitement par TCA et 5-FU s’est avéré supérieur à la monothérapie par TCA pour les cicatrices chéloïdes et hypertrophiques (Jianzhen Shi et al.).
Pour le 5-FU, la concentration habituellement utilisée est de 1,5 mg/ml à 50 mg/ml dans une dose de 0,02 à 0,4 ml/cm3 (dose maximale : 150 mg/traitement), toutes les 1 à 4 semaines. Les effets secondaires peuvent inclure une douleur au niveau du site d’injection, un érythème, une ulcération et une hyperpigmentation.
Pour la toxine botulique de type A, la concentration habituelle est de 10 à 75 U/ml, à une dose de 2,5 à 5 U/cm3 (dose maximale : 100 U/traitement), toutes les 4 à 12 semaines. Les effets secondaires comprennent une faiblesse musculaire locale temporaire.
Intervenant : Prof. Dr Klaus Fritz (Landau, Allemagne)
Points à retenir :
Le professeur Fritz a commencé par souligner les principales différences entre une cicatrice hypertrophique et une cicatrice chéloïde. Une cicatrice hypertrophique peut régresser et elle se limite à la plaie, alors que les cicatrices chéloïdes ne régressent pas et ne sont pas limitées.
Les lignes directrices S2k pour le traitement des cicatrices pathologiques (mise à jour de 2020) constituent un algorithme clé, incontestablement utile pour la pratique clinique. En résumé, en cas de cicatrice chéloïde, si elle est petite, on recommande la TCA et/ou la cryochirurgie. Si la cicatrice est réfractaire au traitement, on recommandera alors une combinaison de TCA, de cryochirurgie et de 5-FU OU une chirurgie avec suivi, et si l’érythème persiste, on suggère le laser à colorant pulsé.
Pour les cicatrices rouges, le professeur Fritz suggère le KTP, le Pro yellow, le laser à colorant pulsé et l’IPL.
Une largeur d’impulsion de 0,45 ms de PDL s’est avérée plus efficace pour réduire la taille des cicatrices et améliorer leur souplesse que celle de 40 ms, à 7 J chacune (Manuskiatti W et al.). Il a également été démontré que la hauteur et la souplesse des cicatrices étaient améliorées après 2 semaines et que cette amélioration était d’autant plus importante que les visites étaient nombreuses (intervalle de 4 semaines).
Pour le traitement des cicatrices hypertrophiques à l’aide de PDL, on conseille de suivre les recommandations suivantes (Manuskiatti W et al.) : 1. Durée d’impulsion : 0,45 à 1,5 ms, 2. Fluence : 3 à 7 J/cm2, 4. Refroidissement suffisant, 5. Séances : 4 à 8 au total, avec un intervalle de 4 à 6 semaines.
La méthode de référence consiste à appliquer un laser à colorant pulsé, le jour de l’ablation des sutures, à raison de 4,5 J/cm2 avec une durée d’impulsion courte de 1,5 à 2 ms (Leclere FM et al.).
Le professeur Fritz a présenté une étude sur l’efficacité du PDL par rapport au traitement standard (Waraphong M, Fitzpatrick) dans laquelle toutes les cicatrices ont connu un aplanissement significatif par rapport au témoin et les traitements intralésionnels ont montré une résolution plus rapide que le PDL. (L’étude a utilisé un PDL alimenté par une lampe flash de 585 nm, un corticostéroïde intralésionnel seul et un corticostéroïde intralésionnel + 5-FU).
Le laser Nd:Yag (1064 nm) est conseillé pour les cicatrices étendues et les chéloïdes. Le professeur Fritz conseille de commencer par le Nd:Yag intralésionnel, puis de poursuivre dans les zones moins épaisses avec le laser topique et enfin le PDL. Les spécificités du Nd:Yag, en fonction de l’épaisseur, sont les suivantes : en dessous de 0,5 cm, il s’agit du PDL, de 0,5 à 1 cm, il s’agit de PDL ou de Nd:Yag, enfin, au delà de 1 cm, il s’agit de Nd:Yag.
En cas de rougeurs et d’hypopigmentation au niveau des cicatrices, le professeur Fritz recommande l’ablation des zones hypertrophiques avec Er:Yag, 2 traitements par PDL, puis Excimer 308 nm pour la repigmentation, et 18 traitements entre 300 et 400 mJ.
Les lignes directrices S2k pour le traitement des cicatrices pathologiques (mise à jour de 2020) en cas de cicatrices hypertrophiques, orientent les cliniciens en fonction de la présence ou non d’une contrainte de traction et, le cas échéant, conseillent de recourir à un soulagement chirurgical via une chirurgie locale par lambeau ou une greffe. Dans le cas contraire, on conseille les lasers, les produits topiques, le TCA et la cryochirurgie ou la compression.
Le professeur Frtiz note que pour les cicatrices anciennes, le laser au CO2 est une option acceptable, mais que pour les chéloïdes, il faut s’attendre à une réapparition de 95 % d’entre elles après un an (Nast, Fritz et al.).
Pour les cicatrices causées par des brûlures, les lasers ablatifs et non ablatifs gagnent du terrain car ils permettent d’améliorer la texture, l’épaisseur et la contracture de la peau, entre autres (Beachkofsky et al.).
Pour les lasers non ablatifs destinés aux cicatrices, le professeur Fritz suggère de cibler le derme : Nd:Yag 1064 nm, 1450 nm, Er:Glass 1540 nm et radiofréquence.
Pour les chéloïdes inactives, le laser fractionné ablatif peut être utilisé en combinaison avec des stéroïdes ou dans le cadre d’une « administration de médicaments assistée par laser ».
Pour le traitement de l’hyperpigmentation, les techniques Q-Switched Nd:Yag et Picosecond ont été évoquées, cette dernière technique entraînant une moindre diffusion thermique.
Pour le traitement de l’hypopigmentation, on conseille le laser Excimer 308 nm ou la lumière.
Le professeur Fritz a présenté une étude intéressante sur la repigmentation par des mélanocytes dérivés de la gaine radiculaire externe, dans le vitiligo et la leucodermie (Vanscheidt, Hunziker). Une repigmentation variable mais stable a été enregistrée chez tous les patients, ce qui montre que les mélanocytes dérivés de la gaine radiculaire externe constituent une technologie prometteuse pour améliorer la greffe de mélanocytes autologues.
Les LLLT augmentent l’activité et la migration des fibroblastes et des macrophages, améliorant ainsi la mobilité des leucocytes (Jagdeo, Nguyen JK et al.). Jadgdeo a également démontré que la lumière rouge ou bleue à haute fluence inhibe la migration des fibroblastes, ce qui pourrait permettre de prévenir la cicatrisation des plaies.
Intervenant : Prof. Dr Klaus Eisendle (Bolzano, Italie)
Points à retenir :
Le Dr Eisendle a présenté des cas cliniques au cours de cette session passionnante. Les complications cicatricielles ont été évoquées, notamment l’ectropion et la trappe ou la pelote d’épingles. Le Dr Eisendle a souligné l’importance de savoir quand et comment planifier les greffes et choisir les lambeaux appropriés.
Il a détaillé les techniques chirurgicales de la plastie en VY et de la plastie en Z.
Le Dr Eisendle a expliqué que la plastie en VY consiste en une incision en forme de V avec une tension longitudinale, la tension provoquant le rapprochement des bords de la plaie. La fermeture de la plaie s’effectue sans tension en forme de Y. La plastie en Z consiste à placer deux lambeaux de transposition opposés l’un contre l’autre.
Les cicatrices hypertrophiques ont tendance à apparaître lorsque les cicatrices croisent des articulations ou des plis cutanés à angle droit, tandis que les chéloïdes sont principalement observées sur le lobe de l’oreille, les épaules et le sternum.
Les lignes directrices du S2k apportent un éclairage sur la radiothérapie des chéloïdes. La radiothérapie adjuvante après l’excision des chéloïdes est recommandée lorsque ces dernières ont tendance à récidiver, qu’elles sont de grande taille et que leur traitement est complexe par ailleurs.
La curiethérapie HDR est recommandée pour la radiothérapie adjuvante.
Une étude récente de Huang et al. recommande de combiner l’excision avec la radiothérapie ou l’administration périopératoire de stéroïdes afin d’améliorer le pronostic des chéloïdes du lobe de l’oreille.