1 professionals
Coup d’œil du congrès ANSF 2022
Coup d’œil du congrès ANSF 2022
Améliorez vos connaissances professionnelles en profitant de nombreux services exclusifs dans le domaine de la dermatologie : plus de 500 visuels de pathologies, des cas cliniques, des vidéos d’experts…
Bénéficiez d’options uniques telles que l’offre de contenus audio et de supports à proposer à vos patients.
Restez informé(e) des événements et des webinaires à venir, des dernières publications scientifiques et des innovations produit.
Vous avez déjà un compte ? Se connecter
Comptes-rendus rédigés par Mme Camille TALLET (Sage-Femme)
Sujets liés
Orateur : Charles GARABEDIAN, gynécologue obstétricien, Lille
Articles rédigés par Mme Camille TALLET
Quelle grossesse envisager après un accouchement compliqué ? Quels facteurs et contre-indications prendre en compte pour favoriser le meilleur mode d’accouchement possible ?
Les informations sont basées sur les recommandations de CNGOF de 2013.
Ce que l’on redoute, c’est le risque de rupture qui est faible : entre 0,2 et 0,8 %.
Il existe 3 facteurs fortement associés à la réussite de l’accouchement par voie basse :
- L’antécédent d’accouchement par voie basse.
- Le bishop favorable ou col considéré comme favorable à l’entrée en salle
- Le travail spontané.
Il n’y a pas d’indication à réaliser une pelvimétrie.
Les critères de contre-indication pour une tentative d’accouchement par voie basse sont l’hystérotomie corporéale et un utérus tri-cicatriciel ou plus.
Nombre de patientes se posent des questions à la suite d’un premier accouchement par césarienne :
- Que faire si le délai avec la dernière césarienne est inférieur à 6 mois ?
Une tentative d’accouchement par voie basse peut être autorisée si les conditions obstétricales sont favorables.
- Que faire s’il y a un antécédent de césarienne avant 37 SA ?
Il n’y a pas d’argument pour contre-indiquer une tentative d’accouchement par voie basse.
- Que faire s’il n’y a pas de compte-rendu antérieur disponible ?
Une tentative d’accouchement par voie basse est possible, il faut cependant prendre en compte le contexte de la césarienne antérieure (recherche d’une hystérotomie segmentaire).
- Quelles sont les conduites à tenir pendant le travail ?
La tocométrie interne n’est pas systématique et l'enregistrement du rythme cardiaque fœtal (ERCF) doit être en continu. Attention prendre des précautions sur le recours et les doses d’ocytocine et il n’y a pas de révision utérine systématique.
La décision de la voie d’accouchement doit être validée par un obstétricien au 8e mois (en pratique, cela dépend de l’organisation et des protocoles des centres). La ou les différentes options doivent être notées dans le dossier médical avec la date et la signature. De même la conduite à tenir en cas de mise en travail inopinée doit être spécifiée. Ces décisions seront partagées avec la patiente en fonction du vécu de la première césarienne et du contexte actuel.
En post-partum, il est important de préciser qu’il est recommandé d’attendre un an avant une nouvelle conception, même si cette information peut être très culpabilisante.
Les facteurs associés à un nouvel accouchement instrumental sont :
- Âge > 40 ans
- Intervalle > à 5 ans entre les deux accouchements
- Âge gestationnel > 41 SA
- Déclenchement
- Poids de naissance > 4 000 g
- Garçon
- Présentation en OS
En prévention secondaire, il existe un risque de récidives de 13 % (instrument ou césarienne). Les facteurs de risque de récidives sont : le forceps, la ventouse, une LOSA, un nouveau-né de plus de 4 kg et un âge maternel de plus de 35 ans.
Les facteurs de risque sont :
- L’accouchement instrumental,
- Antécédent de LOSA 4,
- Nouveau-né > 4 000 g,
- L’âge maternel > 35 ans.
En cas d'antécédent de LOSA, il est recommandé d’examiner le périnée en cas de nouvelle grossesse et de répondre aux questions des femmes à propos du risque de récidive et de séquelles en cas de nouvel accouchement (accord professionnel 2 018).
Il est donc important de demander s’il existe des symptômes d’incontinence urinaire et anale avant la grossesse, si la rééducation a été réalisée, s’il y a des symptômes d’incontinence urinaire et anale après la grossesse et si le périnée a été examiné.
En cas de second accouchement par voie vaginale après une LOSA il n’y a pas de sur risque d’incontinence anale ou d’aggravation d’une incontinence anale préexistante (NP2).
Le risque d’une nouvelle LOSA est entre 5 à 8 % (NP3).
S’il y a une nouvelle LOSA, le risque est cependant augmenté d’avoir une incontinence anale séquellaire (NP4).
La voie d’accouchement doit donc être discutée avec la patiente, car la réalisation d’une césarienne systématique en prévention de l’incontinence anale (grade B) n’est pas recommandée.
En ce qui concerne les problèmes urinaires : en cas d’accouchement vaginal après bandelette sous-urétrale, les données disponibles ne permettent pas de conclure à un sur risque de récidive de l’incontinence urinaire (NP4). Il n’est pas recommandé de proposer la réalisation d’une césarienne programmée en prévention secondaire d’une incontinence urinaire opérée ou non (grade C).
En pratique, il faudra bien penser à tracer les consultations ainsi que les informations données à la patiente.
Un antécédent d’hémorragie du post-partum multiplie par 3 le risque de récidives. En anténatal, il faudra discuter avec la patiente du lieu d’accouchement, en tenant compte du niveau de risque et de la disponibilité des produits sanguins. Il faudra aussi bien prévenir l’anémie en prénatal.
En pré-partum, il n’y a pas lieu de mettre en œuvre une prise en charge spécifique en cas d’antécédent d’hémorragie du post-partum.
La grossesse, l’accouchement et le post-partum sont des situations à risque de traumatisme psychologique.
La dépression du post-partum à une prévalence de 10 à 20 % et le stress post-traumatique de 4 %. Tous les moyens sont bons pour mettre en sécurité physique et affective les futurs parents.
Il semblerait intéressant de pouvoir mettre en place une consultation dédiée au retour sur le vécu de l’accouchement et du post-partum en cas de situation à risque notamment.
Il faudrait aussi investiguer systématiquement le vécu de l’accouchement antérieur lors des grossesses suivantes, car les souvenirs peuvent être ancrés toute la vie.
Pour ce faire, il faudra monter une équipe dédiée à ces consultations.
• Accouchement après une césarienne, la décision de la voie d’accouchement doit être validée par un obstétricien au 8e mois.
• Il existe un risque de récidives faible d’un nouvel accouchement instrumental.
• En cas de second accouchement par voie vaginale après une LOSA, le risque d’une nouvelle LOSA est entre 5 à 8 %.
• Un antécédent d’hémorragie du post-partum multiplie par 3 le risque de récidives.
• Il faudrait aussi demander systématiquement le vécu de l’accouchement antérieur lors des grossesses suivantes car les souvenirs peuvent être ancrés toute la vie.
La dépression du post-partum à une prévalence
Quel est le facteur qui n’est pas associé à un nouvel accouchement instrumental ?
Quel est le risque redouter lorsqu’une patiente présente un antécédent de césarienne ?
En cas d’un second accouchement par voie vaginale après une LOSA quel est le risque d’une nouvelle LOSA ?
Orateur : Paul BERVEILLER, gynécologue obstétricien, Poissy
Comptes-rendus rédigés par Mme Camille TALLET
En 2010, 15 millions d’enfants sont nés avant 37 SA, cela représente 11 % des naissances vivantes :
• 85 % de ces enfants sont des prématurés modérés ou tardifs : entre 32 et 36 SA
• 19 % sont de la grande prématurité : entre 28 et 31 SA
• 5 % sont de la très grande prématurité : < 28 SA
En France, 60 000 des enfants par an (soit 7,4 %) naissent avant 37 SA, dont 12 000 avant 32 SA. Pour moitié, cette prématurité est spontanée (mise en travail spontané ou rupture prématurée des membranes), l’autre moitié étant induite.
2 à 3 % des grossesses présentent une rupture prématurée des membranes avant 37 SA, moins de 1 % des grossesses présentent une rupture prématurée des membranes avant 34 SA.
On sait que l’âge gestationnel de naissance a un impact très fort sur la mortalité, sur la morbidité néonatale sévère et sur le développement de l’enfant.
Enfin, il existe 35 % de risque de récidive d’un accouchement prématuré. La récidive est donc un antécédent grave à prendre en charge.
- Bilan d’insuffisance cervicale/malformation utérine :
En cas d’antécédent de fausse-couches tardives ou d’accouchements prématurés, il est recommandé de rechercher une malformation utérine (grade C). Aucun examen paraclinique à la recherche d’une insuffisance cervicale n’est recommandé (accord professionnel).
- Prélèvement vaginose :
Le lien entre la vaginose et l’accouchement prématuré est faible, ce qui n’empêche pas de la rechercher si la patiente présente des risques (grade C). Un traitement par Métronidazole et Clindamycine sera efficace si la patiente présente des symptômes.
Dans la sous-population des patientes ayant un antécédent d’accouchement prématuré avec infection materno-fœtale, il y aurait un potentiel intérêt à dépister et à traiter précocement une vaginose (accord professionnel).
- Surveillance du col :
Un col court à la grossesse suivante après un antécédent d’accouchement prématuré est un facteur de risque surajouté d’accouchement prématuré versus un col long. On appelle un col court s’il est < 25 mm à 24 SA. Il faudra donc surveiller le col à un rythme qui va d’hebdomadaire à mensuel selon les équipes entre 16 et 24 SA.
- La progestérone :
Il existe, en termes de réduction du risque de prématurité, un bénéfice à prescrire de la progestérone vaginale chez les patientes avec un antécédent d’accouchement prématuré au 2e trimestre avec un col < 25 mm (accord professionnel). D’autres études sont nécessaires pour en faire une recommandation.
- Le cerclage :
La béance du col n’a aucune définition consensuelle, son diagnostic est clinique. Aucun examen paraclinique n’est recommandé.
Le cerclage est recommandé pour une femme ayant eu 3 fausses-couches tardives ou accouchements prématurés (grade A), ce qui n’est pas vraiment respecté en pratique puisque les équipes interviennent souvent plus tôt. Il est aussi recommandé pour les femmes ayant un antécédent d’accouchement prématuré avant 34 SA et un col court échographique < 25 mm lors de la grossesse suivante (grade B).
Le cerclage est donc non recommandé chez les femmes ayant un col court échographique sans antécédents ou grossesse multiple.
Il pourra être réalisé un cerclage de Mc Donald en première intention, car il est plus facile et présente moins de complications ou un Shirodkar si échec de Mc Donald.
- Le repos au lit :
Le taux d’hospitalisation prénatale est de 18,8 % par an, le taux d’hospitalisation pour MAP est de 6,5 % par an.
Une étude de cohorte a montré que le repos au lit présentait plutôt des risques que des bénéfices pour la grossesse : la prévalence des accidents thrombo-emboliques était de 15,6 % dans le groupe repos versus 0,8 % dans le groupe contrôle et la perte trabéculaire était de 4,6 % contre 1,5 % en l’absence de repos au lit.
Les conséquences de ce repos sont donc l’atrophie musculaire et la perte de l’adaptation cardiovasculaire.
De plus, cela augmente la probabilité de trouble de l’humeur (stress par séparation de la famille), le sentiment d’ambivalence par rapport à la grossesse et le sentiment de culpabilité.
Pour le co-parent, cela augmente le sentiment de détresse. En ce qui concerne les autres enfants de la fratrie, cela crée un effet émotionnel adverse avec des réactions négatives.
Cela augmente les coûts directs pour la famille pour la prise en charge des autres enfants et les coûts indirects par l’absentéisme professionnel.
Enfin, cela augmente les coûts pour les systèmes de soins : en 2017, le repos au lit a coûté entre 2 et 7 milliards.
Il n’y a donc pas de preuve du bénéfice du repos au lit, au contraire, nous notons de nombreux arguments en faveur de sa dangerosité.
Il faut donc réduire la prescription de repos ainsi que la fréquence et la durée des hospitalisations.
- L’arrêt du tabac :
Le tabac est associé à une augmentation de la prématurité spontanée (NP2) avec un effet-dose.
Si une intervention de sevrage tabagique est mise en place, cela diminue le risque de prématurité de 14 %. De même, l’interdiction du tabac dans une partie des espaces publics diminue le nombre de naissance prématurée (NP2).
Le sevrage tabagique est donc recommandé chez les patientes enceintes quel que soit le stade de la grossesse (grade A).
- Les autres mesures :
La pratique d’une activité sportive régulière pendant la grossesse n’augmente pas le risque d’accouchement prématuré (NP2), l’activité sportive est même recommandée chez les femmes présentant une grossesse normale (grade A).
Les rapports sexuels pendant la grossesse n’augmentent pas le risque de prématurité (NP2), même chez les patientes avec un antécédent d’accouchement prématuré (NP3).
La tocographie, la fibronectine fœtale et le toucher vaginal à chaque consultation ne sont pas recommandés.
La visite de la sage-femme n’est pas recommandée pour réduire le nombre d’accouchements prématurés ce qui ne veut pas dire qu’elle n’a pas d’autres bénéfices.
• En conclusion, bien que la grossesse après une rupture prématurée des membranes ou un accouchement prématuré soit un facteur de risque, les grossesses ont tendance à être trop médicalisées.
• Il faut développer la consultation pré conceptionnelle et post-natale pour optimiser la prise en charge de nos patientes.
• La consultation obstétricale précoce permet d’organiser au mieux le suivi de grossesse.
• Attention aux idées reçues en matière de prévention et de surveillance.
En France, 7,4 % des enfants naissent avant 37 SA
La mise en place d’un sevrage tabagique, diminue le risque de prématurité
Quel est le pourcentage des grossesses qui présente une rupture prématurée des membranes avant 37 SA ?
Le repos au lit présente plutôt des risques que des bénéfices pour la grossesse :
Orateur : Camille LE RAY, gynécologue obstétricienne, Paris
Comptes-rendus rédigés par Mme Camille TALLET
L’âge des femmes à l’accouchement augmente régulièrement en France. Avec les progrès des techniques d’assistance à la procréation, et notamment le recours au don d’ovocytes, on assiste à un accroissement des femmes accouchant au-delà de 45 ans.
Les femmes de plus de 45 ans sont davantage porteuses de pathologies chroniques et ont également, de fait, plus souvent des antécédents gynécologiques et obstétricaux. Parmi les femmes plus âgées, il existe une prévalence élevée de l’hypertension artérielle (HTA) ou de diabète. Les antécédents de pathologies cardiaques, thrombo-emboliques ou encore certaines maladies auto-immunes augmentent également avec l’âge maternel. De même, les antécédents de césarienne augmentent avec l’âge maternel puisqu’ils concernent 5,1 %, 21,2 % et 22,6 % des femmes de 20-29 ans, 40-44 ans et ≥ 45 ans, respectivement.
Pour ces femmes, il est donc essentiel de programmer la grossesse et donc de dépister ces pathologies ainsi que leurs complications potentielles, lors de consultations pré-conceptionnelles.
- HTA gravidique et pré-éclampsie
Avec l’âge, on observe une perte progressive de la compliance vasculaire, rendant l’adaptation à la grossesse plus difficile. L’incidence de la pré-éclampsie ou de l’hypertension artérielle gravidique est augmentée. Yogev et al., rapportent des taux de pré-éclampsie 15 fois supérieurs chez les femmes ≥ 45 ans par rapport à celles entre 20 et 29 ans, atteignant même 35 % chez les femmes ≥ 50 ans. De même, Jacobsson et al., dans une étude de cohorte suédoise, trouvent des taux de pré-éclampsie sévère supérieurs chez les femmes ≥ 45 ans comparés à celles de 20-29 ans (OR ajusté = 1,86 [1,17-2,97]).
- Diabète gestationnel
Le risque de diabète gestationnel est augmenté dans la plupart des études, variant entre 1,3 % et 43 % pour les femmes de 45 ans et plus, et même entre 20 % et 42 % pour les femmes de 50-65 ans.
- Retard de croissance intra-utérin et faible poids de naissance
Pour Dulitzki et al., le taux d’enfants de poids < 2 500 g est de 11 % en cas d’âge maternel ≥ 44 ans contre 4,2 % entre 20 et 29 ans (p = 0,02).
Plusieurs hypothèses sont avancées : modifications de la vascularisation utérine liées à l’âge, diminution de la perfusion placentaire ou du passage transplacentaire des nutriments, augmentation de la morbidité maternelle (notamment de l’HTA chronique) ou présence de myomes utérins.
- Mortalité périnatale
Pour Jacobsson et al., la mortalité périnatale augmente avec l’âge maternel, avec des taux de 0,5 % à 20-29 ans, et 1,4 % à 45 ans et plus. Les liens entre l’augmentation de la mortalité périnatale et les facteurs de confusion liés à l’âge tels ne sont pas totalement clairs. Les femmes indemnes de maladie chronique semblent avoir un taux absolu de mortalité périnatale très faible, même si certains auteurs observent des taux de morts fœtales in utero (MFIU) et de mortalité périnatale significativement supérieurs chez les femmes ≥ 45 ans, même en l’absence de maladie intercurrente.
- Accouchement prématuré
Un lien entre âge maternel avancé et accouchement prématuré est fréquemment retrouvé. S’ils rapportent une augmentation des risques d’accouchement < 37 SA et < 34 SA pour les patientes ≥ 45 ans, Yogev et al., ne trouvent pas de différence significative pour la prématurité sévère (< 32 SA).
- Césarienne
Parmi les femmes de 45 ans et plus, les taux de césarienne sont extrêmement élevés et varient de 30 % à 92,4 %. Ces taux concernent à la fois les césariennes programmées, et les césariennes en cours de travail, et peuvent s’expliquer par une plus grande fréquence des présentations dystociques, des placentas prævia et des utérus cicatriciels avec l’âge. Certains obstétriciens ou certains parents estiment enfin, à tort, que l’âge maternel très avancé est un motif de césarienne en raison de la faible probabilité de grossesse ultérieure. Ceux-ci méconnaissent les risques maternels liés à la césarienne en elle-même, avec un risque augmenté de morbidité maternelle sévère chez les femmes ayant une césarienne.
- Hématome rétro placentaire (HRP) et placenta prævia
L’incidence des HRP (6,1 % versus 0,8 %) chez les femmes ≥ 45 ans est augmentée comparée à celles de 20-29 ans. L’HRP est attribué au vieillissement des vaisseaux utérins et est associé aux pathologies hypertensives chroniques.
De même, l’incidence du placenta prævia est élevée chez les femmes ≥ 45 ans. L’augmentation de l’incidence du placenta prævia est attribuée à une augmentation de la parité, mais également à d’éventuels dommages progressifs de l’endothélium vasculaire.
L’âge maternel a un impact négatif significatif sur les résultats en fécondation in vitro (FIV), avec des taux de réussite extrêmement faibles après 44 ans. Le recours au don d’ovocytes pallie les insuffisances de la FIV avec ovocytes autologues en permettant des grossesses très tardives, au-delà de la ménopause.
La plupart des études sur les grossesses après don d’ovocytes chez les femmes d’âge avancé montrent une augmentation des taux d’hypertension artérielle et surtout de pré-éclampsie, de grossesses multiples, d’accouchement prématuré, de faible poids de naissance et de césarienne.
Dans une étude réalisée à la maternité Port Royal incluant 380 femmes de 43 ans et plus, nous avons observé que le taux de pré-éclampsie était significativement plus élevé en cas de FIV avec don d’ovocyte (3,8 % de pré-éclampsie en l’absence de FIV, 10 % après FIV autologue et 19,2 % après FIV avec don d’ovocyte, p < 0,001). L’hypothèse d’une mal adaptation immunologique à l’origine de la pré-éclampsie est avancée, l’unité fœto-placentaire étant considérée après don d’ovocytes comme une greffe allogénique totale et non plus une greffe semi-allogénique.
De même, le taux de faible poids de naissance (2 500 g) est significativement plus élevé chez les femmes ≥ 43 ans après don d’ovocytes que chez celles n’ayant pas eu de FIV, ainsi que des taux de césarienne de 61,4 %, 42,1 % et 37,9 % selon que la grossesse a été obtenue par don d’ovocytes, FIV avec ovocytes autologues ou sans recours à la FIV. La prévalence des grossesses gémellaires dans ce groupe de femmes, contribue pour une grande part à l’augmentation des complications maternelles ou périnatales. Dans l’étude réalisée à la maternité Port Royal, le taux de grossesse gémellaire était plus élevé en cas de FIV avec don d’ovocyte, lui-même associé à un risque augmenté de prématurité. Une politique de transfert d’un seul embryon de bonne qualité est donc particulièrement souhaitable dans ce contexte. Les grossesses gémellaires issues de don d’ovocyte ne sont pas comparables aux grossesses gémellaires spontanées ou obtenues par FIV avec ovocytes autologues. Dans cette population, les risques de pré-éclampsie et d’hémorragie du post-partum sont augmentés.
À la vue des différents risques décrits ci-dessus, il semble important d’évaluer en pré-conceptionnel particulièrement, les comorbidités de ces patientes et expliquer aux femmes et aux couples les risques liés à la grossesse après 45 ans aussi bien, afin que ceux-ci puissent prendre des décisions éclairées, surtout en cas de recours à la fécondation in vitro avec don d’ovocyte. Une évaluation cardiologique au-delà de 45 ans, bien que non systématique, est fortement recommandée et réalisée par de nombreux centres de procréation médicalement assistée.
Il faut cependant rassurer les femmes car en l’absence de comorbidité préexistante, la grande majorité des grossesses après 45 ans permettent la naissance d’un enfant en bonne santé, sans complication maternelle majeure. Compte tenu des risques inhérents aux grossesses gémellaires, et aux surrisques de ces grossesses gémellaires à un âge avancé, il est primordial d’insister lors des consultations pré-conceptionnelles avant fécondation in vitro sur l’importance d’un transfert unique d’embryon.
Il n’existe pas de données avec un niveau de preuve suffisant dans la littérature permettant de conseiller systématiquement la mise sous aspirine. Le mécanisme des complications vasculaires en cas de don d’ovocyte étant probablement différent de celui des femmes avec antécédents vasculaires. Le dépistage systématique du diabète gestationnel, conformément aux recommandations de bonnes pratiques, doit évidemment être automatiquement proposé.
Concernant la surveillance échographique fœtale, en plus des échographies habituelles, des échographies de croissance supplémentaires au 2e et au 3e trimestre pourront être prescrites au moindre doute de RCIU.
Même si plusieurs études retrouvent un risque augmenté de MFIU, le risque absolu est particulièrement faible et ne justifie pas la mise en place d’une surveillance fœtale par monitoring spécifique. La surveillance doit être adaptée au cas par cas. Enfin, il n’existe pas d’argument scientifique pour proposer systématiquement un déclenchement du travail et encore moins une césarienne programmée.
La plupart des études sur les grossesses après don d’ovocytes chez les femmes d’âge avancé montrent (Sélectionnez la mauvaise réponse) :
À partir de quel âge maternel existe-t-il un impact négatif significatif sur les résultats en fécondation in vitro (FIV),
Une évaluation cardiologique au-delà de 45 ans, est fortement recommandée :
Le risque de diabète gestationnel est diminué dans la plupart des études, variant pour les femmes de 45 ans et plus :
a) Vrai
b) Faux
Orateur : Patrizia GOUET-MORGANTI, Sage-Femme, Rennes
Comptes-rendus rédigés par Mme Camille TALLET
Quatre mutilations sexuelles féminines ont lieu dans le monde chaque minute !
Ces pratiques et leurs conséquences ne sont pas lointaines : en France, des femmes, des adolescentes, des fillettes ont subi ou sont susceptibles de subir la violence des mutilations et peuvent en souffrir.
Enfin, il existe un nombre croissant de femmes migrantes en provenance de pays où sont toujours pratiquées les mutilations sexuelles.
En tant que professionnels de santé, nous sommes amenés à rencontrer et prendre en charge ces femmes. « Parlons-en ! » est alors une incitation à ouvrir un temps d’échange avec elles et entre nous.
La consultation est, en effet, un premier pas, un moment où ces femmes peuvent s’exprimer. C’est l’occasion de rompre le silence face à ces pratiques et de les accompagner face au traumatisme dont elles gardent la mémoire.
Les mutilations sexuelles féminines sont un problème médical, légal et éthique, mais aussi relatif à des cultures et à des traditions, qui ne doivent pas nous laisser indifférents.
Selon L’OMS, les mutilations sexuelles féminines recouvrent toutes les interventions incluant l’ablation partielle ou totale des organes génitaux féminins pour des raisons culturelles, religieuses ou pour toute autre raison non-thérapeutiques.
TYPE 1 : excision du prépuce clitoridien, avec ou sans excision partielle ou totale du clitoris. Appelé par différents auteurs, circoncision clitoridienne ou sunna.
TYPE 2 : clitoridectomie avec excision partielle ou totale des petites lèvres, pouvant être associée à l’application de diverses substances (cendre, herbes, terre, etc.) pour des raisons antiseptiques ou autres. Appelée communément excision.
TYPE 3 : excision partielle ou totale des organes génitaux externes et suture, rétrécissement de l’orifice vulvaire laissant juste un orifice pour permettre l’écoulement des urines et du sang menstruel. Appelé infibulation, circoncision pharaonique ou encore circoncision soudanaise.
Les défibulations et réinfibulations successives touchent les femmes infibulées. En effet, lorsqu’une femme est infibulée, elle peut être défibulée lors d’un accouchement. Cela concerne également les jeunes mariées pour permettre les relations sexuelles. Ces femmes sont ensuite réinfibulées après l’accouchement ou en prévision d’une longue absence du mari. Cela peut être pratiqué tout au long de la vie sexuelle d’une femme.
TYPE 4 : regroupe toutes les interventions non classées telles que les piqûres, perforations ou incisions du clitoris et ou des petites lèvres, l’étirement du clitoris net ou des lèvres, la cautérisation par brûlure du clitoris et du tissu avoisinant.
Pierre Foldes décrit des formes plus sournoises, des lésions plus graves sous-jacentes.
Les exciseuses, dans la tradition, reprennent une fonction assumée par leurs ancêtres. Elles utilisent toutes sortes d’instruments : couteau, lame de rasoir, morceau de verre…
Actuellement, nous assistons à une médicalisation du mode opératoire des pratiques de l’excision par des sages-femmes ou des médecins.
La pratique de l’excision remonterait à 6 000 ans avant J.-C., chez les Égyptiens. Elle est d’origine païenne et est bien antérieure aux religions monothéistes.
D’autre part, la clitoridectomie n’est pas un phénomène exclusivement africain. Elle est retrouvée dans la médecine européenne aux XVIII° et XIX° siècles.
Nous pouvons, en premier lieu, évoquer des raisons d’ordre sociologique : l’excision serait la marque de l’appartenance au groupe, une condition indispensable aux alliances entre familles par le biais du mariage, un rituel nécessaire de passage à l’âge adulte. Elle préserverait l’honneur de la famille. En conséquence de quoi, une jeune fille non excisée est considérée comme une personne disqualifiée et dévalorisée sur le plan social. Pour les populations immigrées, l’attachement à la tradition peut signifier le maintien d’une identité familiale et culturelle. Il est pour le moins contestable d’évoquer des raisons religieuses à la pratique de l’excision puisque celle-ci n’est prescrite par aucun texte des religions monothéistes. En revanche, certaines croyances trouvant leurs origines dans des mythes très anciens, servent de raison au maintien de cette pratique.
Pour exemple, le mythe de la bisexualité originelle à laquelle l’excision des femmes et la circoncision des hommes, permettraient de remédier - mythe observé chez les ethnies Bambara et Dogon au Mali.
La tradition met en avant également des raisons psychosexuelles qui sont autant de manières de contrôler la sexualité féminine. Sont ainsi avancées la sauvegarde de la chasteté, la préservation de la virginité, la maîtrise du désir sexuel et la réduction du risque de relations extra-conjugales.
En fonction du type et de la gravité des mutilations sexuelles féminines, celles-ci sont parfois dramatiques.
Les complications immédiates : décès par hémorragie (10-15 % mortalité immédiate), douleurs suraiguës, plaies supplémentaires du périnée, rétention aiguë d’urine, infections aiguës locales, abcès, phlegmon, adénite suppurée, tétanos, anémie, transmissions virales notamment du V.I.H et des hépatites.
Les complications à long terme : cicatrices chéloïdes, kystes épidermiques, algies pelviennes chroniques, névrome du nerf dorsal du clitoris, fistules vésico-vaginales ou recto-vaginales, dysménorrhée, stérilité, cystites, pyélonéphrites, insuffisance rénale.
Les complications obstétricales : pendant la grossesse, il existe un risque hémorragique suite à une intervention chirurgicale. Les MSF de type 2 et 3 entraînent des risques d’infection : génitale basse, urinaire et par conséquent, des risques de fausses-couchesspontanées tardives, MAP, RPM.
En salle de naissance : on note une augmentation du risque des déchirures périnéales, épisiotomie.
Pour la femme infibulée : obstacle à la surveillance pendant l’accouchement, obstacle à la progression de la partie fœtale, césarienne, hypoxie fœtale. Rétention prolongée du fœtus dans la filière génitale, fistules, incontinence.
Les complications sexuelles et psychologiques : L’épreuve de la mutilation entraîne des facteurs d’anxiété, de dépression et de stress post-traumatique. Concernant les troubles de la sexualité, nous retrouvons notamment des troubles de la lubrification, du désir, du plaisir et des dyspareunies. L’image de soi, de leur corps, de la confiance et de l’estime de soi sont mises à mal.
Il témoigne d’un engagement de la Communauté Internationale contre les mutilations sexuelles féminines.
Ces pratiques sont, en effet, pénalement condamnées dans toute l’Europe, dans 26 pays d’Afrique et du Moyen-Orient et aussi dans 33 autres pays accueillant des populations migrantes originaires de pays où ces mutilations sont pratiquées. L’excision est dénoncée comme « une atteinte à l’intégrité physique des femmes et une maltraitance contre les enfants ».
Une Convention sur la prévention et la lutte contre la violence à l’égard des femmes et la violence domestique, dite Convention d’Istanbul, adoptée par le Comité des Ministres du Conseil de l’Europe le 7 avril 2011 et entrée en vigueur le 1er août 2014, comporte un article qui vise précisément les mutilations sexuelles féminines :
« Les Parties prennent les mesures législatives ou autres nécessaires pour ériger en infractions pénales, lorsqu’ils sont commis intentionnellement :
a) L’excision, l’infibulation ou toute autre mutilation de la totalité ou partie des labia majora, labia minora ou du clitoris d’une femme ;
b) Le fait de contraindre une femme à subir tout acte énuméré au point a) ou de lui fournir les moyens à cette fin ;
c) Le fait d’inciter ou de contraindre une fille à subir tout acte énuméré au point a) ou de lui fournir les moyens à cette fin » (article 38). »
Avec l’institution de la Journée Tolérance 0 (chaque 6 février), nous assistons à un renforcement de la mobilisation internationale dont l’objectif est l’éradication des mutilations sexuelles féminines d’ici 2030.
Que dit la Loi Française ?
Elle fait obligation de signalement de toute violence à l’égard des femmes ou des enfants sous peine de poursuites pénales pour non-assistance à personne en danger.
Elle punit, par ailleurs, les auteurs de mutilations sexuelles féminines ainsi que les personnes les ayant incitées, qu’elles soient commises en France ou à l’étranger, au même titre que les autres violences ayant entraîné une mutilation permanente.
La Loi s’applique à l’acte commis à l’étranger si la victime est française ou, si elle est étrangère, lorsqu’elle réside habituellement en France.
La victime peut porter plainte jusqu’à 30 ans après sa majorité.
De plus, la Loi du 29 juillet 2015, relative à la réforme de l’asile, améliore la prise en compte du risque de mutilation sexuelle chez les mineurs. Elle décrit les modalités du constat initial et du suivi de l’absence d’excision chez les mineurs qui sollicitent l’asile à ce motif (article L752-3 du code de l’entrée et du séjour des étrangers et du droit d’asile).
L’enjeu principal est de permettre aux femmes excisées de dépasser le traumatisme qu’elles ont subi et de s’engager dans un processus de réappropriation de leur identité féminine.
C’est aussi, en leur proposant une information sur leur corps et un parcours de reconstruction de soi physique et psychologique, que cela leur permet une meilleure insertion dans leur vie professionnelle, sociale et affective. C’est également convaincre les professionnels de santé de dépasser le silence qui entoure la violence de l’excision et ainsi d’orienter ces femmes, si elles le désirent, vers l’unité mutilations sexuelles féminines, vers des associations… etc.
L’objectif est une amélioration de la prise en charge des femmes ayant vécu le traumatisme de l’excision.
Chaque situation est unique. Il s’agit alors, de créer et d’entretenir une relation de confiance, d’identifier ce dont telle femme est prête à parler de façon à engager une relation de soin à partir de son savoir, de son expérience et de ses compétences. Il ne s’agit pas de juger la tradition, mais de permettre à ces femmes de se libérer de leur poids et d’envisager un avenir qui leur soit propre.
D’autres enjeux consistent dans la prévention par un rappel à la Loi lors du contrat d’accueil et d’intégration des migrants, dans la formation et la sensibilisation des personnels soignants, ou encore des enseignants face à des jeunes filles susceptibles d’être mutilées par exemple lors d’un retour dans leur pays d’origine.
Dans les complications immédiates des mutilations sexuelles féminines, le décès par hémorragie représente :
L’enjeu principal est de permettre aux femmes excisées de dépasser le traumatisme qu’elles ont subi et de s’engager dans un processus de réappropriation de leur identité féminine.
Il existe 3 types de mutilations sexuelles féminines.
En 2014 la loi dit qu’une personne qui pratique l’excision, l’infibulation ou toute autre mutilation de la totalité ou partie des labia majora, labia minora ou du clitoris d’une femme sera passible d’une sanction pénale :
Orateur : Philippe MERVIEL, gynécologue obstétricien, Brest.
Comptes-rendus rédigés par Mme Camille TALLET
Le prolapsus génital n’est pas uniquement une pathologie de la femme âgée, mais peut survenir chez une femme jeune, en âge de procréer.
Il s’agit d’une défaillance des systèmes de soutènement et de suspension des organes pelviens de la femme, qui font issue à travers l’orifice vulvo-vaginal.
Le prolapsus génital touche 6,5 % des femmes de moins de 30 ans, selon Samuel Lesson en 1999 (19 % des femmes entre 40 et 60 ans seront atteintes de prolapsus). Toutes les femmes ne sont pas symptomatiques, et seulement 10 % des femmes seront opérées lorsqu’elles ont moins de 40 ans (30 % au total sont réopérées pour récidive de prolapsus).
Actuellement, nous assistons à une baisse de fréquence des prolapsus, car il y a une baisse de la parité, plus de césariennes, moins de déchirures, et la prescription d’un traitement hormonal substitutif. Néanmoins, l’augmentation de la durée de vie des femmes va entraîner un certain nombre de prolapsus à des âges plus tardifs.
Dans la prise en charge d’un prolapsus, il faudra toujours tenir compte du retentissement fonctionnel, en particulier l’activité physique, la sexualité, la reproduction, et le risque de récidive avec l’âge.
Pour éviter le prolapsus, la femme possède un système autobloquant au niveau de la statique pelvienne. Les pressions abdominales s’exercent toujours dans l’axe ombilico-coccygien, sur le fond utérin, et accentuent l’antéflexion. Le col est maintenu en position postérieure par les ligaments cardinaux et les ligaments suspenseurs. Les pressions sur la vessie sont transmises au fascia de Halban, au fascia de Denonvilliers, puis au diaphragme des releveurs. Enfin, il existe des contractions réflexes des muscles releveurs, tout cela fermant le cap vaginal et empêchant le prolapsus génital.
Les facteurs de risques de prolapsus génital peuvent être congénitaux, c’est le cas des prolapsus chez la nullipare, par anomalie du tissu conjonctif (Maladie de Marfan ou syndrome d’Ehlers Danlos), ou par anomalie de courbure du rachis par perte de la lordose lombaire. D’autres facteurs de risques plus généraux existent : la parité, en particulier la multiparité ; l’âge avec le vieillissement ; le poids avec l’obésité ; les bronchopathies chroniques, l’asthme, la constipation, le tabac, les antécédents familiaux, et une activité trop intense chez la nullipare qui peut entraîner une cystocèle en particulier. Il existe également des facteurs traumatiques, comme les accouchements, avec le mode d’accouchement (extractions instrumentales, présentation dystocique, le poids du nouveau-né avec la macrosomie) ce qui entraîne une dénervation partielle du plancher pelvien, en particulier le nerf pudendal qui innerve les muscles releveurs. Le port de charges lourdes, en particulier les activités rurales, augmente la pression intra-abdominale, et sollicite les structures de soutien de l’appareil génito-urinaire. Il existe des facteurs de risques iatrogènes : la correction d’un prolapsus d’un des étages, peut révéler le prolapsus d’un autre étage ; une hystérectomie pour fibrome en particulier peut révéler un prolapsus. Cela ne crée pas de prolapsus mais peut le révéler. Enfin des modifications physiologiques comme la ménopause, par le taux réduit de collagène, l’involution des fascias et des ligaments, l’involution des muscles striés pelviens, et la perte de tonicité et la diminution de la longueur du vagin, par carence oestrogénique, peut être un facteur de risque.
DE FALCO Martins en 2011 a publié les fréquences des facteurs de risques, retrouvant principalement les accouchements par voie basse, la macrosomie comme responsables de prolapsus génital. La césarienne est en revanche un facteur préventif de prolapsus génital. On retrouve également dans cette étude l’âge, l’IMC, les forceps, ou les antécédents familiaux. On peut noter que le type de prolapsus varie avec l’âge, selon une étude de l’ICS en 2014, avec essentiellement des prolapsus de stade 1 pour les femmes entre 18 et 40 ans, puis apparition d’une fréquence de plus en plus importante de prolapsus de stade 2 dès 30 ans, devenant majoritaire après 40 ans.
Il est important de bien connaître la clinique du prolapsus qui se caractérise souvent l’apparition d’une boule ou d’une masse à l’orifice vulvaire, d’une pesanteur, de leucorrhées. Les douleurs et les saignements sont en général anormaux, et doivent être explorés puisqu’ils n’accompagnent pas un prolapsus génital. Nous devons rechercher une association à des troubles urinaires présents dans 70 % des cas, soit une incontinence urinaire à l’effort, ou au repos, une impériosité mictionnelle, des urgences mictionnelles, une pollakiurie diurne (supérieure à 6 fois/jour) ou nocturne (supérieure à 2 fois/nuit), une dysurie, ou une incontinence par regorgement. On définira ainsi des incontinences urinaires du 1er, 2ème ou 3ème degré en fonction des efforts générant cette incontinence. L’incontinence anale existe également, de l’ordre de 13 % en cas de prolapsus de stade 1, dont 1,5 % incontinence aux selles. Une dyschésie anorectale peut également exister. Des troubles sexuels liés à la béance vulvaire, à la présence des gaz vaginaux ou de dyspareunie, et des douleurs dorso-lombaires peuvent exister, tous ces symptômes sont aggravés par la station debout, et disparaissent en position allongée.
L’examen clinique est extrêmement important et suffit souvent au diagnostic, en position gynécologique puis debout, vessie pleine. Une béance vulvaire sera recherchée, la trophicité vaginale et la longueur du col seront étudiées. Les efforts de poussée et de toux seront pratiqués de façon à rechercher une incontinence existante ou rechercher également un effet pelote par rétention chronique d’urine dans une cystocèle. Nous allons refouler les éléments prolabés pour rechercher un élément de prolapsus masqué, ou rechercher une incontinence masquée, et des manœuvres peuvent exister comme la manœuvre de Bonney (Burch test) ou la manœuvre d’Ulmsten (TVT test).
En cas de trouble urinaire à type d’impériosités, un catalogue mictionnel peut être pratiqué, un pad-test peut être également réalisé. La contractilité des muscles releveurs est cotée de 0 à 5, le noyau fibreux du périnée est étudié, comme la tonicité du sphincter anal, et la sensibilité nerveuse cutanée aux muqueuses peut être testée. Il existe des questionnaires spécifiques sur les symptômes et des questionnaires de qualité de vie qui peuvent être utilisés.
Les prolapsus sont classés selon la classification classique de Baden et Walker :
• Grade 0, pas de prolapsus,
• Grade 1 une descente à mi-étage du vagin,
• Grade 2 une descente jusqu’au niveau de l’hymen,
• Grade 3 une extériorisation au-delà de l’hymen,
• Grade 4 une extériorisation maximale par rapport à l’hymen.
Cette classification souvent utilisée par les praticiens, est parfois remplacée dans les publications par la classification POP-Q décrite en 1996, classification beaucoup plus complexe à utiliser en pratique courante, mais qui permet des études comparatives dans la littérature.
Différents stades de prolapsus génital selon la classification de Baden et Walke :

Les examens complémentaires ne sont pas nécessaires dans l’exploration d’un prolapsus génital. Néanmoins, certains pourront être pratiqués en fonction de symptômes, comme le bilan urodynamique comprenant une débitmétrie et une recherche de résidus post mictionnel, si des signes urinaires existent, en particulier mixtes. Une échographie pelvienne pour rechercher une pathologie utéro-annexielle, un frottis cervico-utérin ou une recherche d’HPV, peut être pratiquée. Un bilan urinaire avec une échographie rénale, en particulier si le prolapsus est important de type 4, du fait des risques de dilatation urétérale avec un retentissement rénal. Un bilan digestif en fonction des signes digestifs associés, une échographie ou une manométrie anorectale. L’IRM dynamique, très à la mode actuellement, montre une bonne visualisation des espaces prolabés, et a surtout un intérêt dans les prolapsus complexes et/ou récidivants.
Il ne faudra jamais oublier la clinique, car ce sera la clinique que l’on va corriger, et évidemment faire attention au syndrome douloureux pelvien pouvant être associé, en prévenant bien les patientes qu’il peut être persistant en post-opératoire, et qu’a priori le prolapsus n’a aucune raison d’entraîner des douleurs particulières. Bien décrire le prolapsus génital et évaluer son retentissement est absolument fondamental, et il ne faudra traiter que les prolapsus symptomatiques.
Le traitement sera d’abord non chirurgical, par correction des facteurs de risque pouvant être améliorés, en particulier la lutte contre l’obésité (exercice physique), la régularisation du transit intestinal, le traitement d’une toux chronique, ou l’éducation thérapeutique au port de charges lourdes. Éviter bien sûr l’atrophie cutanéo-muqueuse et musculaire par des œstrogènes locaux, mais en général chez la femme jeune, ce n’est pas tellement le problème.
Enfin, il faudra envisager une rééducation périnéale qui sera en général très bien faite par une sage-femme, parce qu’elle doit être digitale, sans sonde d’électrostimulation systématique. Elle consistera au renforcement des muscles du plancher périnéal, permettant une amélioration en cas de prolapsus de grade 1 ou de grade 2. Cependant la Cochrane 2 006 n’avait pas permis, par manque de données, de montrer son efficacité totale. Elle est également efficace sur l’incontinence urinaire d’effort. Ces exercices pourront être poursuivis à domicile, ce qui est très important, soit avec utilisation de boules de Geisha, ou d’une sonde connectée. Il faudra aussi corriger certaines anomalies posturales, en particulier la contraction abdomino-pelvienne, le port de semelles. Cette rééducation périnéale est surtout indiquée chez des patientes qui souhaitent éviter une aggravation trop rapide. Néanmoins, il n’a pas été fait de démonstration du bénéfice préventif de ce traitement vis-à-vis du risque de prolapsus sur le long cours en post-partum, et il n’a pas été fait démonstration du bénéfice en cas de prolapsus de grade 3 ou plus.
Deuxième moyen de prise en charge, c’est le pessaire. Le pessaire doit être mis pour certains en 1ère intention, en alternative, ou en attente d’une grossesse, et en tout cas comme test thérapeutique. Peu d’études chez la femme jeune. Le pessaire risque d’altérer la féminité et d’entraîner des troubles lors des rapports sexuels (en particulier, il faut retirer les pessaires cubes avant les rapports sexuels) et il entraîne une gêne chez 2 à 33 % des femmes porteuses de pessaire. La poursuite du traitement par pessaire se fait néanmoins dans 56 à 73 % des cas, et s’il est encore présent à 1 mois, il existe jusqu’à 86 % de poursuite de ce traitement. Les pessaires ont différentes formes, soit anneau, soit cube, le tout en silicone. Ils doivent être placés sous les organes génitaux, dans le vagin, entre la face postérieure de la symphyse pubienne et la concavité sacrée. Le retrait et le nettoyage doivent avoir lieu tous les 2 ou 3 mois. Bien sûr, le pessaire va réduire la gêne fonctionnelle au stade 2, en revanche, il sera totalement inefficace pour un stade 4. Il y a de rares mauvaises tolérances au long cours, avec des infections vaginales, des ulcérations muqueuses de l’ordre de 3 à 10 %, ou des fistules en particulier chez les femmes plus âgées.
Enfin, arrivera la chirurgie, en cas d’absence d’efficacité de la rééducation périnéale, de prolapsus trop important, de retrait de pessaire, ou de non-volonté de porter un pessaire. La chirurgie peut être faite par voie basse, en 1ère intention, et 2 techniques peuvent être faites chez la femme jeune. L’intervention de Manchester, qui consiste en une amputation +/- importante du col utérin en cas d’allongement hypertrophique et une transposition antérieure des ligaments utérosacrés. Les risques de cette intervention sont la sténose du col, la surveillance du col et l’accouchement prématuré au cours d’une grossesse.
Deuxième type d’intervention, c’est l’intervention de Richardson, qui est un pseudo-Richter, c’est-à-dire une fixation de l’isthme utérin et des utérosacrés au ligament sacro-épineux unilatéral. Les risques sont les récidives, 6 à 23 % des cas, et les dyspareunies profondes.
Enfin, la chirurgie peut être faite par voie haute avec la promontofixation associée à une conservation utérine qui entraîne un risque de récidive de 6,6 %.
La chirurgie est indiquée lorsque la gêne ressentie reste importante malgré la rééducation et le pessaire, et lorsqu’il existe des troubles associés (incontinence urinaire d’effort, ou des troubles sexuels).
En complément de la cure de l’hystéroptose, principal élément, nous pouvons traiter l’étage antérieur avec une plicature ou un plastron du fascia de Halban, mais qui entraîne un risque de récidive de l’ordre de 37 %, d’où l’utilisation de fils non résorbables ; et l’étage postérieur par la myorraphie de releveurs avec un risque de dyspareunie lorsque celle-ci est trop importante.
Il sera essentiel chez la femme jeune, de respecter le calibre vaginal pour éviter de diminuer ce calibre de façon trop importante et d’entraîner des dyspareunies d’intromission et au cours des rapports sexuels.
Faut-il réaliser une hystérectomie ? Il n’y a pas de raison de pratiquer une hystérectomie systématiquement au cours de la cure d’un prolapsus génital. Une hystérectomie ne modifie pas la fonction sexuelle.
Toute cure chirurgicale présente de bons résultats, 70 à 90 % de bons résultats, mais présente également des risques de complications. Complications per opératoire ou post opératoires, voir complications tardives. Parmi les complications de la voie basse, on peut noter des plaies vésicales ou rectales, les hématomes de l’espace de Retzius, les infections en particulier tardives. Il peut y avoir une incontinence révélée par la cure d’un prolapsus, une dyspareunie, et des risques de récidive. Par voie haute, les complications per opératoires peuvent être des plaies viscérales, des accidents thromboemboliques, des syndromes occlusifs, des infections, des dyspareunies, un risque de récidive du prolapsus, et une aggravation d’une l’incontinence urinaire.
Une cure de prolapsus par voie basse ou par voie haute permet de traiter 30 à 60 % des incontinences urinaires à l’effort. La chirurgie peut être en 2 temps lorsqu’il existe une incontinence urinaire.
La question importante, pour les sages-femmes, est évidemment la voie d’accouchement après le traitement d’un prolapsus. Cette voie d’accouchement a été peu étudiée dans la littérature, et ce sont donc des avis d’experts.
On considère qu’un accouchement se fera plutôt par césarienne après une promontofixation, alors qu’il peut se faire par voie basse après une cure de prolapsus par voie vaginale. Bien sûr, il existe un risque de récidive après Richardson, un risque d’anomalie de la dilatation cervicale après Manchester.
En cas de pratique d’un TVT ou d’un TVTO, la voie basse est autorisée. Et s’il existe un traitement d’une cystocèle +/- d’une rectocèle, il faudra discuter de la voie d’accouchement. De toute façon, il faudra toujours prévenir la femme du risque de récidive lors d’un accouchement par les voies naturelles après une cure de prolapsus génital.
• En conclusion, le prolapsus vaginal n’est pas une fatalité, et constitue un vrai handicap.
• 12 % des femmes en âge de procréer peuvent présenter un prolapsus génital, il ne faut pas hésiter à en parler lors des consultations avec les patientes.
• L’examen clinique est absolument primordial, les examens complémentaires sont à indiquer qu’en cas de signes cliniques ajoutés.
• La correction des facteurs de risque, la rééducation, le pessaire, sont les premières thérapeutiques à mettre en œuvre.
• La chirurgie, voie basse ou voie haute, intervient ensuite si la gêne est persistante.
• En général l’accouchement se fait par voie basse après la chirurgie, mais il faut prévenir des risques de récidive.
Le prolapsus génital touche 6,5 % des femmes de moins de 30 ans.
Les prolapsus sont classés selon la classification classique de Baden et Walker (Sélectionnez la réponse fausse) :
Il existe 3 types de mutilations sexuelles féminines.
Le traitement du prolapsus sera d’abord non chirurgical :
Orateur : Marion VALLET, sage-femme, Versailles
Comptes-rendus rédigés par Mme Camille TALLET
À l’heure où l’on constate une importante baisse de la fertilité, un des enjeux pour notre profession est de se positionner en première ligne dans la prise en charge des femmes et des couples lors des consultations gynécologiques et pré-conceptionnelles afin de réduire l’attente avant la grossesse. Contrairement aux idées reçues, les femmes ne sont pas fertiles à tout moment et donc il est grand temps d’adapter les conseils sexologiques afin que les rapports sexuels puissent avoir lieu de façon ciblée dans la phase de fertilité du cycle plutôt que tous les 2 jours comme c’est si souvent conseillé…
Mais comment identifier cette phase de fertilité ? Toutes les femmes en sont-elles capables ? Comment adapter les conseils pour la sage-femme ? Jusqu’où informer ?
De nombreux scientifiques se sont intéressés et s’intéressent encore aux marqueurs biologiques du cycle, que l’on va appeler biomarqueurs.
Quelques points d’histoire :
D’abord, dans les années 1920, les scientifiques Kyusaku Ogino et Hermann Knaus ont constaté de manière indépendante que l’ovulation avait lieu en moyenne 14 jours avant le premier jour des règles. Découverte du siècle sur la fertilité qui a permis de mieux comprendre le cycle ! À partir de cette donnée, le docteur Léo Latz, gynécologue obstétricien, a publié en 1932, l’ouvrage Rythme d’infertilité et de fertilité chez les femmes. Il y décrivait déjà les formules qu’une femme pouvait utiliser pour prédire la période de fécondité de son cycle en fonction de ses cycles précédents. Il nous faut rappeler qu’à l’époque il y a près de cent ans, cette méthode basée sur le calendrier était l’une des plus efficaces ! Dans les années 1950, d’importantes découvertes scientifiques fondamentales ont été faites quant au rôle essentiel du mucus cervical sur la santé reproductive. En 1964, le docteur John Billings a mis en évidence le rôle du mucus cervical dans la fertilité en réalisant une étude en Australie auprès de nombreuses femmes. Par la suite, le professeur Erik Odeblad a identifié et décrit les différents types de cellules du col utérin, les différentes sortes de mucus cervical qu’elles produisent, et leurs interactions avec les hormones.
Ces importantes découvertes ont fixé les bases du développement des méthodes modernes de planification familiale naturelle (PFN ; en anglais NFP, Natural Family)
Ce vaste corpus de preuves et de connaissances a continué à s’enrichir au XXIe siècle grâce à des recherches approfondies sur les différentes méthodes d’observation du cycle, appelées habituellement en France « méthodes naturelles de régulation des naissances ».
Ces différentes méthodes sont basées sur l’observation des marqueurs biologiques de la fertilité que nous appellerons ici les « biomarqueurs ». Il existe deux biomarqueurs constants que sont le mucus cervical et la température basale du corps et des biomarqueurs inconstants ou accessoires.
LES BIOMARQUEURS DE LA FERTILITÉ
Produit par le col de l’utérus ou cervix, le mucus cervical est sécrété plus précisément par les cryptes cervicales. Il est composé majoritairement d’eau (à plus de 90 %), de cellules de l’immunité (leucocytes et lymphocytes), de substances nutritives et enzymatiques, et forme un réseau de mailles tridimensionnelles qui vont, au fil du cycle, plus ou moins se serrer, empêchant ou favorisant le passage des gamètes mâles. De ce fait, il joue un rôle essentiel dans la fécondité. Ce mucus sécrété par la femme joue un rôle indispensable pour la fertilité du couple.
Le mucus cervical est le signe par excellence du cycle ovulatoire. Il est à la fois un signe interne et externe, perceptible et visible. Il apparaît dans le cycle quelques jours avant l’évènement majeur que constitue l’ovulation. Le mucus cervical est un marqueur biologique que la femme peut percevoir de façon très précise si elle a appris à l’observer. Une étude multicentrique menée par l’OMS en 1981 a montré que 99,5 % des femmes des pays en voie de développement sont capables de percevoir le mucus cervical au cours du premier cycle si elles ont reçu un enseignement de qualité (97,4 % pour les femmes occidentales !). Par ailleurs, plus récemment, une autre étude multicentrique sur plus de 7 000 cycles a montré le lien entre les rapports sexuels ciblés en phase fertile et la fécondité du cycle.
Il est intéressant de souligner que le cervix contient en permanence du mucus cervical, mais selon le climat hormonal du cycle, sa nature évolue. La majeure partie du cycle, le col est obstrué par un mucus compact ; cependant, durant 4 à 5 jours, le mucus cervical est plus fluide, il s’écoule et rend la femme fertile (il est alors observable). La fertilité de la femme est ainsi régulée par les différentes fonctions de ces sécrétions. En raison de la diversité de leurs combinaisons, la femme peut apprécier sa fertilité en observant des modifications dans l’apparence et la sensation du mucus cervical au niveau de la vulve et plus précisément des petites lèvres grâce à une grande innervation (récepteurs de Merkel et de Paccini).
Les travaux du professeur Erik Odeblad, médecin biophysicien suédois, qui a concentré ses recherches durant de nombreuses années sur le mucus cervical, ont permis de distinguer plusieurs types de mucus, sécrétés par différentes cryptes cervicales, qui ont chacun des rôles bien distincts. Selon des compositions biochimiques et des formes microscopiques très caractéristiques, il a pu décrire les mucus G, L, S et P.
• Le mucus G, produit dans les cryptes cervicales les plus basses, est le mucus qui obstrue le col de l’utérus pendant la majeure partie du cycle, empêchant l’entrée de spermatozoïdes dans le col de l’utérus, et assurant ainsi l’infertilité lorsqu’il est présent. C’est une sécrétion très riche en leucocytes et lymphocytes et, à ce titre, ce mucus fait partie du système immunitaire, protégeant l’appareil génital de la femme des infections. On l’appelle mucus G pour gestagenic. Il a la même racine étymologique que « gestation ». Il est impénétrable et donc antibactérien pour protéger l’éventuelle grossesse. Il constitue le « bouchon muqueux ». En réalité, il est aussi bien présent chez une femme non gravide durant un certain nombre de jours de son cycle.
• Le mucus L est sécrété par des cryptes sur toute la longueur du canal cervical. On l’appelle L pour locking in mucus qui signifie « enfermé dans le mucus ». En effet, ce mucus emprisonne les spermatozoïdes de mauvaise qualité. On peut aussi dire L pour leaf, qui signifie « feuille », car, une fois séché, il forme au microscope des images ressemblant à des feuilles de fougères. Véritable échafaudage, support des mucus P et S, le mucus L, attire donc et élimine les spermatozoïdes de mauvaise qualité, ne laissant que les spermatozoïdes de meilleure qualité. Une fois produit, il quitte le col de l’utérus, tapisse les parois du vagin jusqu’à la vulve. La femme peut alors percevoir sa présence suite à la modification de ses sensations, et même le constater visuellement en s’essuyant ou en se lavant.
• Le mucus S est sécrété par des cryptes occupant la moitié supérieure du col de l’utérus. Au microscope, il apparaît comme une succession de lignes parallèles. Le mucus S porte ce nom pour sperm transmission mucus, qui se traduit par « mucus qui guide les spermatozoïdes » puisqu’il forme comme un réseau de filaments dans le canal cervical. Il est lui aussi présent les quelques jours avant, pendant et après l’ovulation et contribue à la fertilité de la femme. Le mucus S assure la nutrition des spermatozoïdes de bonne qualité et les canalise pour les transporter vers les cryptes S.
• Le mucus P est produit par les cryptes les plus hautes du col de l’utérus. Il est disposé en couches comme un oignon, juste en dessous de l’isthme utérin. Peu de temps avant l’ovulation, le mucus P atteint 4 à 8 % du volume total des sécrétions et, en se combinant à une enzyme, il a un effet liquéfiant, en particulier sur le mucus L, de sorte que les spermatozoïdes jusqu’alors enfermés dans les cryptes sont relâchés et peuvent maintenant poursuivre rapidement leur ascension dans les voies génitales. En liquéfiant les mucus L et S, le symptôme du sommet est une sensation très lubrifiante (glissante) au niveau de la vulve, parfois sans mucus visible. Ensuite, la quantité de mucus P diminue jusqu’à 3 jours après le pic de fertilité. Le professeur Odeblad l’a appelé mucus P pour peak, « sommet ».
© WOOMB International
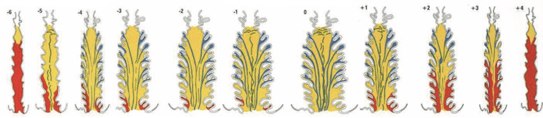
Schéma illustrant les différents types de mucus cervical lors de la phase fertile du cycle ovulatoire (mucus G en rouge, L en jaune, S en bleu et P en vert foncé).
Voici comment s’enchaînent précisément les différentes étapes de sécrétions.
Six jours environ avant le pic ou sommet, le niveau d’estradiol est bas et le col utérin étroit est obstrué par du mucus G épais. Les spermatozoïdes sont maintenus dans le vagin où leur temps de survie est très court, de l’ordre de quelques minutes. La vulve est perçue comme sèche, ou la femme peut remarquer un léger écoulement constant. Elle est dans une phase infertile.
Lorsque le niveau d’œstradiol commence à augmenter, le mucus P liquéfie le bouchon de mucus G et, mélangé au mucus L, il quitte le col de l’utérus. Les spermatozoïdes peuvent maintenant entrer dans le cervix. Le mucus s’écoule et atteint rapidement la vulve qui n’est plus ressentie sèche par la femme.
La phase de fertilité évolutive commence dès le changement de sensation à la vulve. Au fur et à mesure que le taux d’œstradiol augmente, le mucus G diminue, les mucus L et S augmentent, et le mucus P réapparaît à nouveau très près de l’ovulation. Les modifications des sensations fertiles observées à la vulve sont causées par l’évolution des proportions des différents types de mucus. Des filaments de mucus élastique, en raison de la présence des mucus L et S, très favorables au transport et à la nutrition des spermatozoïdes, peuvent apparaître avant le sommet de la fertilité, laissant ensuite la place à un écoulement liquide comme de l’eau et une sensation lubrifiante à la vulve. La femme est alors au sommet de sa fertilité. L’ovulation est imminente. Le col de l’utérus a atteint son ouverture et sa préparation maximale pour la capacitation des spermatozoïdes. Le niveau d’œstradiol est très élevé et va chuter rapidement. Les conditions sont optimales pour la sélection et le transport rapide de spermatozoïdes de haute qualité grâce au mucus cervical. Le taux de progestérone commence alors à augmenter. La vulve est ressentie glissante, indiquant le pic de fertilité.
Au cours des 3 jours suivant le sommet, le mucus G réapparaît dans les cryptes cervicales, et, dans le col de l’utérus, le nombre de canaux pour le transport des spermatozoïdes décroît. Comme l’ovulation peut se produire le jour sommet et les 48 heures qui suivent et comme l’ovule peut survivre jusqu’à 24 heures, une conception est possible jusqu’au troisième jour inclus suivant ce pic.
Durant ces 3 jours, la vulve est ressentie par la femme comme sèche ou collante, en raison de l’action de la progestérone sur les poches de Shaw (celles vaginales jouant un rôle de déshydratation du mucus sous l’influence progestéronique), situées à l’extrémité inférieure du vagin, qui absorbent l’humidité du mucus cervical avant qu’il n’atteigne la vulve. Le mucus est comme déshydraté. Bien que la femme ne se sente plus mouillée ni glissante, ces trois jours sont toujours potentiellement fertiles.
Du quatrième jour après le sommet jusqu’au début des menstruations suivantes (11 à 16 jours après le jour pic/ sommet), la femme est infertile et le col de l’utérus reste obstrué par du mucus épais.
En plus du biomarqueur du mucus cervical, le corps de la femme a une température de base, maintenue aux environs de 36-36,5 °C, que l’on appelle l’homéostasie. Cependant, cette température varie légèrement au cours du cycle.
En effet, lorsqu’une femme prend sa température (avec un thermomètre d’une précision à deux décimales) par voie buccale, rectale ou vaginale (mais toujours par le même orifice !), le matin avant de poser le pied par terre, elle pourra observer les modifications suivantes : la température est basale avant la lutéinisation (pic de LH), elle s’élève ensuite de 0,3 à 0,5 °C au moment de l’ovulation et reste à un plateau thermique jusqu’aux règles, c’est-à-dire qu’elle demeure haute et stable pendant la phase post-ovulatoire.
C’est la progestérone qui a une action hyperthermiante. Elle est également « stabilisante », car sous son influence la température reste haute et stable. La courbe de température est ainsi basse et fluctuante avant l’ovulation, et plus haute et stable après l’ovulation.
La prise de température est parfois recommandée en PMA aux femmes. Il est important de leur transmettre les bonnes informations afin que celle-ci soit optimale !
• Attention, quand la température s’élève, l’ovulation est imminente ou a déjà eu lieu.
• Le thermomètre doit avoir une précision au centième (donc il faut un thermomètre spécifique et un thermomètre de grande surface ne suffira pas).
• La prise doit s’effectuer en buccal, vaginal ou rectal et toujours par le même orifice pendant 1 minute le matin au réveil, avant de poser le pied par terre.
• La femme doit collecter les températures sur un graphique (papier ou application).
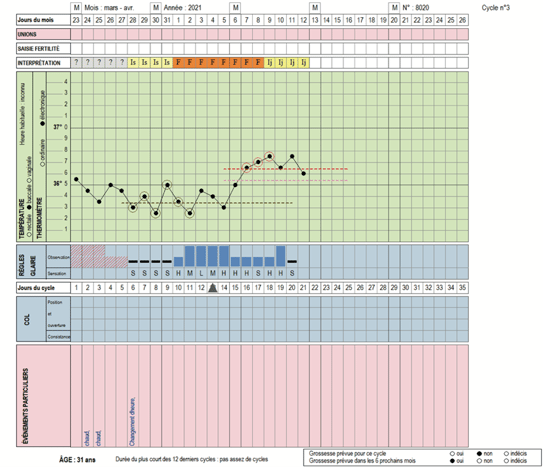
Ensuite la sage-femme ou le médecin peut analyser simplement ce graphique afin de vérifier la qualité ovulatoire. Pour attester d’une ovulation, il faut que la courbe soit bi-phasique et que le plateau soit d’une longueur supérieure à 11 jours. En deçà, on diagnostique une dysovulation (phase lutéale déficiente).
La courbe thermique biphasique (données issues du logiciel Dafra® - Cyclamen®)
En plus des deux biomarqueurs principaux, d’autres signes secondaires sont observables par la femme. Chez certaines, ils seront très visibles, alors que chez d’autres ils seront inexistants, ou plutôt imperceptibles, car ils sont bien présents. Voici ce à quoi elles peuvent être attentives.
Lors du cycle ovulatoire, l’utérus va varier dans sa position. Ainsi, pendant les phases infertiles du cycle, l’utérus est plus bas et antéversé chez la plupart des femmes. Le col est donc dirigé en postérieur.
Quand la femme est en phase fertile, l’utérus se redresse et ascensionne, entraînant le col avec lui. Celui-ci se retrouve alors plus haut et plus centré au fond du vagin, beaucoup plus accessible au spéculum. Donc col accessible et centré = mucus cervical qui s’écoule !
Ces signes peuvent être perceptibles par la femme et certaines femmes examinent leur col en plus de l’observation du mucus et de la température.
Le professeur Erik Odeblad a mis en lumière un phénomène qu’il a appelé « la vulve gonflée ». Sous l’influence de la croissance oestrogénique qui entraîne un important afflux sanguin dans le pelvis, un œdème se crée au niveau de la vulve. La femme peut percevoir ce phénomène au niveau de ses sensations, et peut aussi le ressentir au toucher.
La vulve, au niveau du périnée postérieur, à la jonction des petites lèvres, est plus œdématiée et tendue pendant cette période fertile pré-ovulatoire. L’œdème atteint son paroxysme lors du jour sommet de la fertilité. C’est tout à fait visible à l’examen clinique si l'on y prête attention.
Ce phénomène est bien connu des éleveurs de mammifères ainsi que des vétérinaires : un œdème vulvaire survient au moment de l’œstrus, quand les femelles sont en chaleur, c’est-à-dire que l’ovulation est imminente. C’est à ce moment-là qu’ils effectuent des inséminations quand ils souhaitent que les femelles aient des petits.
Certaines femmes réussissent à percevoir l’augmentation de volume d’un ganglion dans le pli de l’aine concomitamment à l’ovulation. Ce ganglion, présent mais plus petit et donc non perceptible habituellement, prend la taille d’un petit pois au moment de l’ovulation et apparaît du côté de l’ovaire où a lieu l’ovulation. Pour le percevoir, la femme doit poser son index sur l’artère fémorale (dans le haut de la cuisse) et elle peut alors le ressentir avec son majeur. La sage-femme peut le percevoir à l’examen clinique.
Il est important d’aborder la question de la douleur ovulatoire, car bien que celle-ci ne soit pas systématique, comme certains autres signes, certaines femmes la perçoivent très bien. Dans certaines langues, il existe même un mot spécifique pour la nommer ! La langue anglaise utilise le mot allemand Mittelschmertz (« douleur du milieu », le milieu du cycle). Cette douleur, aiguë ou diffuse, centrale ou latérale dans le bas-ventre, peut apparaître dans la période péri-ovulatoire, ces jours qui entourent l’ovulation. Elle est souvent due, une fois que l’ovulation a eu lieu, à l’écoulement du liquide folliculaire dans le cul-de-sac de Douglas. Mais cette douleur peut aussi être provoquée par l’augmentation de volume du follicule et la tension engendrée sur les ligaments ovariens avant l’ovulation, ou encore à certains mouvements des trompes utérines avant ou après l’ovulation.
À noter ! Attention, contrairement à ce que certaines femmes imaginent, la douleur ne peut pas, à elle seule, confirmer à la femme son ovulation. Ce n’est pas un biomarqueur suffisamment précis, régulier et donc fiable. La femme peut noter la survenue de cette douleur dans son tableau d’observations, mais il ne lui est pas conseillé d’utiliser cet élément pour déterminer si tel jour du cycle est un jour de fertilité ou d’infertilité.
La sage-femme par son expertise sur la physiologie de la femme est l’interlocuteur privilégié dans la transmission de cette connaissance qui va permettre à la femme d’atteindre une bonne expertise de son cycle et la compréhension des différentes phases.
A. Enrichir sa consultation par la transmission de l’auto-observation
La sage-femme peut transmettre ces connaissances sur le mucus cervical lors du suivi gynécologique de prévention et de dépistage à toute femme. C’est notamment important de le faire le plus tôt possible et notamment lors de la consultation de contraception et de prévention de la jeune femme.
C’est un élément essentiel pour suivre sa santé génésique si elle a un cycle physiologique. Tout comme l’autopalpation de seins permet de dépister un cancer du sein, l’auto-observation du cycle permet à la femme de vérifier la qualité de son ovulation qui est un marqueur de bonne santé. Un trouble de l’ovulation aura des conséquences sur la fertilité mais aussi sur son bien-être physique et psychique (SPM par exemple, mais aussi ménorragies, etc. …).
B. Intérêt du tableau d’observation du cycle pour la sage-femme
Quand la femme acquiert l’auto-observation à l’aide d’une méthode d’observation du cycle (MOC), elle va tenir un relevé quotidien de ses observations et un tableau de son cycle. Ce tableau est pour la sage-femme un élément clinique qui devient vite essentiel à son suivi gynécologique et à son analyse de la qualité ovulatoire.
Sur le tableau, la sage-femme peut déceler :
• Un trouble de l’ovulation par une anomalie de la phase de mucus (phase courte, évolution non classique, absence de lubrification) ;
• Une anomalie du corps jaune par un rétrécissement de la phase lutéale, ou par la présence de spottings prémenstruels ou post-menstruels ;
• Une anomalie des saignements.
De même que le tableau permet de qualifier les différents types de saignements physiologiques : menstruations, privation, poussée oestrogénique ou nidation.
Lorsqu’une anomalie clinique est constatée sur le tableau, la sage-femme va pouvoir poser un diagnostic ou émettre des hypothèses et explorer finement grâce à la paraclinique (analyse biologique de première intention, imagerie). Le tableau permet de dater une grossesse de façon précise en cessant de considérer que la conception a lieu 14 jours après la date des dernières règles, surtout pour les femmes qui n’ont pas des cycles de 28 jours ! Cela renforce véritablement la place de la sage-femme dans le parcours de soins et l’orientation des patientes grâce à un adressage précis et ciblé contribuant à une bonne visibilité et crédibilité auprès des médecins.
C. Le tableau pour optimiser les explorations prises en charges thérapeutiques dans le champ de nos compétences
De plus, le tableau du cycle va également permettre d’optimiser les explorations biologiques en fonction de l’ovulation et non du calendrier. Pour les sages-femmes échographistes qui font de la gynécologie, la femme va pouvoir venir au bon moment pour un monitorage de l’ovulation. Il en est de même pour ce qui est de la prise en charge thérapeutique de concert avec le médecin. En effet, bien que très limitée dans l’allopathie, les compétences complémentaires des sages-femmes comme l’acupuncture, la phytothérapie, l’ostéopathie, la micronutrition etc. vont pouvoir être plus adaptées en fonction de la phase du cycle, des troubles fonctionnels et non des jours du calendrier, au service de nos patientes. Par exemple, si la sage-femme souhaite booster l’ovulation elle va pouvoir s’adapter au cycle à l’instant T et ne pas considérer que l’ovulation est au jour 14 ou à peu près au milieu et donc potentiellement « tomber » à côté. Ainsi nous ne devrions plus prescrire ou voir prescrit des traitements du Jour 1 au jour 14 ou du jour 16 au jour 25 de cycle.
Il existe différents types de mucus cervical en phase fertile
(Sélectionnez la réponse fausse)
La prise de température est parfois recommandée en PMA aux femmes. Il est important de leur transmettre les bonnes informations afin que celle-ci soit optimale !
(Sélectionnez la réponse fausse).
Il existe deux biomarqueurs constants que sont le mucus cervical et la température basale du corps :
La prise de la température doit être prise avec un thermomètre d’une précision à deux décimales :
Orateur : Faustine CHERRIÈRE, gynécologue obstétricienne, Vannes.
Comptes-rendus rédigés par Mme Camille TALLET
Un couple sur cinq rencontre des difficultés pour procréer. Il est considéré comme infertile s’il n’a pas pu concevoir d’enfant après 12 à 24 mois de tentatives sans contraception.
Dans environ 15 % des cas, cette incapacité est inexpliquée. Dans d’autres cas, elle est liée à une altération de la qualité de sperme chez l’homme (nombre et/ou mobilité des spermatozoïdes), à un trouble de l’ovulation ou encore à un problème de trompes chez la femme. Il s’agit aussi souvent de problèmes de fertilité mixtes, c’est-à-dire concernant les deux membres du couple.
Le recul de l’âge des femmes désirant concevoir un premier enfant est une cause importante d’infertilité et de recours à l’AMP. L’âge moyen au moment de devenir mère est passé de 26,5 ans en 1977 à 30,4 ans en 2016 d’après la dernière Enquête nationale périnatale. Désormais, 21,3 % des femmes ont plus de 35 ans quand elles accouchent et 4,1 % plus de 40 ans. Or, après 35 ans, il existe un déclin de la qualité des ovocytes qui augmente significativement le risque d’infertilité.
À partir de 38 ans, 30 % des femmes n’arriveront pas à avoir d’enfant.
De récents travaux de l’Institut de veille sanitaire montrent par ailleurs une tendance à la baisse de qualité du sperme chez les hommes représentatifs de la population générale sur la période 1989-2005 et sur la période 1998-2008. Ils montrent également une augmentation des taux de cancer du testicule, de cryptorchidie et d’hypospadias, avec des différences géographiques. Indépendamment des causes génétiques ou constitutionnelles, il existe probablement des facteurs environnementaux pour expliquer cette tendance : le surpoids, le tabagisme, l’obésité et les expositions environnementales, notamment à certains polluants organiques persistants (tels que les PCB) et métaux lourds. Certaines de ces substances agissent à faible dose et exercent des effets différés dans le temps.
Après un an de tentatives de grossesse spontanée sans contraception, 18 % à 24 % des couples restent sans enfant, selon l’Observatoire épidémiologique de la fertilité en France (Obseff). Après deux ans, 8 % à 11 % des couples sont toujours en attente d’une grossesse.
Un couple sur 5 consultera en PMA ce qui, bien heureusement, aboutira à de nombreuses naissances.
En France, en 2018, 1 enfant sur 30 (3,4 %) environ a été conçu grâce à une technique d’AMP, qu’il s’agisse d’une FIV ou d’une insémination. La FIV domine désormais le paysage de l’assistance médicale, représentant 70 % des enfants conçus par AMP.
Après cette grossesse obtenue parfois difficilement, on peut s’interroger sur la nécessité d’une contraception ainsi que sur son type.
Selon une étude parue dans la revue scientifique Human Reproduction, une femme sur cinq peut tomber enceinte naturellement après une FIV infructueuse. (Treatment-independent live birth after in-vitro fertilization: a retrospective cohort study of 2,133 women Yousuf ElMokhallalati, Rik van Eekelen, Siladitya Bhattacharya, David J McLernon).
Les chercheurs ont alors observé que dans les 5 années de suivi à la suite d’une FIV, le taux de grossesse spontanée avec naissance était de 17 % chez les femmes dont le traitement par FIV avait échoué et de 15 % chez les femmes dont le traitement avait donné lieu à une naissance.
De manière générale, ils ont aussi relevé que la durée plus courte de l’infertilité, l’âge plus jeune des femmes et la FIV par rapport à la FIV ICSI étaient associés à une plus grande probabilité d’obtenir une naissance indépendante du traitement.
Dans le post-partum, plusieurs solutions s’offrent à nous. Il faudra ensuite s’adapter au type d’infertilité et donc à chaque patiente :
• Les pilules microprogestatives et l’implant contenant des progestatifs sont utilisables à partir de 21 jours après l’accouchement.
• Une pilule œstroprogestative (ou l’anneau) peut être commencée à partir de 42 jours et ce délai peut être raccourci à 21 jours en l’absence de risque de phlébite et d’autres contre-indications (risque cardiovasculaire élevé…). Elles ne sont pas recommandées chez les femmes qui allaitent, dans les 6 mois qui suivent l’accouchement.
• Quatre semaines après l’accouchement, un stérilet au cuivre ou un stérilet hormonal (au lévonorgestrel) peuvent être posés en l’absence de contre-indications (infection sexuellement transmissible par exemple). La pose d’un stérilet au cuivre est possible dans les 48 heures suivant l’accouchement, mais n’est pas d’usage courant.
• Le préservatif.
Devant certaines causes d’infertilité, une contraception doit être proposée. Celle-ci sera toujours à choisir après discussion avec la patiente.
Plusieurs situations peuvent se présenter :
• Infertilité d’origine masculine :
La qualité spermatique est fluctuante, elle peut s’améliorer mais souvent modérément. Cependant, tant qu’il n’y a pas d’azoospermie il est difficile de conclure à un risque zéro. Nous pouvons donc proposer une contraception citée précédemment.
• Infertilité d’origine féminine - Tubaire :
En cas d’imperméabilité tubaire bilatérale, il faut rester prudent : est-ce lié à une infection, une salpingectomie bilatérale ? Le diagnostic a été posé sur une hystérosalpingographie, une cœlioscopie épreuve au bleu ? Les chances de grossesse sont minimes mais pas nul si le diagnostic est incertain. Il existe parfois des spasmes pendant l’hystérosalpingographie…
• Infertilité d’origine féminine - Endométriosique :
La contraception fait pleinement parti du traitement de l’endométriose. Il soulage les patientes en bloquant le cycle et il diminue l’évolution de la maladie.
Nous pouvons proposer en première intention une pilule œstroprogestative en continu ou un stérilet au lévonorgestrel et en deuxième intention du dienogest en continu ou un progestatif. Le but étant de mettre en aménorrhée la patiente.
• Infertilité d’origine féminine - Syndrome des ovaires polykystiques :
Lorsqu’une patiente a une spanioménorrhée de plus de 3 mois ou est en aménorrhée, il est recommandé de lui proposer une contraception œstroprogestative en première intention pour plusieurs raisons :
- Réduire le risque de cancer de l’endomètre lié à son hyperplasie ;
- Régulariser les saignements ;
- Réduire les effets de l’hyperandrogénie tel que l’acné ;
- Diminuer les risques de diabète de type 2.
• Infertilité d’origine féminine - Aménorrhée haute :
En cas d’aménorrhée haute, il n’y a pas de grossesse possible. Mais il est important de supplémenter en œstrogène la patiente pour diminuer le risque d’ostéoporose et préserver le système cardiovasculaire.
Au total, il y a deux situations principales où il est important de proposer une contraception : L’endométriose et le syndrome des ovaires polykystiques.
Dans les autres cas, il faut savoir discuter avec le couple, en rappelant que les chances de nouvelles grossesses sont loin d’être nul. Ils doivent alors être conscients du risque de grossesses rapprochées.
À partir de 38 ans (Sélectionnez la bonne réponse)
Dans le post-partum, plusieurs solutions sont possibles. Il faudra ensuite s’adapter au type d’infertilité et donc à chaque patiente (Sélectionnez la fausse réponse).
Dans les 5 années de suivi à la suite d’une FIV, le taux de grossesse spontanée avec naissance est de 15 % chez les femmes dont le traitement avait donné lieu à une naissance :
En cas d’infertilité à cause d’une endométriose, la patiente ne doit pas reprendre de contraceptif :
La dépression du post-partum à une prévalence
Quel est le facteur qui n’est pas associé à un nouvel accouchement instrumental ?
Quel est le risque redouter lorsqu’une patiente présente un antécédent de césarienne ?
En cas d’un second accouchement par voie vaginale après une LOSA quel est le risque d’une nouvelle LOSA ?
Article : La grossesse après un antécédent de rupture prématurée des membranes, de prématurité
En France, 7,4 % des enfants naissent avant 37 SA
La mise en place d’un sevrage tabagique, diminue le risque de prématurité
Quel est le pourcentage des grossesses qui présente une rupture prématurée des membranes avant 37 SA ?
Le repos au lit présente plutôt des risques que des bénéfices pour la grossesse :
La plupart des études sur les grossesses après don d’ovocytes chez les femmes d’âge avancé montrent (Sélectionnez la mauvaise réponse) :
À partir de quel âge maternel existe-t-il un impact négatif significatif sur les résultats en fécondation in vitro (FIV),
Une évaluation cardiologique au-delà de 45 ans, est fortement recommandée :
Le risque de diabète gestationnel est diminué dans la plupart des études, variant pour les femmes de 45 ans et plus :
Dans les complications immédiates des mutilations sexuelles féminines, le décès par hémorragie représente :
b.10-15 % de mortalité immédiate
L’enjeu principal est de permettre aux femmes excisées de dépasser le traumatisme qu’elles ont subi et de s’engager dans un processus de réappropriation de leur identité féminine.
Il existe 3 types de mutilations sexuelles féminines.
En 2014 la loi dit qu’une personne qui pratique l’excision, l’infibulation ou toute autre mutilation de la totalité ou partie des labia majora, labia minora ou du clitoris d’une femme sera passible d’une sanction pénale :
Le prolapsus génital touche 6,5 % des femmes de moins de 30 ans.
Les prolapsus sont classés selon la classification classique de Baden et Walker (Sélectionnez la réponse fausse) :
d.Grade 3 une extériorisation maximale par rapport à l’hymen.
Il existe 3 types de mutilations sexuelles féminines.
Le traitement du prolapsus sera d’abord non chirurgical :
Il existe différents types de mucus cervical en phase fertile
(Sélectionnez la réponse fausse)
d.Le mucus K
La prise de température est parfois recommandée en PMA aux femmes. Il est important de leur transmettre les bonnes informations afin que celle-ci soit optimale !
(Sélectionnez la réponse fausse).
Il existe deux biomarqueurs constants que sont le mucus cervical et la température basale du corps :
La prise de la température doit être prise avec un thermomètre d’une précision à deux décimales :
À partir de 38 ans (Sélectionnez la bonne réponse)
Dans le post-partum, plusieurs solutions sont possibles. Il faudra ensuite s’adapter au type d’infertilité et donc à chaque patiente (Sélectionnez la fausse réponse).
Dans les 5 années de suivi à la suite d’une FIV, le taux de grossesse spontanée avec naissance est de 15 % chez les femmes dont le traitement avait donné lieu à une naissance :
En cas d’infertilité à cause d’une endométriose, la patiente ne doit pas reprendre de contraceptif :