0 professionals
Coup d’œil du congrès WCCS 2022
Coup d’œil du congrès WCCS 2022
Améliorez vos connaissances professionnelles en profitant de nombreux services exclusifs dans le domaine de la dermatologie : plus de 500 visuels de pathologies, des cas cliniques, des vidéos d’experts…
Bénéficiez d’options uniques telles que l’offre de contenus audio et de supports à proposer à vos patients.
Restez informé(e) des événements et des webinaires à venir, des dernières publications scientifiques et des innovations produit.
Vous avez déjà un compte ? Se connecter
Comptes-rendus rédigés par Pr Lise BOUSSEMART Dermatologue France, Dr Maria Manuela MARTINEZ PIVA Dermatologue, Argentine
Chers Confrères,
C’est avec grand plaisir que je vous retrouve pour les résumés du World Congress on Cancers of the skin, qui se tient à Buenos Aires du 26 au 29/10/22, avec le soutien de Bioderma. Ce congrès a été reporté à plusieurs reprises depuis 2020, la séance d’ouverture (enfin !) a ainsi été assez émouvante.
Sujets liés
Après une modernisation de la classification des différents types de mélanome par Pr Boris Bastian (voir résumé du Dr Manuela Martinez Piva), Pr Claus Garbe nous a énuméré des obstacles à la prévention efficace des cancers cutanés, notamment en Europe et aux US (Garbe et al., EJC 2021). D’après lui, l’Europe et les Etats Unis tardent à voir diminuer l’incidence de leurs cancers cutanés, car l’accent n’est pas assez mis sur la prévention textile plus que par crème solaire. Il semblerait que la crème solaire seule pousse à rester plus longtemps au soleil, ce qui peut finalement être pire que de ne pas en mettre. Qu’ils appliquent de la crème solaire ou non, il a été démontré que les enfants ont autant de naevus qui poussent avec l’âge (J Bauer et al., Am J Epidemiol 2005)… alors qu’on note une baisse significative des nouveaux naevus en cas de port de t-shirt, avec ou sans short, et surtout en cas de port de chapeau. En pratique, il est vrai que la crème solaire est en moyenne mise à raison de 0,5mg/cm2 au lieu de 2mg/cm2.
Même de faibles doses d’UV (10% de la DEM=Dose Erythémateuse Minimale) sont mutagènes, même sans coup de soleil clinique. D’ailleurs à ces doses-là, la peau ne desquamant pas, les kératinocytes (et les mélanocytes bien-sûr) survivent avec leurs mutations. Mieux vaut protection textile et ne pas s’exposer.
D’autres l’ont bien compris : en Australie et Nouvelle Zélande, où la protection textile et la recherche de l’ombre ont été extrêmement encouragées, on observe une diminution d’incidence du mélanome depuis les années 2010. Pr Garbe a été provocateur au point de nous accuser nous les dermatologues, d’être responsables de l’augmentation de l’incidence des cancers cutanés si nous ne recommandons nous-mêmes que de la crème solaire.
Orateurs : Dr Manuela Martinez Piva, Pr Claus Garbe, Deborah Sarnoff
Article rédigé par Pr Lise BOUSSEMART
Ensuite, Deborah Sarnoff (NYU) nous a rappelé l’intérêt des lasers dans la prise en charge du photovieillissement. D’après elle, il existe 3 principaux chromophores dans la peau : l’hémoglobine, la mélanine, l’eau.
Pour l’hémoglobine elle préconise le PDL (« pulse dye laser » ou laser pulsé), le KTP, le YAG. Pour la mélanine : on peut traiter les lentigo par laser Q switched laser (ruby ou alexandrite).
Pour l’eau, il s’agit principalement du laser sur rides : laser ablatif CO2, erbium YAG: le principe étant de creuse des micro-trous cutanés suivis de néocollagénèse.
Pour tout ce qui est pré-cancéreux, Dr Sarnoff s’autorise parfois à proposer du laser PDL sur kératoses actiniques par exemple. Pour les cancers in situ difficiles à opérer (par exemple dans un contexte de syndrome de Gorlin ou de XP multi-opérés), la chirurgie reste le traitement de choix, mais elle signale d’assez bons résultats avec de la photothérapie dynamique intensifiée par du laser CO2, il s’agit de la « LADD » : laser assisted drug delivery. Ce 2 en 1 est très efficace mais cela requiert une cicatrisation plus longue et n’a pas encore été testé à grande échelle.
Enfin, il lui est arrivé de proposer pour des carcinomes épidermoïdes in situ du laser complètement (« fully ») ablatif (CO2 ou Er-YAG), surtout pas du fractionné, pour obtenir une réponse complète. Une vérification en microscopie confocale, post laser en oncologie, serait idéale à l’avenir car la simple disparition clinique des lésions ne suffit pas toujours.
Et voici pour le premier jour du congrès ! A demain pour la suite
Orateurs : Pr Boris Bastian
Article rédigé par Pr Lise BOUSSEMART
Chers Confrères,
La 2e journée du WCCS a commencé par 2 sessions plénières à propos du mélanome, abordé sur le versant pathogénique puis thérapeutique :
Le Pr Boris Bastian nous a détaillé l’évolution du mélanocyte « sain » vers le naevus, le naevus dysplasique puis le mélanome. Cette évolution se fait par l’accumulation progressive de mutations UV induites pour la plupart des mélanomes, mais certains sous types de mélanomes (acro-lentigineux, muqueux, ou de type « naevus bleu ») ont une génétique très différente, indépendante des UV.
Il a pris comme exemple ce mélanome développé sur naevus qu’il a étudié sur le plan histologique et moléculaire : la partie bénigne de ce naevus était mutée BRAFV600E, tandis que la partie histologiquement cancéreuse avait acquis des mutations pathogéniques supplémentaires de
CDKN2A (délétion homozygote), MAP2K1 P124L, ARID1A P2161L (Shain et al, NEJM 2015). De son point de vue, la plupart des mélanomes démarreraient comme un naevus par une mutation activatrice acquise et précoce de la voie des MAP kinases (BRAF, NRAS par exemple), puis évolueraient vers la malignité en accumulant des mutations du promoteur de TERT, puis des mutations perte de fonction de gènes suppresseurs de tumeur tels que PTEN et TP53, relativement tardives.
Toute cette accumulation de mutations au fil du temps se traduit en augmentation du TMB (=charge mutationnelle = nombre de mutations non synonymes/Mb d’ADN tumoral) entre naevus, naevus dysplasique, mélanome in situ, et mélanome (cutané). A tous ces niveaux de TMB croissants, la signature UV identifiable reste largement majoritaire. Ce travail de recherche incite, selon lui, à particulièrement protéger les naevus du soleil.
De façon intéressante, le Pr Bastian a cité les travaux de Tang J, Feening E et al, Nature 2020, qui ont séquencé des mélanocytes humains biopsiés en peau saine, puis amplifiés en culture.
Le TMB y a été mesuré particulièrement élevé et même corrélé à la localisation +/- photexposée de la biopsie (dos>lobe d’oreille>fesse…), jusqu’à des taux similaires aux TMB mesurés classiquement dans d’authentiques mélanomes. Il suspecte les lentigines typiques d’héliodermie d’être la traduction
clinique de ces clones non cancéreux mais bel et bien mutés, un peu comme, en hématologie, un pic de gammapathie monoclonale peut traduire la présence d’un clone de lymphocytaire B non nécessairement cancéreux.
A l’opposé, dans les mélanomes acro-lentigineux et muqueux, sont retrouvées plus d’amplifications de gènes que de mutations. De son point de vue, les mélanomes uvéaux et les mélanomes développés sur naevus bleu, typiquement mutés GNAQ/GNA11, dérivent de la migration ventrale des mélanocytes de la crête neurale, d’où un paysage mutationnel et évolutif très différent des mélanocytes dérivant de la migration dorsolatérale classique (Adameyko et al., Cell 2009).
Orateurs : Dr Jonathan ZAGER
Article rédigé par Pr Lise BOUSSEMART
Dr Jonathan ZAGER a ensuite exposé l’intérêt croissant de l’immunothérapie néoadjuvante pour les mélanomes avancés d’extension locorégionale, en raison notamment de la présence des néoantigènes tumoraux au moment de la mise en route du traitement, comme dans l’essai clinique PRADO ipilimumab 1mg/kg + nivolumab 3mg/kg, Reijers et al., Nature Medicine 2022 ; ou l’essai S1801. L’avenir va même probablement privilégier l’association nivolumab 480mg + relatlimab 160mg toutes les 4 semaines compte tenu de la meilleure tolérance, mais cela reste à prouver par un essai clinique de phase 3.
Orateurs : Dr Carlos Garcia Rementeria, Dr Claas Ulrich, Pr Kiarash Khosrotehrani
Article rédigé par Pr Lise BOUSSEMART
Patients immunodéprimés et les lésions génitales HPV induites
Ensuite, le Dr Maria Ivonne Arellano Mendoza a initié la session portant sur les patients immunodéprimés et les lésions génitales HPV induites.
L’immunité à médiation cellulaire permet chez l’immunocompétent de bien contrôler les lésions génitales HPV induites, mais chez le patient transplanté, les condylomes (dont le condylome géant de Buschke Lowenstein) et les carcinomes anogénitaux ont tendance à proliférer.
Dans une étude rétrospective chez les patients transplantés, il en a été retrouvé chez 1,2% des patients, vs 24% des patients dans le cadre d’une étude prospective, dont 82% d’hommes. La prévalence des lésions HPV est donc grandement sous-estimée si on ne les recherche pas activement (Nadhan KS et al., JAMA Dermatol 2018). Il est aussi important de prévenir les patients que le port de préservatif ne protège pas à 100% de la transmission.
En prévention primaire, le vaccin nonavalent à HPV couvre 63% des sérotypes d’HPV cervicaux et 64% des sérotypes d’HPV anaux. En prévention secondaire, en plus de l’examen cutanéo-muqueux, un frottis du col de l’utérus est recommandé chez les transplantés de façon annuelle.
Concernant le traitement des condylomes, l’oratrice, parmi les divers traitements locaux disponibles tels que l’acide trichloracétique, la podophylline, la photothérapie dynamique etc, recommande vivement la crème imiquimod 5%, 3 applications/semaine, jusqu’à 16 semaines, couplée à de la cryothérapie 1 semaine sur 2.
Carcinome de Merkel des patients transplantés d’organe
Le Dr Carlos Garcia Rementeria a ensuite traité le sujet du carcinome de Merkel des patients transplantés d’organe, plus fréquent et plus précoce (dès 65 ans vs 79 ans classiquement) et plus mortel que chez les patients immunocompétents (Ferrandiz-Pulido C et al., JEADV 2022).
Plus il y a d’incompatibilité « mismatch » HLA entre greffé et greffon, plus le risque de cancer cutané est grand chez le greffé car le traitement immunosuppresseur est intensifié.
Ce type d’immunodépression iatrogène est bien plus forte que celle induite par le VIH ou les traitements proposés dans un contexte de maladie auto-immune.
En cas de diagnostic de carcinome de Merkel, il recommande le Pet scanner (sans imagerie cérébrale en l’absence de symptômes), puis l’exérèse avec au minium 1cm de marge (+/- ganglion sentinelle) suivie de radiothérapie.
En cas d’immunothérapie, Nakamura M. et al ont publié en 2022 dans J Dermatol l’intérêt de coupler 2 biomarqueurs prédictifs de réponse : notamment l’expression forte de PD-L1 et l’expression faible de G6PD (Glucose‐6‐phosphate déhydrogénase).
Intérêt des traitements systémiques dans les cancers cutanés des immunodéprimés
Par la suite, le Dr Claas Ulrich avait la lourde mission de discuter de l’intérêt des traitements systémiques dans les cancers cutanés des immunodéprimés. Comme discuté à l’EADO 2022, le traitement préventif par acitrétine semble unanimement plus efficace que le nicotinamide (résultats non significatifs) en préventif des kératoses actiniques et carcinomes épidermoïdes. La chimiothérapie par capécitabine peut aider dans des cas extrêmes (Breithaupt et al., JAAD case reports 2015).
En curatif des stades avancés, il a rapporté les résultats d’une étude rétrospective sur 39 cas de patients transplantés (cardiaques, hépatiques ou rénaux) traités par anti PD-1 et/ou ipilimumab au centre de cancérologie du MD Anderson. Les rejets d’organe ont concerné 41% des patients (15/39), 40% sous anti PD-1 et 36% sous ipilimumab. Les rejets étaient plus fréquents en cas de diminution simultanée du traitement immunosuppresseur pendant l’immunothérapie (50% vs 32%). Mais des réponses ont également été rapportées dans 36% des mélanomes et 40% des carcinomes épidermoïdes.
Patients transplantés
Le Pr Kiarash Khosrotehrani a quant à lui partagé son expérience de création d’une « clinique » dédiée aux patients transplantés, permettant un circuit rapide de diagnostic clinique, dermoscopique et de chirurgie dans la foulée. Pour les kératoses actiniques, en plus de l’acitrétine, il a souligné l’intérêt de la cryothérapie (lésions isolées) et du 5-FU topique (lésions multiples), ainsi que l’adaptation du traitement immunosuppresseur avec du sirolimus/everolimus (inhibiteurs de mTor) pour les patients ayant développé un carcinome épidermoïde de haut risque ou de multiples carcinomes cutanés épidermoïdes (d’après le consensus d’experts recueilli par méthode Delphi, Massey et al., JAMA Derm 2021).
Les inhibiteurs de mTor oraux étant relativement mal tolérés, il a démontré l’intérêt du sirolimus topique 1% dans le cadre de son essai clinique randomisé en double aveugle vs placebo, sur 30 patients, 12 semaines, pour réduire l’incidence des carcinomes intraépidermiques et des kératoses actiniques.
Orateurs : Dr Susana Puig, Dr Cristian Navarrete-Dechent
Article rédigé par Pr Lise BOUSSEMART
Caractéristiques des mélanomes selon le phototype des patients
Le Dr Susana Puig a parlé plus spécifiquement des caractéristiques des mélanomes selon le phototype des patients. Par exemple, chez les patients de phototype 1, homozygotes pour les variants roux du gène MC1R, la clinique est moins contributive : les mélanomes étant souvent rosés, le signe du « vilain petit canard » est moins efficace. Bien que l’on distingue en dermoscopie des vaisseaux en points ou en virgules, un suivi par microscopie confocale apparaît particulièrement judicieux : sa sensibilité n’est pas altérée par la couleur des lésions.
Microscopie confocale pré-opératoire dans le mélanome de Dubreuilh
Le Dr Cristian Navarrete-Dechent recommande lui aussi chaudement l’usage de la microscopie confocale pré-opératoire dans le mélanome de Dubreuilh (primitif ou récidivant).
Coupler la photographie corps entier au suivi par dermoscopie digitale
Le Dr Gabriel Salerni a parlé de l’intérêt de coupler la photographie corps entier (« total body photography ») au suivi par dermoscopie digitale chez les patients particulièrement à risque de mélanome. Cela réduit le nombre d’exérèses inutiles et permet l’exérèse de mélanomes plus fins.
Orateurs : Pr Richard Scolyer, Pr Boris Bastian, Dr Gabriel Casas
Article rédigé par Pr Lise BOUSSEMART
Surveillance recommandée dans le contexte de mutation germinale de BAP1
Le Pr Richard Scolyer a précisé la surveillance recommandée dans le contexte de mutation germinale de BAP1 : ophtalmologique (mélanome uvéal ?), radiologique (mésothéliome ?), surveillance dermatologique+dermoscopique tous les 6 à 12 mois à partir de 18 ans (mélanomes ?), echographie rénale (carcinomes rénaux ?) (consensus interdisciplinaire de Star P et al., Eur J Cancer 2018).
Il a parlé du piège du mélanome naevoïde, autrement appelé le mélanome de l’avocat (lawyer’s melanoma), car souvent à l’origine de procès. Il survient à tout âge, homme ou femme, tout site, mimant un naevus car bien circonscrit mais asymétrique, à pigmentation variable, avec papilles rembourrées (« puffy shirt sign »). La présence de mitoses, ainsi qu’une FISH et/ou CGH, peuvent aider au diagnostic.
Intérêt de la biologie moléculaire dans le mélanome
Le Pr Boris Bastian a enfin énuméré l’intérêt de la biologie moléculaire (séquençage haut début, FISH, CGH) dans le mélanome, non seulement à visée théranostique (accès aux thérapies ciblées) mais aussi à visée diagnostique.
Histologie des carcinomes épidermoides à haut risque de récidive
Pour finir, le Dr Gabriel Casas a cloturé cette deuxième journée sur l’histologie des carcinomes épidermoides à haut risque de récidive, comme ceux des lèvres, tempes ou oreilles.
Un Breslow <2mm annonce un bon pronostic sans métastases, mais un Breslow >5mm donne lieu à des métastases chez 20% des patients.
Il milite pour intégrer l’envahissement lymphovasculaire et la « satellitose » / présence de métastases en transit dans la classification AJCC actuelle.
Et voilà, c’est tout pour la 2e journée de congrès. Je vous retrouve demain pour la suite !
Orateurs : Pr Soyer
Article rédigé par Pr Lise BOUSSEMART
Le sujet le plus intéressant de la 3e journée du WCCS a été selon moi le partage d’expérience de la télésurveillance cutanée du Pr Peter SOYER, en Australie où le mélanome est le cancer le plus fréquent chez les 15-39 ans. Il s’y est en effet monté un réseau de télésurveillance de naevus dans le cadre de l’étude de cohorte « ACEMID » (Australian Centre of Excellence in Melanoma Imaging & Diagnosis), financée à hauteur de plusieurs millions de dollars.
Cette cohorte constitue à ce jour la plus grande banque d’images cutanée au monde, et y associe données génétiques, histologiques, dermoscopiques, le tout avec une approche d’intelligence artificielle.
Au-delà de l’intérêt scientifique et médical, ce réseau aide à rétablir l’équité d’accès à l’expertise dermatologique sur le territoire australien.
Les patients sont inclus dans cette cohorte avec un suivi personnalisé à leurs antécédents et exposition solaire passée ; associant à fréquence variable, photographie corps entier 3D (par assemblage de 92 photos prises sous une multitude d’angles), et dermoscopie. Les patients sont invités à répondre à des questionnaires de qualité de vie, acceptabilité, et protection solaire.
D’après le Pr Soyer, du fait de la complexité technologique associée à ce type de suivi, un nouveau métier technique devrait bientôt voir le jour : « manipulateur data dermato » un peu sur le modèle des manipulateurs exerçant déjà en radiologie ou médecine nucléaire.
Orateurs : Dr Emilia COHEN SABBAN, Pr Rolf Markus SZEIMIES, Pr Raul CABRERA, Dr Maria Ivonne Arellano Mendoza
Article rédigé par Pr Lise BOUSSEMART
Une session était également dédiée à la prise en charge des champs de cancérisation cutanée, survenant volontiers sur le cuir chevelu des hommes de plus de 70 ans, à forte exposition solaire passée.
Kératoses actiniques
Le Dr Emilia COHEN SABBAN a rappelé que bien que 25% des kératoses actiniques disparaissent spontanément, il s’agit de formes extrêmement précoces de carcinomes épidermoïdes (CE) in situ selon J Röwert Hubern, Br J Dermatol 2007.
Sur le plan génétique, les kératoses actiniques présentent en effet les mêmes mutations oncogéniques que les CE vers lesquels 0,1% à 20% d’entre elles évoluent (gène TP53 entre autres). A l’inverse, 80% des CE cutanés dérivent d’une kératose actinique.
Dans le contexte de champ de cancérisation, la cryothérapie a l’inconvénient de traiter très localement, et d’engendrer des cicatrices dépigmentées. Il est donc préférable de privilégier les traitements plus larges tels que le 5FU, l’imiquimod, la photothérapie dynamique (PDT), +/- calcipotriol.
Certains combinent ces traitements, ainsi le Dr COHEN SABBAN propose régulièrement 10 jours d’application de 5FU avant la pratique de la MAL (methyl aminolevulinate) PDT.
Avantages de la PDT
Le Pr Rolf Markus SZEIMIES a rappelé les avantages de la PDT en lumière du jour naturelle voire artificielle pour s’affranchir des aléas de la météo et améliorer la satisfaction patient per traitement.
Evaluation de l’efficacité de ces topiques
Concernant l’évaluation de l’efficacité de ces topiques, le Pr Raul CABRERA a mis en garde contre le simple comptage des kératoses actiniques : la prise de photos plus fiable pour faire la part entre un échec de traitement et une réponse accompagnée d’apparition de nouvelles lésions voisines.
Récemment, Brian CHENG et al., JAAD 2022, ont démontré en rétrospectif, la supériorité du 5FU et de l’imiquimod, par rapport à la PDT par ALA (acide 5-aminolevulinique) pour limiter l’incidence de CE invasifs dans l’année suivant le traitement de kératoses actiniques. Il n’y avait pas de différence significative entre 5FU et imiquimod. Les auteurs concluent que les essais cliniques devraient inclure dans leurs comme critères d’évaluation l’apparition ultérieure de CE en plus de la simple réponse clinique des KA traitées (elle-même à homogénéiser par score « AKASI » = actinic keratosis area and severity index).
Patients transplantés
Chez les patients transplantés également, le Dr Maria Ivonne Arellano Mendoza a particulièrement recommandé, sur les champs de cancérisation, l’usage du 5FU topique (Zeeshaan-Ul HASAN et al., BJD 2022).
Orateurs : Dr Monica NOGUERA, Dr Jade CURY-MARTINS, Pr Reinhard DUMMMER
Article rédigé par Pr Lise BOUSSEMART
C’est ensuite le sujet des toxicités cutanées des nouveaux traitements anti-cancéreux qui a été abordé par les Dr Monica NOGUERA, Dr Jade CURY-MARTINS et Pr Reinhard DUMMMER. Celles-ci sont fréquentes et affectent souvent la qualité de vie des patients. Heureusement, elles peuvent être annonciatrices d’efficacité du traitement (exemple des toxicités des anti EGFR).
Dans le contexte de l’immunothérapie en particulier, se pose la question de l’impact délétère d’une corticothérapie forte dose (60mg/j ou plus) sur la survie des patients, notamment quand elle est instaurée dans les 8 premières semaines d’immunothérapie (Xue BAI et al., Clin Cancer Res 2021).
Il est intéressant de retenir qu’une toxicité cutanée immuno-induite ne récidive pas nécéssairement en cas de reprise de l’immunothérapie. Des avancées devraient porter prochainement sur l’intérêt des inhibiteurs de JAK topiques pour ces toxidermies immuno-induites, ainsi que sur la meilleure compréhension du rôle associé du microbiome digestif, et du contexte génétique du patient.
Toxicités cutanées rares
Dr Jade CURY-MARTINS a rapporté des toxicités cutanées rares telles que :
- un cas de lipoatrophie faciale induite par anti PD-1, symptomatique d’une panniculite lymphoplasmocytique et améliorée par lipofilling.
- un cas de botriomycomes (=granulomes pyogéniques) eruptifs observés sous encorafenib+anti EGFR, secondaires à l’activation paradoxale de la voie des MAP kinases sous inhibiteurs de BRAF V600, dans les cellules BRAF sauvages, telle qu’explicitée par le Pr Reinhard Dummer.
- un cas de prurit grade 3, avec hyper IgE>2000, sous inhibiteur de TIGIT « vibostolimab » +/- pembrolizumab dans le cadre de l’essai de phase I (J. Niu et al., Annals of Oncology 2022).
La biopsie aurait révélé une dermatite périvasculaire avec éosinophiles, et immunofluorescence négative. Le prurit était si insupportable que le patient a été sorti de l’étude et traité par omalizumab 300mg en sous cutané, avec régression rapide et complète du prurit : difficile d’affirmer si cette amélioration était plus liée à l’arrêt ou à l’omalizumab. Ce traitement avait été proposé d’après la publication de DM Barrios et al, Annals of Oncology 2021, montrant 82% de réponses à l’omalizumab dans les prurits rebelles induits par immunothérapie ou anti HER2).
De nouvelles thérapies ciblées prescrites notamment dans les cancers de vessie donnent de nouvelles toxicités cutanées :
- l’erdafitinib, inhibiteur de FGFR1-4, est pourvoyeur de calcinoses cutanées, calciphylaxies, paronychies et onycholyses après 1-2 mois de traitement (ME Lacouture et al., The Oncologist 2021).
- l’enfortumab vedotin (Padcev*), anti nectine 4 couplé à un inhibiteur de microtubules, donne 55% de toxidermies, dès la 2e semaine de traitement, dont 13% de grades 3-4, ainsi que des SDRIFE (symmetrical drug related intertriginous and flexural exanthema) (ME Lacouture et al., The Oncologist 2022).
Orateurs : Pr Henry Lim, Pr Sergio SCHALKA
Article rédigé par Pr Lise BOUSSEMART
Sur le sujet de la photoprotection, le Pr Henry Lim a démontré l’association entre application régulière de crème solaire ou hydratante et alopécie frontale fibrosante (risque augmenté de 45% pour la crème solaire vs 26% pour la crème hydratante pour le visage) dans sa revue systémique et méta-analyse qu’il a publiée cette année, J Maghfour et al., JAAD 2022. Le lien de cause à effet n’est cependant pas établi.
Il a aussi mentionné une étude sur 3418 adultes ayant permis de montrer qu’une photoprotection attentive n’a pas d’impact délétère sur le risque supposé d’ostéoporose/fracture. Au contraire, les personnes se protégeant beaucoup du soleil auraient tendance à avoir moins de fractures, mais probablement plus en lien avec une prudence exacerbée (M Afarideh et al, JAMA Dermatol 2021).
Enfin, lui et le Pr Sergio SCHALKA ont expliqué comment les crèmes solaires teintées (à l’oxyde de fer) ont l’avantage de protéger aussi de la lumière visible haute énergie (bleue/violette, 400-500nm de longueur d’onde), elle aussi pourvoyeuse de pigmentation post inflammatoire et melasma. En effet, les protéines photoréceptrices « opsines » existent dans les yeux comme à la surface des kératinocytes et mélanocytes.
L’opsine 3 est présente en particulier sur les mélanocytes des personnes de phototype 3 à 6. C’est donc pour ces phototypes plus foncés que la protection contre la lumière visible est surtout utile.
Malgré l’apparition de 3 nouveaux filtres à UV tels que le MCE, le BDBP et le TRIASORB, Uli Osterwalder, chimiste spécialisé dans la photoprotection solaire, a rappelé que rien de vaut la protection textile.
Orateurs : Dr Mariana ARIAS
Article rédigé par Pr Lise BOUSSEMART
Concernant les lymphomes cutanés, le Dr Mariana ARIAS a parlé des lymphomes cutanés primitifs anaplasiques à grandes cellules, qui touchent 1,45 hommes pour 1 femme (âge médian 59 ans au diagnostic), et qui sont souvent associés à d’autres ATCD de cancers.
Se présentant souvent sous forme de nodule ulcéré, parfois spontanément régressif (10-40%), leur pronostic est plutôt bon.
Cependant, 10% d’entre eux présentent un envahissement ganglionnaire locorégional et 20% évoluent sur un mode multifocal. Sur le plan histologique, ils sont CD30+>75%.
Un bilan clinique, biologique et radiologique par Pet scanner est recommandé (+/- biopsie médullaire selon les cas).
Le traitement associe chirurgie et radiothérapie ou radiothérapie seule si lésion unique, voire du brentuximab en cas d’évolution multifocale. Un suivi à long terme est recommandé.
Il a aussi été rappelé que les mycosis fongoïdes de sous-type pilotrope (ou folliculaire) peuvent être soit indolents (sous forme de plaques, papules folliculaires, acnéiformes, kératose pilaire, avec prurit et mucinose folliculaire), soit agressifs (sous forme nodulaire, tumorale, voire érythrodermique, avec >25% de cellules atypiques dans le derme, >10% de cellules ki67+, >10% de blastes, avec épidermotropisme interfolliculaire, présence d’éosinophiles et plasmocytes dans le derme, à un âge
>60ans, ou en l’absence de réponse complète). Le traitement relève d’une concertation pluridisciplinaire.
Et voici, sur le fond, j’ai fini pour mon résumé de la 3e journée de congrès à Buenos Aires. D’un point de vue « forme », j’ai quand même une petite anecdote du congrès à vous raconter. Aujourd’hui, un orateur a dit en plein diaporama : « on ne doit pas comparer des essais cliniques entre eux, mais c’est comme avec ses ex petites amies, on ne doit pas les comparer mais tout le monde le fait, hahaha ! ». Au-delà du caractère assez malvenu de la comparaison, ce fut assez amusant de le voir se rendre compte qu’il faisait face à un public surtout féminin, sans aucun rire à sa blague ! Je pense qu’il se souviendra longtemps de ce grand moment de solitude. Je vous dis à demain pour la fin du spectacle !
Orateurs : Dr Josep Malvehy, Dr Allan Halpern, Dr Luis Mazzuoccolo
Article rédigé par Pr Lise BOUSSEMART
La dernière journée du WCCS a commencé par les avancées technologiques dans le diagnostic et le suivi des patients atteints de mélanome.
Futures applications des analyses de « GEP »
Le Dr Josep Malvehy a énuméré les futures applications des analyses de « GEP » (profil d’expression génique), mesurant la transcription différentielle d’une sélection d’ARNm. Ces profils GEP serviront de biomarqueurs de malignité, de pronostic (annonciateurs de récidive du mélanome) ou de prédiction de réponse aux traitements.
Une analyse GEP de 15 gènes est déjà d’actualité dans le mélanome uvéal pour évaluer le risque de métastases (idem pour le cancer du sein).
Sur la peau, les ARN peuvent même être recueillis par l’intermédiaire d’un simple autocollant appliqué sur une lésion suspecte, et dont l’analyse GEP aidera à préciser le degré de malignité. Cette pratique n’est pas approuvée par la FDA mais est déjà très en vogue aux US.
Pour intégrer ce type de tests GEP dans le parcours patient de façon sécurisée, des essais prospectifs sont nécessaires (comme dans l’essai de S Podlipnik, Cancers 2022, ou l’essai
« Nivomela » qui vise à tester l’intérêt du nivolumab en adjuvant en cas de mauvais pronostic annoncé par le test « Melagenix », T Amaral et al., EJC 2020).
Plus simples à appliquer, des signatures d’expression protéique en immunohistochimie sont aussi en cours de développement (R Reschke et al, Cancers, 2021).
Diagnostiquer le mélanome à l'ère numérique
Pour améliorer les diagnostics précoces à l’ère du numérique, le Dr Allan Halpern a loué l’intérêt d’un suivi en 2 étapes, aussi plébiscité par les australiens : photographie corps entier, associée au suivi dermoscopique prospectif. Il encourage à partager la quantité d’images ainsi générées avec la banque publique de photos de mélanomes ISIC, qui contribuera à améliorer les performances des algorithmes d’intelligence artificielle.
Applications d’auto-diagnostic grand public
Le Dr Luis Mazzuoccolo a critiqué la sensibilité et spécificité des applications d’auto-diagnostic grand public (telles que skinvision, miiskin, …), surestimées par rapport à des cas de vie réelle (nécessité de validation externe). La performance d’un algorithme d’intelligence artificielle repose en effet sur la similitude des données d’entrainement et des données testées, qui varient selon les populations, et même selon le type de smartphone prenant la photo (androïde vs iOS).
Orateurs : Pr Susana Puig
Article rédigé par Pr Lise BOUSSEMART
Le Pr Susana Puig a rappelé que les personnes les plus à risque de mélanome sont celles ayant des ATCD familiaux ou personnel(s) de mélanome, voire des mélanomes synchrones (1 chance sur 4 de développer un 3e mélanome ultérieurement), un syndrome des naevus dysplasiques, un phototype 2 voire 1, tous ces facteurs d’additionnant les uns aux autres.
D’après ses travaux de corrélation génotype-phénotype, les patients mutés CDKN2A (=20% des mélanomes familiaux) n’ont pas plus de naevus que les autres mais ceux-ci sont plus volontiers dysplasiques. A l’inverse, les patients porteurs d’une mutation de MITF présentent classiquement un très grand nombre de naevus, et ont tendance à développer des mélanomes nodulaires.
D’après elle, plusieurs antécédents de mélanomes spitzoïdes chez une même personne doit faire évoquer une mutation germinale de TERT ou POT1.
Orateurs : Dr Fernando STENGEL
Article rédigé par Pr Lise BOUSSEMART
Pour finir, sur le plan des nouveautés thérapeutiques, le Dr Fernando STENGEL a mentionné la tirbanibuline à 1% (Klisyri) : un nouvel inhibiteur de microtubules topique pour le traitement des kératoses actiniques. Cette pommade a l’avantage de s’appliquer uniquement 5 jours consécutifs. Mais son efficacité à long terme, en comparaison avec les autres topiques disponibles tels que le 5FU, reste à préciser.
Du côté des traitements systémiques des cancers cutanés avancés (mélanome, carcinome épidermoïde, carcinome de Merkel), tous les experts s’accordent à dire que la place de la chirurgie diminue progressivement au profit de l’immunothérapie néoadjuvante. En cas de métastases de mélanome inopérables mutées BRAFV600, les 2 essais cliniques récents SECOMBIT (phase 2) et DREAMseq (phase 3) ont montré la supériorité de la double immunothérapie ipilimumab+nivolumab plutôt que bithérapie ciblée en 1ere ligne (sauf en cas de métastases cérébrales symptomatiques, c’est l’exception).
Notons aussi que la FDA et l’EMA ont approuvé cette année l’association nivolumab + relatlimab (=anti LAG3) en première ligne de traitement systémique de mélanome. A noter qu’en Europe, cette nouvelle double immunothérapie, mieux tolérée qu’ipilimumab + nivolumab pour des taux de réponse similaires, sera restreinte aux cas de mélanome exprimant faiblement PD-L1.
Toutes les bonnes choses ont une fin, le congrès WCCS est maintenant terminé. J’espère avoir pu vous en faire profiter un peu et vous dis à bientôt pour la suite ! Encore un grand MERCI à Géraldine Fleury et Bioderma pour m’avoir offert l’opportunité de partager ce bel évènement avec vous.
Orateurs : Dr Tenorio, Dr Cuellar Barboza, Dr Etchichury, Dr Ferrario, Dr Torres, Dr Gomes Tarlé, Dr Terzian, Dr Uribe
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Présentation de cas cliniques
Lors de cette session, des spécialistes en chirurgie micrographique de Mohs ont été présentés. Ils ont parlé des difficultés de la chirurgie oncologique et reconstructive des différentes régions anatomiques du visage.
Maria Soledad Aluma Tenorio (Colombie)
Le Dr Tenorio a présenté plusieurs cas cliniques sur la chirurgie de Mohs et la reconstruction dans le tiers distal du nez (pointe nasale, aile narinaire, triangle mou de Converse, columelle). Dans cette région, même si le lambeau frontal médian est très fréquemment utilisé et accepté, il présente quelques inconvénients qui méritent d’être mentionnés : il ajoute une cicatrice sur le front qui est la zone de prélèvement de peau pour ce lambeau, il peut générer une déformation du sourcil, il requiert un long pédicule qui provoque un saignement majeur, il peut dégager une odeur due à l’accumulation de sang, voire altérer temporairement le champ visuel, il peut y avoir une perte du contour des sous- unités esthétiques, et il peut y avoir un transfert de duvet du front vers le nez. Par conséquent, il faut envisager des lambeaux alternatifs qui seront utiles pour réparer les défauts du tiers distal du nez, comme le lambeau nasogénien à pédicule supérieur. Souvent, si le défaut chirurgical implique la perte du support cartilagineux du nez, il est nécessaire de réaliser, en premier lieu, une greffe de cartilage (dont la zone donneuse pourrait être le cartilage auriculaire), puis de procéder à la greffe naso-labiale. Pour un meilleur résultat esthétique, il est souvent nécessaire de réaliser une seconde intervention chirurgicale (qui peut être réalisée trois semaines après la première intervention), dont le but est de terminer la mise en forme du lambeau et d’harmoniser l’anatomie de la région opérée. Lors de la reconstruction du triangle mou de Converse, il est important que la partie distale du lambeau
soit plus fine (afin que le bord libre du nez ne soit pas trop épaissi) et que la partie proximale du pédicule du lambeau soit plus épaisse pour assurer une irrigation optimale. Pour conclure, le Dr indique que le lambeau nasogénien constitue une bonne option pour reconstruire les défauts du tiers distal du nez.
Adrian Cuellar Barboza (Mexique)
Le Dr Cuellar Barboza expose le cas clinique d’une femme de 78 ans présentant un carcinome basocellulaire infiltrant ulcéré évoluant depuis 2 ans dans la paroi nasale et l’aile narinaire droites. La patiente a subi une chirurgie conventionnelle dont l’anatomie pathologique a rapporté des marges chirurgicales latérales compromises par la tumeur. Il a donc été décidé de réaliser une chirurgie de Mohs avec une résection complète de la cicatrice de la chirurgie précédente. L’intervention a nécessité 2 couches de Mohs pour obtenir des marges négatives, laissant un défaut chirurgical compromettant plusieurs sous-unités esthétiques du côté droit du nez : aile narinaire, pointe nasale et paroi nasale. Dans ce cas, il a été nécessaire de réaliser une greffe de cartilage prélevé au niveau de la conque auriculaire afin de structurer le lambeau postérieur et éviter le collapsus de la valve nasale (c’est-à-dire l’affaissement de la narine à l’inspiration). Un lambeau nasogénien à pédicule inférieur en deux temps a ensuite été réalisé. Lors du 2e temps chirurgical (réalisé à 3 semaines), le lambeau a été libéré et des points transfixiants ont été réalisés pour modeler le sillon alaire. Voici les conclusions de ce cas : il est nécessaire de réséquer la cicatrice complète en cas de récidive tumorale, d’éviter les défauts de l’aile narinaire tels que l’élévation nasale, l’effacement du sillon alaire ou les effets d’interruption dans la reconstruction des défauts de l’aile narinaire, et enfin, il est nécessaire de considérer le lambeau nasogénien à pédicule comme un bon outil pour les défauts de l’aile
narinaire.
Dardo Etchichury (Argentine)
Le Dr Etchichury a présenté le cas clinique d’un homme de 73 ans atteint d’un carcinome adénoïde basal ayant récidivé à 2 reprises après une chirurgie conventionnelle dans la région pré-auriculaire gauche. Ce patient a subi une chirurgie de Mohs. Après 3 étapes de Mohs, la marge profonde était toujours compromise par des cellules tumorales. Une parotidectomie superficielle a donc dû être réalisée. Le patient a régulièrement été suivi, et 4 ans plus tard, il a présenté une nouvelle récidive tumorale dans la zone de la cicatrice, dont la biopsie a révélé un carcinome basocellulaire métatypique. Il a été décidé d’instaurer un traitement par vismodégib aux doses habituelles. Il a reçu un traitement pendant 7 mois avec une réponse complète, avec comme effets indésirables des crampes sévères, une constipation modérée et une légère fatigue. À l’arrêt du vismodégib, il a été décidé de réaliser à nouveau une chirurgie de Mohs, qui a révélé à nouveau les restes d’un carcinome basocellulaire lobulé dans des régions de fibrose cicatricielle, avec des marges superficielles et profondes exemptes de lésions. La fermeture s’est faite avec une greffe de peau.
Pour conclure, le Dr insiste sur le fait qu’il est difficile de prendre en charge les patients présentant une récidive tumorale, indique les diverses possibilités thérapeutiques et souligne l’importance de la chirurgie après un traitement par vismodégib.
Damian Ferrario (Argentine)
Le Dr Ferrario a exposé le cas clinique d’un homme de 85 ans présentant un carcinome basocellulaire primitif sclérodermiforme et nodulaire de 5 cm, datant de 1 an. Il a été décidé de réaliser une chirurgie de Mohs en raison de facteurs de risque élevés. Il montre le marquage préalable de la marge chirurgicale à prendre avec la chirurgie de Mohs avant l’infiltration avec l’anesthésie locale, et montre la dissection antéro-postérieure de la première couche de Mohs afin de ne pas léser l’artère temporale superficielle. Il montre ensuite comment l’échantillon a été traité dans le laboratoire de Mohs, les contre-incisions nécessaires pour une bonne visualisation au microscope de toutes les marges chirurgicales en surface et en profondeur. Puis, il évoque les précautions à prendre lors du traitement de l’échantillon afin d’éviter les faux positifs dus à la chute de la marge
supérieure par manque de support de la pièce sur la lame. Trois étapes ont été nécessaires pour obtenir des marges négatives, et pour la fermeture, il a été décidé de fermer par granulation du lit en seconde intention avec des pansements humides avec gaze et vaseline et alginate de calcium. Pour conclure, le Dr souligne l’importance de l’anatomie et des plans de dissection afin de prélever des couches de Mohs correctes, la manipulation correcte de la pièce opératoire afin d’éviter les faux positifs, et souligne que la fermeture en seconde intention constitue une excellente option chez les patients présentant un champ de cancérisation important, avec des comorbidités chirurgicales élevées, mais qu’elle présente l’inconvénient d’un temps de cicatrisation long avec des soins à domicile importants de la plaie.
Veronica Paz Torres (Uruguay)
Le Dr Torres a exposé le cas clinique d’un homme de 85 ans présentant un carcinome épidermoïde infiltrant modérément différencié avec invasion périneurale dans le tiers externe de la paupière inférieure, de croissance rapide (progression inférieure à 1 mois). Une chirurgie de Mohs a été réalisée et a laissé un défaut chirurgical de pleine épaisseur impliquant plus de 50 % de la paupière inférieure. Pour la reconstruction, une greffe tarso-conjonctivale a été réalisée, ainsi qu’un lambeau d’avancement-rotation de Mustardé de la joue homolatérale. Les photos de suivi montrent un bon résultat esthétique et fonctionnel, sans récidive.
Roberto Gomes Tarlé (Brésil)
Le Dr Gomes Tarlé commence par évoquer les difficultés du débulking en vue d’une analyse histologique lors d’une chirurgie de Mohs dans une région de peau fine, en raison du risque d’atteinte de la marge profonde de la pièce opératoire, soit en perforant la marge profonde et en ayant trop peu de tissu pour l’analyse microscopique, soit en retirant par inadvertance du cartilage avec un risque de chondrite ou d’altérations anatomiques ou fonctionnelles. Comme alternative, il propose le pseudo- bulking, qui consiste à faire une coupe d’épaisseur partielle autour de la tumeur, sans atteindre la marge profonde et sans enlever complètement la tumeur, afin de faciliter la préparation de la pièce opératoire au laboratoire.

Luis Roberto Terzian (Brésil)
Le Dr Terzian a exposé le cas d’un homme de 86 ans présentant un carcinome basocellulaire de la paupière inférieure gauche. Une chirurgie de Mohs a été réalisée. Il a fallu 2 étapes pour obtenir des marges négatives. La chirurgie a laissé un défaut chirurgical de pleine épaisseur de 90 % de la paupière inférieure. Pour la reconstruction, un lambeau tarso-conjonctival de Hughes de la paupière supérieure a été réalisé, suivi d’un lambeau de transposition inférieur et latéral. Après 2 semaines, le pédicule tarsal a été coupé, avec d’excellents résultats esthétiques et fonctionnels. Il a ensuite présenté le cas clinique d’un homme de 43 ans atteint d’un carcinome basocellulaire micronodulaire.
Ce patient a subi une chirurgie conventionnelle, mais il s’avère que les marges profondes étaient compromises par la tumeur. Une chirurgie de Mohs a été réalisée en trois étapes pour obtenir des marges négatives laissant un défaut chirurgical de 3 cm, qui a été reconstruit avec un lambeau d’avancement de la joue, avec de bons résultats esthétiques et fonctionnels.
Pablo Uribe (Chili)
Le Dr Uribe a exposé le cas clinique d’un homme de 53 ans présentant un lentigo malin de 1 cm sur le front. Le lentigo malin a un taux de récidive élevé, une extension infraclinique et un upstaging, ce qui le rend difficile à traiter. Le Dr Uribe demande à l’auditoire comment nous traiterions ce patient selon notre pratique habituelle et il propose 5 options :
1. Élargissement standard avec une marge de 5 à 10 mm.
2. Chirurgie de Mohs avec congélation des coupes et immunohistochimie.
3. Excision par étapes avec coupes radiales verticales périphériques.
4. Excision par étapes selon la technique du spaghetti ou du carré.
5. Autre moyen.
Cette question a été posée à un groupe de 23 médecins chiliens spécialisés dans la chirurgie de Mohs. Voici leur réponse : 52,2 % choisiraient l’option 4, 26,1 % l’option 3 et 13 % l’option 1.
Le Dr Uribe explique un tableau comparatif de ces 4 techniques chirurgicales dans le cadre du lentigo malin.
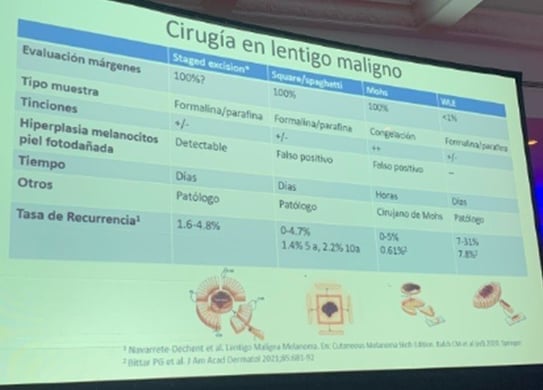
Pour conclure, le Dr évoque la grande variabilité des traitements chirurgicaux qui existent pour le lentigo malin, et explique que la technique d’excision par étapes avec des coupes verticales radiales périphériques permet de mieux analyser la progression du lentigo malin dans la marge et d’évaluer correctement la mélanocytose actinique pour la différencier de la tumeur, avec des résultats favorables.
Orateurs : Selma Schuartz Cernea
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Selma Schuartz Cernea (Brésil)
Lorsque l’on analyse la reconstruction de la région malaire, il faut tenir compte de l’anatomie du nerf facial, de la glande parotide et des 3 sous-unités esthétiques qui la composent : infra-orbitaire médiale, temporo-pré-auriculaire et oro-mandibulaire. Dans la région malaire, nous pouvons utiliser des fermetures directes, des lambeaux d’avancement, de rotation ou de transposition ou des greffes. Le Dr Schuartz Cernea expose plusieurs cas cliniques où, selon la taille du défaut chirurgical, sa localisation et l’expérience du chirurgien, un choix sera fait entre les différentes alternatives de fermeture, de la plus simple à la plus complexe.
Orateurs : Martin Devoto
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Martin Devoto (Argentine)
Le Dr Devoto explique comment les défauts des paupières supérieure et inférieure peuvent être fermés en fonction de leur taille. Un petit défaut impliquant moins de 33 % de la paupière peut être fermé par fermeture simple, en suturant d’abord le tarse des deux côtés avec des points résorbables, puis l’épithélium avec des points de matelassier verticaux pour éviter les marques. Pour les défauts impliquant 33 à 50 % de la paupière, un lambeau de glissement peut être réalisé, et pour les défauts impliquant 50 à 100 % de la paupière, un lambeau tarso-conjonctival de Hughes en 2 étapes est nécessaire. Pour la région canthale médiale, il existe plusieurs options : seconde intention, greffes, lambeaux ou combinaisons de ces options. Ce qu’il faut retenir ici, c’est que la peau interne du canthus est plus fine et la peau externe plus épaisse, et qu’il est important de respecter ces caractéristiques pour un résultat post-chirurgical optimal. Pour conclure, il mentionne que le plus important dans la région péri-oculaire est d’abord d’optimiser le taux de guérison du carcinome basocellulaire ou épidermoïde en réalisant une chirurgie de Mohs, puis de préserver la fonction et l’esthétique de la région.
Orateurs : Vieira
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Vieira (Portugal)
Les défauts nasaux peuvent être classés en fonction de :
1. Localisation : tiers distal, tiers moyen, tiers proximal, ou plusieurs tiers du nez.
2. Profondeur : atteinte de la peau uniquement, ou atteinte de toute l’épaisseur (peau et cartilage).
3. Taille : inférieure ou supérieure à 2 cm.
Le nez comporte plusieurs sous-unités esthétiques : le dorsum, la pointe, la paroi, l’aile et le triangle mou de Converse. Les résultats sont meilleurs si la cicatrice est cachée au niveau des limites des sous-unités esthétiques, et si la sous-unité entière est réparée.
Options de reconstruction pour les défauts inférieurs à 2 cm : lambeaux de peau du nez ou de la région périnasale comme région donneuse :
1. Transposition : unilobée, bilobée ou trilobée.
2. Avancement : d’est en ouest, en forme de croissant, en V-Y.
Options de reconstruction pour les défauts supérieurs à 2 cm : lambeau de transposition naso-labial, lambeau nasogénien et frontal médian à pédicule, ou greffe.
Quand une greffe de cartilage est-elle nécessaire ?
Quand un support structurel est nécessaire, et quand il y a des implications fonctionnelles et esthétiques. Elle est utilisée pour les petits défauts de pleine épaisseur dans le triangle mou du nez, l’aile narinaire, et pour les défauts plus importants dans la pointe ou la cloison nasale. Le cartilage de l’oreille est souvent utilisé comme site donneur.
Pour conclure, il faut indiquer que les lambeaux de transposition naso-labiaux, bilobés et trilobés sont très utiles dans cette région. Une greffe de cartilage est nécessaire pour les petits défauts de pleine épaisseur du triangle mou du nez et de l’aile narinaire. Le lambeau frontal médian constitue la meilleure option pour les défauts importants du nez.
Orateurs : Abel Gonzalez
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Abel Gonzalez (Argentine)
Les principes à prendre en compte dans la réparation des défauts chirurgicaux importants du visage sont les suivants :
1. Toujours prendre en compte les unités esthétiques lors de la reconstruction.
2. Essayer de remplacer la perte de tissu par des tissus ayant des caractéristiques similaires, en privilégiant les lambeaux locaux car ils sont davantage compatibles.
3. En général, le nombre d’étapes chirurgicales est lié au résultat, mais il faut tenir compte du rapport coût-bénéfice et des préférences du patient pour décider de cet aspect.
Orateurs : Boris Bastian
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Boris Bastian (États-Unis)
Parlons à présent des différents types de mélanome et de leurs principales caractéristiques.
Mélanome sur une peau exposée au soleil
En fonction du degré de dommages cumulatifs induits par les rayons ultraviolets (RUV), nous passerons d’une exposition au soleil moindre à une exposition plus importante :
1. Avec de faibles dommages cumulatifs causés par le soleil (dommages chroniques causés par le soleil, DCS) : mutation BRAF V600E, faible charge mutationnelle, avec un pic d’incidence à 50 ans.
2. Dommages cumulatifs causés par le soleil élevés (DCS) : mutation NRAS, NF1 KIT, BRAF V600K, charge mutationnelle élevée (des mutations secondaires conduisant au mélanome s’ajoutent), l’incidence augmente avec l'âge.
3. Mélanome desmoplastique : NF1, charge mutationnelle élevée, augmentation de l’incidence à un âge plus avancé.
L’élastose solaire augmente également avec l’accumulation des dommages chroniques causés par le soleil.
En analysant le nombre de mutations somatiques dans les différents cancers humains, nous observons que la charge mutationnelle, mesurée par le nombre de mutations par mégabase, est très élevée pour le mélanome, qui est l’un des cancers les plus courants.
Nous observons que le mélanome cutané sur une peau exposée au soleil avec des DCS élevés a une charge mutationnelle élevée, alors que le mélanome muqueux ou acral (non exposé au soleil) a une charge mutationnelle faible.
Mélanome sur une peau protégée
1. Mélanome acral : mutation NRAS, KIT, (BRAF V600E faible), augmentation de l’incidence avec l’âge, modèle très unique de réarrangement structurel génomique précoce.
2. Mélanome muqueux : mutation NRAS, KIT, augmentation de l’incidence avec l’âge, présente également un réarrangement structurel (BRAF V600E absente).
3. Mélanome uvéal : mutations dans la voie Gαq GNAQ, GNA11, très différent des autres mélanomes, a une charge mutationnelle faible, pas de preuve de réarrangement structurel, et augmentation de l’incidence avec l’âge.
Dans les mélanomes acral et muqueux, le réarrangement structurel est très complexe, avec des fusions entre chromosomes (par exemple, chromosomes 5 et 12) et des réarrangements intrachromosomiques.
Autres sous-types de mélanome
1. Mélanome sur nævus bleu : mutations Gαq GNAQ, GNA11, augmentation de l’incidence avec l’âge.
2. Mélanome sur nævus congénital : mutations NRAS (évolue probablement en mélanome par des mutations supplémentaires induites par les RUV).
3. Mélanome de Spitz : mutations HRAS et fusions avec BRAF, NTRK, ALK, RET, ROS, MET, MAP3K8, plus fréquent chez les jeunes et les enfants, évolution favorable par rapport aux autres mélanomes.
Caractéristiques communes au mélanome uvéal, au mélanome sur nævus bleu et au mélanome leptoméningé
Ils présentent des mutations primaires : GNAQ, GNA11, PLCB4, CYSLTR2, qui s’ajoutent ensuite à des mutations secondaires : BAP1, EIF1AX, SF3B1, pour aboutir à un mélanome. Ils ont en commun une prévalence plus élevée de métastases hépatiques.
Évolution génétique du mélanocytome
À partir d’un mélanocyte normal ----1re mutation : naevus 2e mutation : mélanocytome (tumeur
intermédiaire) 3e mutation : mélanome
Mélanocytomes selon l’OMS
1. À pénétration profonde : voie de la MAP kinase + BRAF
2. BAP1 inactivé : voie de la MAP kinase + perte de BAP1
3. Épithélioma pigmenté : voie de la MAP kinase + voie de la PKA
Différences au niveau de la classification de l’OMS des mélanomes
3e édition
mélanome superficiel extensif mélanome nodulaire mélanome sur naevus mélanome persistant mélanome de l’enfant
4e édition
mélanome avec DCS faibles mélanome avec DCS élevés pas de mélanome sur naevus pas de mélanome persistant mélanome de Spitz
Orateurs : Dr Renato Marchiori Bakos, Dr Joao Duprat, Dr Flavio Cavarsan
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Cas de dermoscopie au Brésil
Dr Renato Marchiori Bakos
Nous présentons un patient au phototype IV, présentant une lésion cliniquement ulcérée qui montre à la dermoscopie une pigmentation périphérique en forme de pseudopodes (qui peuvent également être interprétés comme des feuilles d’érable), induisant comme diagnostics différentiels un mélanome ou un carcinome basocellulaire (CBC). La biopsie confirme le CBC. Ce cas porte le message selon lequel les personnes à la peau foncée peuvent présenter des schémas particuliers dont il faut tenir compte.
Le deuxième cas est un patient qui présente une lésion tumorale nodulaire pigmentée. Les diagnostics différentiels sont un mélanome ou un carcinome spinocellulaire. La dermoscopie révèle des territoires vasculaires rouges laiteux et une ulcération avec foyer de pigments périfolliculaires. Le diagnostic histologique correspond à la combinaison d’un lentigo malin et d’un mélanome desmoplasique. Ce cas porte le message selon lequel il faut être attentif aux variantes atypiques du mélanome.
Le troisième cas concerne une lésion pigmentée que la dermoscopie voit compatible avec une kératose séborrhéique avec pseudo-ouvertures folliculaires associée à des taches pigmentaires en périphérie qui pourraient être compatibles avec une lésion mélanocitaire. La biopsie confirme la kératose séborrhéique.
Le quatrième cas est une lésion pigmentée apparue depuis 15 ans. Cliniquement, elle ressemble à un nævus avec une zone plus pigmentée, et la dermoscopie de cette zone présente un réseau et des globules pigmentaires. La biopsie confirme un mélanome de Breslow de 2 mm. Ce cas renvoie à une nouvelle structure dermoscopique à analyser, qui consiste en un îlot dermoscopique situé sur la lésion pigmentée.
Le cinquième cas est une lésion rosée pour laquelle la dermoscopie montre un polymorphisme vasculaire, avec des zones pigmentées et un réseau périphérique. Le résultat est un mélanome nævoïde. Ce cas porte le message selon lequel il faut tenir compte des variantes du mélanome. Le 6e cas est une lésion présentant à la dermoscopie une zone nodulaire pigmentée, avec un pigment granuleux en périphérie et des zones compatibles avec des pseudo-grains de milium. La biopsie confirme une kératose séborrhéique lichénoïde.
Le 7e cas est un patient transplanté présentant une lésion nodulaire érythémateuse apparue depuis 3 mois. La dermoscopie montre une zone ulcérée avec polymorphisme vasculaire et des territoires rouges laiteux. La biopsie confirme un cancer de la cellule de Merkel. Nous insistons sur l’enregistrement des caractéristiques AEIOU de ce carcinome, qui signifient A : asymptomatique, E : développement expansif, I : immunodépression, O : plus de 50 ans, U : rayons ultraviolets. Ce cas porte le message selon lequel il faut prêter attention aux imitations du mélanome.
Le 8e cas est une lésion pigmentaire sur le pied apparue depuis 3 mois. La dermoscopie montre des taches pigmentaires et des structures linéaires pigmentées, il s’agissait d’une tinea nigra. Ce cas porte le message selon lequel il faut recourir à la dermoscopie en dermatologie générale.
Recommandations de biopsie du ganglion sentinelle aux stades IIB et IIC
Dr Joao Duprat
La biopsie du ganglion sentinelle (BGS) au Brésil est recommandée pour :
- un mélanome de Breslow supérieur à 0,8 mm, ou ulcéré inférieur à 0,8 mm
- du stade IB à IIC
Les avantages à effectuer une BGS sont les suivants : le contrôle régional de la maladie, il s’agit d’une intervention chirurgicale simple, à faible risque avec peu d’effets secondaires, qui permet la stadification correcte du patient, et elle est déterminante dans l’indication d’un traitement adjuvant.
Mortalité en fonction de T : les courbes de survie de Kaplan Meier spécifiques au mélanome en fonction de T aux stades I et II, montrent un taux de survie à 5 et 10 ans à T3b plus faible qu’à T4a (86 % contre 90 % à 5 ans et 81 % contre 83 % à 10 ans)
Mortalité en fonction de N : les courbes de survie de Kaplan Meier spécifiques au mélanome en fonction de N montrent un taux de survie à 5 et 10 ans à N1b plus faible qu’à N1c (76 % contre 81 % à 5 ans et 71 % contre 75 % à 10 ans)
Selon la 8e édition de l’AJCC, les courbes de survie de Kaplan Meier spécifiques au mélanome conformément au stade donné, le taux de survie à 5 et 10 ans d’un patient au stade IIB (87 %/82 %) ou IIC (82 %/75 %) est plus faible qu’au stade IIIA (93 %/88 %) ou IIIB (83 %/77 %)
En comparant la 7e et la 8e éditions de l’AJCC, le taux de survie des patients au stade IIIA est plus élevé dans la 8e édition (93 %) que ce qu’il était dans la 7e édition (78 %)
Sommes-nous prêts à renoncer à la BGS ?
Selon l’étude de Morton, Donald L. et al de 2014, chez les patients atteints de mélanomes intermédiaires ou épais, ceux qui avaient réalisé une BGS avaient un taux de survie plus élevé que ceux du groupe d’observation, mais les patients atteints de mélanomes fins du groupe d’observation avaient un taux de survie supérieur à ceux du groupe ayant réalisé la BGS. Les résultats sont controversés.
Étude Keynote-716 : il s’agit d’une étude de phase 3 réalisée sur 1182 patients randomisés, en double aveugle, qui évalue le traitement adjuvant par pembrolizumab contre placebo dans les mélanomes de stades IIB ou IIC complètement réséqués, avec un suivi de 27 mois. Elle a montré des résultats favorables pour le pembrolizumab concernant le taux de survie sans récidive ni effets indésirables, mais avec un impact peu important.
Étude CheckMate 76K : traitement adjuvant par nivolumab contre placebo chez des patients atteints de mélanomes de stades IIB ou IIC complètement réséqués. Elle a montré pour tous les éléments évalués (survie sans récidive, survie globale, sécurité, qualité de vie, effets indésirables) un bénéfice avec nivolumab.
Pourquoi réaliser une BGS si le patient doit dans tous les cas suivre un traitement adjuvant ? Selon un article du Dr Sondak, si nous ne réalisons plus de BGS nous aurons plus de lymphadénectomies. En outre, tous les patients ne souhaitent pas ou ne peuvent pas prendre de traitement adjuvant (50 % aux États-Unis), et la BGS est très importante, car le taux de survie diminue considérablement chez les patients en stade IIIB ou IIIC.
En conclusion, je considère que la BGS est importante pour la stadification, le suivi des patients et il s’agit en outre d’une intervention chirurgicale sans complications ni comorbidités majeures.
Excision avec contrôle des marges histologiques chez des patients atteints de CBC au Brésil
Dr Flavio Cavarsan
On estime à 142 000 le nombre de nouveaux cas de CBC au Brésil en 2022.
La stadification à haut risque ou à faible risque du CBC est très importante pour définir l’approche thérapeutique. Selon le NCCN, le CBC est considéré comme à haut risque s’il répond au moins à l’un des critères cliniques ou histologiques suivants : localisation sur le tronc ou les membres, supérieur ou égal à 2 cm, sur la tête et le cou, les mains, les pieds, la zone anogénitale et la zone prétibiale de
toute taille, aux contours mal définis, récidive, immunodépression ou site de radiothérapie antérieure, sous-types histologiques sclérodermiforme, chordé, métatypique, micronodulaire, adénoïde. Le traitement de choix du CBC à haut risque est une intervention chirurgicale avec contrôle des marges comme la chirurgie de Mohs ou équivalent. Si une telle intervention est impossible, une excision large avec de grandes marges de sécurité peut être pratiquée. Le problème ici est que l’on ne connaît pas précisément la largeur des marges (on recommande 6 à 10 mm), car en chirurgie conventionnelle,
5 % des marges seulement sont analysés.
En conclusion, la définition du CBC à haut risque est bien représentée dans les directives du NCCN. Pour le traitement chirurgical du CBC à haut risque, il existe deux possibilités : la chirurgie de Mohs ou la chirurgie conventionnelle avec de grandes marges, avec une préférence pour la première.
Orateurs : Dr Rafael Aron Schmerling
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Il y a quelque temps, nous avons commencé à voir des médicaments qui améliorent l’OS et la qualité de vie des patients atteints de mélanome. La présentation de l’antigène est la base de l’immunothérapie. La cellule présentatrice de l’antigène présente l’antigène au lymphocyte T qui commence à lutter contre la tumeur, et c’est le même mécanisme d’action du renforcement de l’immunité qui génère la toxicité contre l’organisme lui-même. Tout tissu de l’organisme peut se voir attaqué si nous diminuons la tolérance immunitaire.
L’ipilimumab a été le premier médicament dont nous avons disposé et nous pouvons voir la toxicité sur la peau, le système digestif et endocrinien, une toxicité qui est plus élevée à des doses plus élevées.
Ensuite, avec les anti-PD1 et anti-PDL1, nous avons constaté moins de colites, plus de fatigue, plus de pneumonies et moins d’hypothyroïdies qu’avec l’ipilimumab.
Dans la cinétique des effets indésirables, les éruptions et le prurit sont les premiers à apparaître, suivis de la diarrhée et de la colite, puis de la toxicité hépatique et enfin de l’hypophysite.
Concernant la toxicité et l’efficacité, il semble exister une relation entre la survie globale et la toxicité, et une meilleure chance de survie a été observée chez des patients présentant une éruption et un vitiligo. Avec les anti-PD1, plus l’effet est grand, plus la toxicité est grande, et il existe aussi une relation avec le nombre d’événements et leur gravité. Si le patient a besoin de corticoïdes, ils peuvent être administrés sans compromettre l’efficacité du traitement.
Les inhibiteurs de BRAF et les inhibiteurs de MEK ont des profils de toxicité similaires. Dans leur cas, la toxicité n’est pas liée à l’efficacité, contrairement à l’immunothérapie, et ils peuvent avoir un effet indésirable qui consiste en l’allongement de l’intervalle QT.
Orateurs : Dr Ocampo Candiani, Dr Abel Gonzalez, Dr Monica Ramos, Dr Carlos Garcia Rementeria, Dr COHEN SABBAN, Emilia Noemí, Dr BAKOS, Renato
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Chirurgie de Mohs : sommes-nous limités ?
Dr Ocampo Candiani, Jorge
Récidives locales après une chirurgie micrographique de Mohs (CMM) Incidence de 2 %, 75 % des cas sont dus à des erreurs de technique.
Délai moyen de récidive de 38,5 mois, avec un taux de récidive de 20 % après 5 ans, plus particulièrement chez des patients ayant connu plusieurs récidives avant la CMM, et dans des localisations à haut risque comme l’oreille.
Dans quels cas la CMM est-elle indiquée sans pouvoir être pratiquée ?
Chez les patients présentant des troubles psychiatriques, peu coopératifs, très anxieux, lorsque la sédation ne fonctionne pas, ou qui présentent une arthropathie cervicale. Dans ce cas, nous devons rechercher d’autres options telles que la cryochirurgie, le curetage et l’électrodessication, ou la radiothérapie, toutes les options qui présentent des taux de guérison acceptables.
En conclusion, la CMM impose des limites telles que les tumeurs non résécables qui compromettent la glande parotide, l’os, la zone intranasale ou intraorbitaire, le conduit auditif externe, ou les patients psychiatriques.
Carcinome épidermoïde (CEC) non résécable, traitement systémique
Dr Abel Gonzalez
Le cas présenté est celui d’une femme de 37 ans souffrant d’un CEC récidivant sur la lèvre supérieure droite, ayant subi une chirurgie CMM en 2 étapes et qui présentait une invasion périneurale. La reconstruction a nécessité 3 lambeaux : lambeau d’avancement de la lèvre + lambeau d’Abbé + lambeau d’îlot. Neuf mois plus tard, un nouveau nodule controlatéral est apparu et les options thérapeutiques suivantes ont été envisagées : une intervention chirurgicale, qui a été écartée car jugée comme présentant trop de comorbidités, la radiothérapie, qui a été écartée car elle n’avait pas de visée curative et le patient était jeune, et l’immunothérapie, qui a été choisie comme option thérapeutique.
Parmi les traitements du CEC avancé par chimiothérapie figurent le cisplatine, le carboplatine, la bléomycine et le 5-fluorouracile. L’association de plusieurs régimes est plus efficace que les médicaments seuls. La FDA les a approuvés pour la tête et le cou. Le délai de réponse (qui est initialement très bon) est discutable après l’arrêt de la chimiothérapie.
Parmi les traitements du CEC avancé par thérapie ciblée et petites molécules inhibitrices, on trouve le cetuximab, l’erlotinib, le géfitinib, le panitumumab, nombre d’entre eux sont approuvés par la FDA pour la tête et le cou, mais pas pour un CEC avancé. La thérapie ciblée présente des taux de réponse plus faibles que la chimiothérapie, mais le délai de réponse et les effets indésirables sont meilleurs. L’effet indésirable le plus fréquent est l’éruption acnéiforme, qui peut suggérer un taux de survie sans progression.
Parmi les traitements du CEC avancé par immunothérapie, nous disposons du cemiplimab et du pembrolizumab, approuvés par la FDA pour le traitement du CEC avancé, 50 % des patients présentent une réponse partielle et pour 205 autres patients, la maladie reste stable. Plus de 60 % ont une réponse durable, pendant au moins 6 mois après le traitement. Les effets indésirables sont à médiation immunitaire et généralement bien tolérés, des corticoïdes peuvent être administrés si nécessaire.
Le néoadjuvant cemiplimab fait l’objet d’une étude pour les stades II à IV du CEC. Il a montré que 50 % des patients répondaient au traitement. Les cas comme celui présenté ici pourraient d’abord recevoir une immunothérapie néoadjuvante, et souvent ne nécessitent pas de chirurgie par la suite. Si une intervention chirurgicale devait être nécessaire, elle présenterait moins de comorbidités.
Mélanome dans les cabinets privés : notre expérience au Mexique
Dr Monica Ramos
En Amérique latine, nous sommes confrontés à plusieurs défis en matière de mélanome.
Défi 1 : la peau de la population hispanique va du blanc au foncé, avec des phototypes selon la classification de Fitzpatrick qui ne correspondent pas toujours à la population compte tenu de son hétérogénéité raciale et ethnique.
Défi 2 : les médecins recommandent moins souvent aux personnes de couleur d’appliquer de la crème solaire, 65 % de la population hispanique se perçoivent comme n’étant pas à risque de cancer
de la peau et ne considèrent pas nécessaire de se protéger du soleil.
Défi 3 : 5 % seulement des patients hispaniques indiquent avoir effectué un examen complet de la peau avec un médecin contre 49 % des patients à la peau blanche, les patients ayant la peau de couleur qui développent un mélanome sont plus susceptibles d’avoir des métastases, et l’accès aux soins de santé est très inégal.
En 2009, nous avons publié nos premiers cas de mélanome en cabinet privé et nous nous sommes demandé si le dermatologue pouvait faire la différence. Nous avons conclu que le dépistage pouvait faire la différence en augmentant la détection des mélanomes précoces.
Un autre article publié en 2015 dans la revue mexicaine de dermatologie portait sur une étude rétrospective de 13 ans, évaluant deux cliniques, l’une à Guadalajara et l’autre à Ajijic. Elles regroupaient 165 mélanomes, avec des caractéristiques différentes chez les hommes et les femmes. Les hommes viennent en consultation parce qu’ils sont envoyés par leurs épouses, qui observent quelque chose d’étrange, tandis que les femmes sont plus attentives et consultent plus tôt, donc les mélanomes chez les hommes ont tendance à avoir un indice de Breslow plus élevé que ceux des femmes. Et concernant les sites anatomiques, le mélanome acral est beaucoup plus fréquent en Amérique latine.
Les Américains et les Européens effectuent des dépistages, tandis que les Mexicains n’ont pas l’habitude d’en faire.
En conclusion, nos patients mexicains peuvent payer une médecine privée pour des consultations cliniques ou esthétiques. La plupart de nos patients ont été diagnostiqués à des stades précoces, sans différence entre les Mexicains et les non-Mexicains. Nous avons constaté un indice de Breslow plus faible lorsque les mélanomes avaient été diagnostiqués par dépistage.
Tumeurs épidermoïdes et risque de métastases
Dr Carlos Garcia Rementeria
Au cours de cette discussion, nous répondrons à 2 questions :
1- Comment poser le diagnostic de kératose actinique (KA) et de CEC 2- Comment prédire le risque de métastases ?
Quel est le risque de transformation ?
Nous connaissons la théorie sur les différentes voies de transformation de la KA en CEC in situ, puis en CEC invasif, depuis l’atypie qui engage la couche basale jusqu’à l’épaisseur totale, puis à l’invasion du derme par différentes voies, mais nous savons que l’invasion peut également se produire directement à partir d’une kératose actinique, sans étapes intermédiaires. Pour aider au diagnostic de ces 2 entités, nous disposons de la dermoscopie, de la microscopie confocale et de la tomographie par cohérence optique (OCT).
Dermoscopie KA : pseudo-réseau érythémateux, squames superficielles, vaisseaux ondulés, ouvertures folliculaires jaunes, globules avec des structures blanches.
Dermoscopie CEC : masse centrale de kératine, squames et croûtes, follicules targetoïdes, vaisseaux multiformes.
Microscopie confocale : il s’agit d’une technologie d’imagerie non invasive, qui permet de visualiser in vivo depuis l’épiderme jusqu’au derme papillaire. Sa résolution est comparable à celle de l’histologie. OCT : technologie non invasive qui utilise la lumière laser pour obtenir des images de la peau à plus de 2 mm de profondeur et qui permet de décrire les caractéristiques de la KA, du CEC in situ et du CBC.
Comment prédire le risque de métastases ?
Facteurs de risque élevés associés à une récidive locale et à des métastases du CEC d’après :
- Caractéristiques de la tumeur : dans la zone centro-faciale (yeux, nez, bouche), les oreilles, les tempes, la mâchoire, le menton, quelle que soit la taille de la tumeur. Dans les joues, le front, le cuir
chevelu, le cou : tumeur de plus de 1 cm, tumeur de plus de 2 cm, quelle que soit la localisation, aux contours mal définis, croissance rapide, symptômes neurologiques et récidive.
- Histologie : plus de 4 mm de profondeur, mal différencié, schéma agressif tel que suspect ou desmoplasique, invasion périneurale ou vasculaire.
- Facteurs liés à l’hôte : site de radiothérapie antérieure, immunodéprimé, site de plaies chroniques, prédisposition génétique telle que le xeroderma pigmentosum.
Toute caractéristique à haut risque est une indication pour une chirurgie de Mohs.
Nous disposons de 2 systèmes de stadification (AJCC 8e édition et Brigham and Women's Hospital) pour prédire les tumeurs à haut risque et les stadifier. Actuellement, la BGS n’est pas recommandée chez ces patients.
Carcinome à cellules de Merkel : un diagnostic difficile
Dr COHEN SABBAN, Emilia Noemí
Présentation d’un homme de 81 ans avec un nodule indolore, ferme et rouge sur la paupière inférieure gauche, de 1 cm de diamètre, apparue depuis 4 mois. Il montrait à la dermoscopie des zones rouges laiteuses, des lignes blanches brillantes, un polymorphisme vasculaire, avec une présomption de diagnostic de CBC, de mélanome amélanotique ou de Merkel. Le résultat de la biopsie était compatible par histologie et immunohistochimie avec un diagnostic de Merkel. Une BGS a été effectuée et s’est avérée négative. Stadification selon le dernier consensus de Merkel : Tis N0 M0.
Le carcinome à cellules de Merkel a été décrit en 1972 comme une tumeur neuroendocrine primaire rare de la peau, très agressive, avec une forte mortalité. Son incidence est en hausse et il existe
2 types de Merkel : celui qui affecte les zones de la peau exposées au soleil et celui lié au poliovirus qui représente 80 %. Les facteurs de risque de récidive locale sont : un âge avancé, le sexe masculin.
Le diagnostic est clinique + histologique par biopsie avec immunohistochimie, où le Ki67 est un marqueur de risque. Plus le Ki67 est élevé, plus l’index mitotique l’est aussi et plus la tumeur est indifférenciée. La BGS et les examens par imagerie sont essentiels pour la stadification. S’agissant d’une tumeur très agressive, le diagnostic est souvent tardif avec métastases.
Le traitement consiste en une exérèse large pour une maladie localisée, et l’indication d’une radiothérapie adjuvante est controversée mais suggérée.
Dermoscopie pour les types de peau foncés
Dr BAKOS, Renato
La plupart des nævus sur peaux foncées présentent un patron réticulaire homogène, uniformément réparti, de couleur marron foncé à noir. Ils constituent un défi pour le diagnostic différentiel avec le mélanome. Les phototypes 5 et 6 de Fitzpatrick présentent moins de nævus, et sont plus fréquents sur le visage et les zones acrales, avec un patron réticulaire et très pigmenté.
Dans la population latino-américaine, le patron du nævus acral est généralement parallèle fibrillaire et plus foncé.
Concernant le mélanome sur peaux foncées, ils apparaissent davantage chez les patients âgés. Il est plus fréquent chez les femmes, plus souvent invasif, situé sur les membres inférieurs (probablement la zone acrale).
Les altérations des ongles de type mélanonychie sont très fréquentes sur les peaux foncées, et les ménopamomes unguéaux présentent généralement un signe de Hutchinson.
Orateurs : Dr Chrysalyne D. SCHMULTS, Dr Vishal A. Patel, Dr Abel Gonzalez, Dr Ricardo Vieira
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Recommandations du NCCN pour la chirurgie de Mohs/PDEMA
Dr Chrysalyne D. SCHMULTS
La récidive du carcinome épidermoïde avec invasion périneurale avec la CMA (chirurgie avec analyse complète des marges) est de 10 % contre 23 % avec une excision standard.
Selon la plus grande cohorte de données de Cleveland et du BWH, le taux de guérison du carcinome épidermoïde à haut risque à 5 ans est 10 % plus élevé avec une chirurgie de Mohs (85 % avec une chirurgie de Mohs contre 75 % avec une chirurgie conventionnelle ; p = 0,04).
Les patients atteints d’un carcinome épidermoïde à haut risque meurent principalement de récidive et de métastases ganglionnaires locales.
Avec les courbes de Kaplan-Meier, nous pouvons voir que dans toutes les classifications (BWH, CCF), les résultats relatifs au risque de récidive locale sont meilleurs avec la chirurgie de Mohs qu’avec la chirurgie conventionnelle.
PDEMA (peripheral and deep en face margin assessment [analyse des marges périphériques et profondes de la face] : par exemple, technique de Mohs ou de Tübingen. Il s’agit du type de chirurgie privilégié pour le carcinome épidermoïde à haut risque ou à très haut risque selon le NCCN.
Selon le NCCN, les facteurs de risque très élevé de récidive locale et d’atteinte ganglionnaire (un seul facteur est nécessaire pour être considéré comme risque très élevé) sont :
- Facteurs cliniques : taille supérieure à 4 cm.
- Facteurs histologiques : peu différencié, sous-type desmoplastique, invasion profonde de plus de 6 mm ou invasion sous la graisse, cellules tumorales dans les gaines nerveuses d’un calibre supérieur ou égal à 0,1 mm ou sous le derme, invasion vasculaire ou lymphatique.
Pour conclure, le NCCN recommande la PDEMA/chirurgie de Mohs comme traitement de référence pour le carcinome épidermoïde à très haut risque, étant donné les chances maximales de contrôle de la maladie au niveau local et le taux de récidive locale plus faible, ce qui minimise le risque de décès.
Chirurgie de Mohs pour le mélanome et le carcinome à cellules de Merkel de la tête et du cou
Dr Vishal A. Patel
Voici les objectifs de cette discussion :
- Aborder les données relatives à l’utilisation de la chirurgie de Mohs dans la prise en charge du mélanome et du carcinome à cellules de Merkel.
- Discuter de l’utilité de l’analyse complète des marges dans la prise en charge des tumeurs à haut risque de la tête et du cou.
- Décrire une approche multidisciplinaire de la prise en charge du mélanome et du carcinome à cellules de Merkel de la tête et du cou.
Il me semble important de poser ces questions :
- Qu’est-ce que la chirurgie avec analyse complète des marges (CMA) ?
- Quelle est la différence entre la CMA et la chirurgie standard ?
- Quel est l’avantage de la CMA par rapport à la chirurgie standard ?
La chirurgie standard consiste à donner une fourchette de marges préétablies en fonction de la rapidité de croissance du mélanome, mais les marges peuvent être modifiées en fonction de l’anatomie de la région ou de considérations fonctionnelles.
À ce stade, il faut être clair sur les termes utilisés et leurs abréviations, qui prêtent souvent à confusion (CMA = CCPDMA = PDEMA). Tous ces termes désignent des techniques chirurgicales avec une analyse complète des marges. Ce terme descriptif peut s’appliquer à la technique de Mohs, à la technique de Tübingen en muffin ou en gâteau.
Les lignes directrices du NCCN sur le mélanome servent à définir les marges d’excision standard. On les utilise également dans des essais sur le mélanome du tronc, mais très peu sur le mélanome de la tête et du cou, et jamais sur le mélanome acral. Par conséquent, en fonction de la localisation, il est difficile de définir les marges.
Quelle est la meilleure technique chirurgicale pour l’analyse des marges ? Selon plusieurs études, les techniques qui effectuent une analyse complète de toutes les marges sont meilleures
(CMA = CCPDMA = PDEMA).
Selon le NCCN sur le carcinome à cellules de Merkel, si le patient présente une maladie localisée sans atteinte ganglionnaire et aucun autre facteur de risque, une chirurgie standard à large marge est suffisante, mais s’il existe d’autres facteurs de risque, la radiothérapie adjuvante est à privilégier. Si la radiothérapie adjuvante est planifiée à l’avance, des marges plus petites peuvent même être suffisantes et se révéler saines.
Plusieurs analyses rétrospectives ont été réalisées pour comparer les résultats de la chirurgie de Mohs à ceux obtenus avec l’excision standard avec de larges marges dans le traitement du carcinome à cellules de Merkel. La chirurgie de Mohs s’est avérée être la méthode la plus efficace pour la survie globale dans le carcinome à cellules de Merkel. L’évolution des patients atteints d’un carcinome à cellules de Merkel de la tête et du cou est meilleure avec la chirurgie de Mohs.
Pourquoi est-il nécessaire d’avoir une approche multidisciplinaire ?
Le mélanome et le carcinome à cellules de Merkel sont des maladies aux multiples facettes, qui nécessitent l’expertise de nombreuses sous-spécialités et un travail coordonné. Dans notre centre, nous planifions la chirurgie de Mohs et la biopsie des ganglions sentinelles (BGS) en même temps, et le patient peut rentrer chez lui le jour même.
Pour conclure, je suggère de commencer à harmoniser les noms des différentes techniques d’analyse complète des marges afin d’éviter toute confusion. Ce type de chirurgie est privilégié par rapport à l’excision standard. La BGS doit être réalisée en même temps que la chirurgie de contrôle des marges. Une planification complète doit être effectuée avant les interventions. Le mélanome et le carcinome à cellules de Merkel de la tête et du cou doivent être traités et pris en charge dans des centres de référence avec une approche multidisciplinaire.
Approche multidisciplinaire de la chirurgie de Mohs
Dr Abel Gonzalez
La chirurgie de Mohs constitue la meilleure option pour le traitement du cancer de la peau autre que le mélanome en raison de son analyse précise des marges chirurgicales. Dans certains cas, la chirurgie de Mohs ne peut être réalisée en ambulatoire sous anesthésie locale (comme c’est le cas pour la plupart des patients) et une anesthésie générale ou une sédation est nécessaire.
L’approche multidisciplinaire est indiquée lorsqu’il existe une atteinte des nerfs intracrâniens, une atteinte osseuse, une atteinte orbitaire ou une atteinte de la glande parotide, une atteinte vulvaire et péri-anale, ainsi que des reconstructions très complexes.
L’équipe multidisciplinaire peut inclure le chirurgien de Mohs, le chirurgien de la tête et du cou, le chirurgien plastique, le chirurgien crânio-facial ou le chirurgien oncologue. Pendant le traitement des
tissus en chirurgie de Mohs, le reste de l’équipe procède à l’élévation du lambeau, à la parotidectomie ou à la BGS, selon le cas, ce qui minimise la durée de l’anesthésie générale.
Chirurgie standard et chirurgie de Mohs dans le carcinome épidermoïde primitif
Dr Ricardo Vieira
Pour la chirurgie conventionnelle du carcinome épidermoïde, les lignes directrices européennes 2020 recommandent une fourchette de marges périphériques selon qu’il s’agit d’un carcinome épidermoïde à faible ou à haut risque pour assurer un taux de guérison de 95 %, soit 5 mm pour le carcinome épidermoïde à faible risque et 6 à 10 mm pour le carcinome épidermoïde à haut risque. Toutefois, les recommandations sont insuffisantes en ce qui concerne la profondeur de la marge qui peut inclure la graisse sous-cutanée ou la galéa aponévrotique sur le cuir chevelu. Le taux de récidive du carcinome épidermoïde invasif avec une chirurgie conventionnelle varie entre 4,4 et 7,5 %, et cela va de pair avec les facteurs de risque élevé du carcinome épidermoïde.
Les études prospectives comparant le taux de récidive avec la chirurgie de Mohs à celui avec la chirurgie conventionnelle pour le carcinome épidermoïde sont insuffisantes. Voici les données d’études rétrospectives dont nous disposons :
Chirurgie conventionnelle : Carcinome épidermoïde primitif : 5,7 % - Carcinome épidermoïde récurrent 17,3 %
Mohs : Carcinome épidermoïde primitif : 2,6 % - Carcinome épidermoïde récurrent 5,9 %
Les tissus congelés sont plus difficiles à interpréter que les tissus inclus en paraffine, avec des risques élevés de faux négatifs. Il existe des techniques d’immunohistochimie pour les tissus congelés, mais il n’est pas très facile d’y avoir accès.
Il n’existe pas de donnée évidente d’un bénéfice de la radiothérapie adjuvante dans le cas d’un carcinome épidermoïde complètement réséqué, mais elle peut être bénéfique en cas d’invasion périneurale et doit être envisagée.
Pour conclure, nous ne disposons pas de beaucoup de données sur le choix de la CMM (chirurgie micrographique de Mohs) dans le carcinome épidermoïde à faible risque, mais la CMM est pratiquement obligatoire dans le carcinome épidermoïde à haut risque, en particulier en cas d’invasion périneurale, car les données étayant sa supériorité sont convaincantes. Elle est également à privilégier dans le carcinome épidermoïde récurrent et dans les localisations anatomiques à risque pour une conservation maximale du tissu péritumoral sain.
Orateurs : Dr Rafael Aron Schmerling
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Dr Rafael Aron Schmerling
Le carcinome à cellules de Merkel est une maladie difficile de la personne âgée avec un pronostic qui n’est pas toujours favorable.
Habituellement, les maladies métastatiques sont traitées par chimiothérapie avec un taux de réponse de 55 %, ce qui est considéré comme un bon taux de réponse.
La charge mutationnelle de cette tumeur est très élevée et peut permettre d’évaluer la réponse à l’immunothérapie. Nous savons que plus il y a de mutations, plus le risque d’effets indésirables à médiation immunitaire est élevé. Il existe 2 causes au carcinome à cellules de Merkel : l’une due à l’accumulation de rayons UV, et l’autre liée au polyomavirus avec un profil moléculaire totalement différent et une charge tumorale plus faible, mais pour laquelle nous pouvons également utiliser
l’immunothérapie comme traitement parce que le système immunitaire reconnaît le virus à l’intérieur de la cellule affectée.
L’avélumab interfère avec l’activité des lymphocytes et entraîne la destruction de la tumeur. Nous constatons que la durée du bénéfice est beaucoup plus longue, et nous étudions les bénéfices à long terme pour justifier ce traitement. En oncologie, la grande difficulté est de savoir comment sélectionner les patients pour ce traitement. L’utilisation de biomarqueurs tels que PDL1 peut être utile, les patients PDL1+ bénéficient davantage de ce traitement que les patients PDL1-, bien que ces résultats ne soient pas statistiquement significatifs, ce qui peut être dû à la faible taille de l’échantillon. Le médicament est efficace chez les patients déjà traités et chez les patients non traités en première intention. Bien que ce traitement puisse entraîner une progression de la maladie, le patient reste en vie pendant une période prolongée et nous pouvons ajouter une chirurgie ou une radiothérapie en cas de progression.
Dans le cas du pembrolizumab en traitement de première intention, nous constatons une diminution de la tumeur, un bon taux de survie sans progression et une bonne SG. Le nivolumab est une autre option qui présente des données assez similaires chez les patients déjà traités. Et que faisons-nous avec les patients qui n’ont pas répondu au traitement anti-PD1 ? L’une des options consiste à combiner ipi + nivo.
Lorsque nous comparons l’arrêt du traitement et le maintien du traitement, nous constatons que chez 73 % des patients qui ont présenté une réponse complète la maladie n’a pas progressé pas à 5 ans contre 44 % des patients qui ont présenté une réponse partielle, et que si nous arrêtons le traitement pour cause de toxicité ou d’arrêt volontaire, le temps sans progression à 1 an est plus important chez ceux qui ont présenté une toxicité, puis s’inverse.
Association de médicaments IPI + NIVO comme traitement de sauvetage pour le carcinome à cellules de Merkel récurrent ou métastatique. Un groupe a reçu IPI + NIVO en première intention avec radiothérapie et l’autre groupe IPI + NIVO en première intention sans radiothérapie. Tous les patients ont obtenu une bonne réponse avec l’association IPI + NIVO, nous ne pouvons donc pas analyser le bénéfice isolé de l’ajout de la radiothérapie. Le carcinome à cellules de Merkel est une tumeur assez sensible aux radiations. Par conséquent, il est conseillé d’envisager l’association IPI + NIVO chez les patients atteints d’une maladie métastatique en première intention afin de ne pas perdre l’option d’une radiothérapie ultérieure.
Après la chirurgie, le nivolumab adjuvant doit être envisagé car le pronostic des patients atteints d’une maladie métastatique est mauvais, et on a observé que, par rapport à l’observation, le nivolumab adjuvant améliorait la survie sans maladie.
Orateurs : Dr Chrys Schmults
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Les objectifs de cette session sont d’utiliser des critères de stadification appropriés pour le carcinome épidermoïde, de comprendre comment une stadification correcte peut avoir un impact sur le pronostic du patient, et d’appliquer un traitement et un suivi appropriés en fonction du risque de récidive et de métastase ganglionnaire.
Étant donné que la plupart des cas de carcinome épidermoïde sont facilement guérissables, pourquoi avons-nous besoin d’une stadification pronostique ? Parce que certains carcinomes épidermoïdes sont exceptionnellement agressifs. Aux États-Unis, nous enregistrons 1,5 million de cas de carcinome épidermoïde par an, ce qui représente un nombre de cas trop important pour pouvoir les contrôler statistiquement et les étudier tous. Ces chiffres ne sont donc pas aussi bien connus que ceux du mélanome, mais nous savons qu’aux États-Unis, 1 à 4 % des patients présentent des métastases à la suite d’un carcinome épidermoïde et que 1 à 2 % des patients en meurent. Cela représente environ 15 000 décès par an dus au carcinome épidermoïde aux États-Unis, un chiffre probablement plus élevé que les décès dus au mélanome dans cette nouvelle ère de traitements par immunothérapie, où l’on estime à 7 300 le nombre de décès par an dus au mélanome.
Une stadification adéquate est nécessaire pour identifier ce petit groupe de patients atteints de carcinome épidermoïde à haut risque de récidive et de décès.
La 8e édition de l’AJCC élargit le T3 pour inclure les patients présentant un ou plusieurs de ces facteurs : 4 cm de diamètre, invasion en profondeur supérieure à 6 mm, invasion nerveuse d’un nerf de 0,1 mm de diamètre ou situé sous le derme, ou érosion osseuse superficielle. Le problème avec la 8e édition de l’AJCC est que les T2 et T3 présentent un risque similaire (bien que non équivalent) et représentent 25 % des patients atteints de carcinome épidermoïde. En revanche, le BWH (Brigham and Women’s Hospital) considère que les paramètres à haut risque sont les suivants : diamètre de
2 cm ou plus, invasion sous la graisse, faible différenciation, invasion périneurale d’un nerf d’un calibre supérieur ou égal à 0,1 mm. On considère que le risque est élevé lorsqu’il y a 2 à 3 facteurs (T2b) ou 4 facteurs ou une invasion osseuse (T3).
Le BWH est plus performant que l’AJCC pour la stadification du risque des patients atteints de carcinome épidermoïde, car les deux permettent de comptabiliser la majorité des patients à risque de métastase et de décès, mais selon l’AJCC, 18 % des patients sont considérés à haut risque et selon le BWH 9 %.
Le traitement chirurgical privilégié dans ces cas est la chirurgie avec contrôle complet des marges, comme la chirurgie de Mohs, la PDEMA (peripheral and deep en face margin assessment [analyse des marges périphériques et profondes de la face]), car elles donnent des taux de guérison plus élevés du carcinome épidermoïde, en particulier en cas d’invasion périneurale avec un risque de récidive de 10 % contre 23 % avec la chirurgie conventionnelle.
Selon le NCCN, les facteurs de risque très élevé de récidive et de métastase dans le carcinome épidermoïde sont les suivants :
- Facteurs cliniques : taille supérieure à 4 cm.
- Facteurs histologiques : peu différencié, sous-type desmoplastique, invasion profonde de plus de 6 mm ou invasion sous la graisse, cellules tumorales dans les gaines nerveuses d’un calibre supérieur ou égal à 0,1 mm ou sous le derme, invasion vasculaire ou lymphatique.
L’irradiation locale pour traiter une marge positive n’est pas fiable pour terminer de la rendre saine, essayant d’obtenir des marges saines avec des chirurgies de contrôle complet des marges.
Qu’en est-il des ganglions ? 30 % des cas T2b de la classification BWH ayant subi une BGS étaient positifs, mais le risque varie de 6 à 21 %. L’utilisation d’une méthode d’analyse complète des marges ne doit pas être sacrifiée au profit de la BGS car il n’existe aucune preuve tangible des bénéfices de cette dernière, contrairement à la chirurgie de Mohs, par exemple, pour laquelle il existe des données tangibles.
La radiothérapie adjuvante est envisagée lorsque nous ne sommes pas certains d’obtenir des marges négatives en raison d’une invasion périneurale, s’il s’agit d’un carcinome épidermoïde à récidives multiples, car elle améliore le contrôle local bien qu’elle n’ait pas d’impact sur le risque de métastases.
Pour conclure :
- La stadification de l’AJCC est compliquée car de nombreux cas sont reclassés vers un stade plus avancé de façon inappropriée.
- Le reclassement vers un stade plus avancé inapproprié est moins fréquent avec le BWH
- Utiliser l’échographie et la tomographie pour la stadification ganglionnaire initiale du carcinome épidermoïde et pour son suivi pendant 3 ans tous les 6 mois, dans les T2b et T3 du BWH.
- Envisager une radiothérapie adjuvante en fonction du risque de récidive et des comorbidités du patient.
Orateurs : Dr Martín Greco, Dr SCHMERLING, Rafael Aron
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Résultats à long terme des traitements standards
Dr Martín Greco
Dans cet exposé, nous aborderons la classification des mélanomes, l’évolution du traitement du mélanome au fil du temps, les résultats à long terme des inhibiteurs de points de contrôle immunologiques et de la thérapie ciblée, les producteurs de bonnes réponses et la qualité de vie à long terme des patients.
Les différents sous-types de mélanome auront une composition moléculaire et des mutations différentes, et c’est en ce sens que le traitement sera différent.
Dans une chronologie de l’évolution du traitement du mélanome MM et de l’approbation des différents médicaments contre le mélanome, nous constatons que dans les premiers traitements de chimiothérapie approuvés par des essais cliniques randomisés, la dacarbazine a montré un taux de survie globale de neuf mois.
Vient ensuite l’interleukine 2 (IL2) à fortes doses, qui a été testée sur 270 patients atteints de MM avec une bonne réponse, mais qui n’a pas fait l’objet d’une étude clinique. Elle a montré un taux de survie élevé chez 16 % des patients atteints de MM et peu de récidives chez les patients répondeurs à 2,5 ans (pratiquement guéris). La FDA l’a approuvée en 1998 pour le mélanome, elle présente une bonne réponse, mais une toxicité importante.
L’ipilimumab et le vemurafenib apparaissent en 2011.
Étude BRIM-3 de phase III : vemurafenib contre dacarbazine dans le mélanome. Survie globale (SG) à 4 ans : a montré une SG supérieure avec le vemurafenib et un degré de toxicité plus faible que l’IL2.
En 2013, apparaissent le dabrafenib et le trametinib en tant que monotraitements, puis en 2014 le dabrafenib en association avec le trametinib, le pembrolizumab et le nivolumab.
Essai Keynote-006 : SG et survie sans progression (PFS) à 5 ans (étendue ensuite à 7 ans - FU SMR2021) en comparant le pembrolizumab à l’ipilimumab, qui a montré une SG et une PFS considérablement supérieures avec le pembrolizumab.
Essai CheckMate-66 : nivolumab contre dacarbazina à 5 ans, qui a montré une SG et une PFS supérieures avec le nivolumab
MSKCC - Analyse rétrospective du traitement par pembrolizumab : diminution de la probabilité d’échec du traitement depuis le début du traitement par pembrolizumab.
La thérapie T-VEC intralésionnelle apparaît en 2015 : ipilimumab + nivolumab, ipilimumab comme adjuvant, et vemurafenib + cobimetinib.
Essai CheckMate 067 : nivolumab + ipilimumab contre nivolumab seul contre ipilimumab seul comme traitement de première ligne du mélanome. Critère d’évaluation primaire : SG et PFS. Les statistiques de cet essai n’étaient pas assez convaincantes. Suivi à long terme (7 ans) taux de réponse 58 % ipi + nivo, 45 % nivo, 19 % ipi. Survie spécifique au mélanome de 56 % avec ipi + nivo, 48 % avec nivo, 27 % avec ipi. Effets indésirables généralement de grade 3-4 : ipi + nivo 40 %, nivo 8 %, ipi 19 %.
Étude de phase 3 : inhibiteurs de BRAF + MEK dans le mélanome avancé non traité précédemment. Deux groupes de patients atteints d’un mélanome non résécable de stade IIIC/IV ont été analysés.
Critère d’évaluation principal : SG.
1er groupe : BRAF V600E/K de type sauvage avec 2 lignes de traitement, dabrafenib + trametinib pour la première, vemurafenib pour la seconde. L’association dabrafenib + trametinib a montré une meilleure SG (34 % à 5 ans).
2e groupe : mutation BRAF V600, 2 lignes de traitement vemurafenib + cobimetinib d’une part, vemurafebib + placebo d’autre part. A montré une meilleure SG avec vemurafenib + cobimetinib.
Chez les patients avec mutation de BRAF, on observe une grande différence entre ipi + nivo et nivo. Chez les patients atteints de BRAF de type sauvage, les courbes sont presque superposées et le taux de réponse est supérieur avec l’immunothérapie.
Le problème de l’association ipi + nivo réside dans sa toxicité élevée : 50 % des patients doivent arrêter le traitement au cours des 4 ou 5 premiers cycles de traitement.
La thérapie ciblée dabra + trame présente 7 % de réponse complète et 50 % de survie sans progression.
Le LDH est un autre facteur important pour le pronostic.
En 2018 apparaissent : encorafenib + binimetinib et dabrafenib + trametinib comme adjuvant. En 2019, pembrolizumab en adjuvant chez les patients présentant une atteinte ganglionnaire. En 2022, pembrolizumab en adjuvant chez les patients T3b et T4
En ce domaine moléculaire de données cliniques et de laboratoire limitées, le seul facteur prédictif de réponse est l’indice de Breslow, il n’y a rien de message moléculaire, les patients qui développent un vitiligo se portent mieux avec l’immunothérapie, la perte de PTEN peut être un motif de résistance aux inhibiteurs de BRAF.
En termes de qualité de vie des patients qui bénéficient d’une longue survie, cet essai néerlandais montre un impact économique sur le niveau de vie, car les patients doivent payer les traitements.
En conclusion, nous disposons à ce jour de données suffisantes du suivi des patients de 5 à 8 ans avec ces nouveaux traitements contre le mélanome. Nous pouvons dire que tous les traitements (immunothérapie, thérapie ciblée) donnent un taux de survie d’au moins 50 %. Nous devons donc comprendre la biologie sous-jacente aux 50 % de patients qui ne répondent pas à ces traitements. Grâce à ces données, nous espérons obtenir un traitement plus personnalisé.
Quelle est la meilleure façon de séquencer les traitements systémiques ?
Dr DUMMER, Reinhard
Selon le guide de pratique clinique de l’ESMO pour le diagnostic, le traitement et le suivi du mélanome cutané, les points à prendre en compte sont les symptômes, le sous-type de mélanome, l’âge, le LDH, la charge tumorale, l’atteinte des organes, la charge mutationnelle, l’infiltration des cellules T, le PD L1.
D’après l’essai DREAMseq, les patients présentant une mutation de BRAF et des métastases de mélanome ont été divisés en deux bras : un bras a reçu IPI + NIVO suivi de DABRA + TRAME face à la progression de la maladie (ce qui a montré un taux de survie global à deux ans de 72 %), et l’autre bras a reçu DABRA + TRAME suivi de IPI + NIVO face à la progression de la maladie (ce qui a montré un taux de survie global à deux ans de 52 %).
SECOMBIT est une étude ouverte de phase 2, randomisée, à trois bras pour des patients atteints de mélanome métastatique avec mutation de BRAF.
Bras 1 : encorafenib + binimetinib puis ipi + nivo, a montré un taux de survie sans progression à quatre ans de 29 %.
Bras 2 : ipilimumab + nivolumab puis enco + bini, a montré un taux de survie sans progression à quatre ans de 55 %.
Bras 3 : encorafenib + binimetinib, puis ipi + nivo, puis enco + bini (appelé SANDWICH), a montré un taux de survie sans progression à quatre ans de 54 %.
TRICOTEL : étude multicentrique ouverte de phase 2, à un seul bras pour des patients atteints de métastases cérébrales de mélanome avec ATEZOLIZUMAB, VEMURAFENIB, COBIMETINIB.
Options de traitement pour les patients présentant des métastases à distance P.D.1 résistantes. Pour les patients à faible risque présentant un LDH normal sans métastases hépatiques ou cérébrales IPI
+ NIVO. Pour les patients à haut risque avec mutation de BRAF, thérapie ciblée (DABRA + TRAME, ENCO + BINI). Pour les patients à haut risque avec mutation de BRAF et métastases cérébrales symptomatiques ATEZOLIZUMAB, VEMURAFENIB, COBIMETINIB.
En conclusion, nous disposons de nombreuses options thérapeutiques. L’IMMUNOTHÉRAPIE est privilégiée au stade IV comme traitement de première ligne. En cas de mutation de BRAF, il faut envisager un traitement en sandwich chez les patients à haut risque. Options chez les patients résistants à PD1 : IT combinée, en cas de mutation de BRAF : thérapie ciblée.
Traitements systémiques des sous-types rares (ou pas si rares) de mélanome
Dr SCHMERLING, Rafael Aron
Nous n’accordions pas d’importance au sous-type auparavant. Aujourd’hui, nous savons que les différents types de mélanome comportent différentes mutations et qu’ils présentent des profils de mutations différents.
Le mélanome cutané représente 90 à 95 % des mélanomes, il est induit par les rayons UV, il prédomine généralement sur les peaux claires et chez les patients âgés de 59 à 65 ans. Le mélanome uvéal présente des caractéristiques totalement différentes, il représente environ 5 % des mélanomes, il est rarement induit par les rayons ultraviolets (UV), provient à 90 % de la choroïde, prédomine chez les patients aux yeux clairs et affecte généralement le foie de manière secondaire. Le mélanome muqueux représente 1 % des cas, il est rarement induit par les rayons UV, est mal pronostiqué et affecte généralement les ganglions locorégionaux.
Le mélanome muqueux a un impact important sur la qualité de vie du patient en raison de sa localisation et de son traitement. Il touche généralement la population adulte, la zone vaginale ano- rectale ou sinusale, et présente un taux élevé de récidive locale. Le traitement est chirurgical et peut consister en une chirurgie conservatrice ou une chirurgie large associée à une radiothérapie. Le traitement chirurgical du mélanome muqueux permet un bon contrôle de la maladie localement, mais ce n’est pas le cas de la maladie systémique et de l’apparition de métastases, qui ne sont pas aussi bien contrôlées chez les patients atteints de mélanome muqueux. Le mélanome muqueux est moins
bien pronostiqué que le mélanome cutané et il est plus sensible à l’immunothérapie par ipilimumab + nivolumab par exemple, avec un taux de survie globale de 36 % à 5 ans avec ce traitement combiné, contre 17 % avec le nivo seul et 7 % avec l’ipi seul.
Le mélanome acral prédomine dans les populations d’Asie et d’Amérique centrale. Il a tendance à présenter une épaisseur de Breslow importante au moment du diagnostic, un taux élevé d’atteinte ganglionnaire et un retard important dans le diagnostic. Son taux de réponse est inférieur à celui du mélanome cutané, ET il répond mieux à l’association anti-PD1 + ipi.
Le mélanome desmoplasique affecte généralement les zones exposées au soleil, il présente un faible taux de métastases à distance, mais un taux élevé de récidive locale, la mutation typique de ce mélanome est la NF1. On observe un taux de réponse de 70 % avec le pembrolizumab. Nous choisissons le traitement en fonction des mutations qu’il présente. Dans 20 % des cas, le mélanome desmoplasique présente la mutation NTRK.
Nous devons faire attention, le pathologiste est déterminant et nous fournit des informations susceptibles de nous aider, il est donc très important de prélever un bon échantillon en vue d’une analyse histopathologique correcte.
Le traitement multidisciplinaire est fondamental chez ces patients atteints de mélanomes plus rares, car nous savons qu’un travail pluridisciplinaire nous permet d’obtenir de meilleurs résultats pour le patient.
Orateurs : SCOLYER, Richard A.
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Le rôle du pathologiste est crucial lorsqu’il s’agit de diagnostiquer un mélanome. En pratique, 5 % des diagnostics de mélanome changent après un nouvel examen histologique.
Certaines lésions peuvent présenter des caractéristiques limites qui combinent des caractéristiques de lésions bénignes et d’autres de lésions malignes. Il existe un surdiagnostic des lésions bénignes fines comme mélanome in situ. Mais avec des lésions plus profondes, le défi est encore plus grand, car la différence entre un naevus et un mélanome volumineux a des conséquences majeures sur la conduite à tenir et le pronostic du patient. Une prolifération mélanocytaire atypique peut aller d’un naevus dysplasique à un lentigo malin en passant par un mélanome in situ et une hyperplasie mélanocytaire.
Le diagnostic histologique est subjectif, il existe différentes interprétations et différents pathologistes peuvent avoir des opinions différentes sur ce qu’ils observent. Mais il existe des outils pour aider le pathologiste à poser le bon diagnostic : les antécédents cliniques de la lésion, il est très important de fournir des informations au pathologiste lorsque nous envoyons l’échantillon pour analyse, afin de distinguer s’il s’agit de nouvelles lésions ou de lésions préexistantes, de donner une description clinique, car il peut l’interpréter différemment en fonction des informations cliniques que nous fournissons. Une étude réalisée en Australie a montré que la moitié des échantillons envoyés pour analyse histologique ne comportaient aucune information utile pour le pathologiste dans la demande d’histopathologie. Les directives australiennes reconnaissent l’importance de la corrélation clinico- pathologique.
Une lésion préexistante peut présenter un changement de la zone de focalisation. Il est donc important que la biopsie (par punch par exemple) soit effectuée dans la zone la plus représentative de cette lésion.
Il faut travailler en collaboration avec le pathologiste pour communiquer facilement et partager les images cliniques. D’autres techniques peuvent aider au diagnostic histopathologique, mais elles ne sont pas toujours définitives. Les tumeurs « borderline » présentent à la fois des caractéristiques bénignes et malignes et si le pathologiste connaît ces caractéristiques, il a plus de chances de parvenir au bon diagnostic.
La pathogenèse moléculaire de ces lésions consiste en l’accumulation d’événements génétiques qui conduisent finalement à transformer une lésion bénigne, à un stade intermédiaire puis malin. L’OMS prend en compte ce paradigme de tumeurs intermédiaires et les appelle MÉLANOCYTOMES. Chacune de ces 9 voies définit une tumeur bénigne, « borderline » ou maligne.
La biopsie du ganglion sentinelle était utilisée lorsque le diagnostic de la tumeur intermédiaire n’était pas clair. Ainsi, si la biopsie du ganglion sentinelle était positive, nous étions sans aucun doute en présence d’un mélanome.
L’idée selon laquelle ces tumeurs intermédiaires peuvent former des métastases dans les ganglions lymphatiques, mais pas de façon systémique n’est pas raisonnable, et la BGS n’a donc pas les mêmes conséquences sur le pronostic que dans le cas du mélanome conventionnel. Dans ces mélanomes intermédiaires (ou plutôt ces lésions intermédiaires), la biopsie du ganglion sentinelle n’est pas recommandée. On recommande en revanche l’échographie pour le contrôle ganglionnaire.
Une approche pratique de la gestion de ces lésions intermédiaires serait la suivante :
1- Dans les lésions définitivement bénignes : exérèse complète, exérèse large, BGS non indiquées 2- Dans les lésions incertaines probablement bénignes : exérèse totale effectivement indiquée, mais exérèse large et BGS contestées
3- Dans les lésions définitivement incertaines : exérèse totale effectivement indiquée, mais exérèse large et BGS contestées
4- Dans les lésions incertaines probablement malignes : exérèse totale, exérèse large et BGS indiquées
5- Dans les lésions définitivement malignes : exérèse totale, exérèse large et BGS indiquées
En conclusion, le diagnostic pathologique est assez simple, mais dans certains cas, il peut être difficile de communiquer avec le médecin. Les informations cliniques sur la tumeur que nous envoyons pour analyse et les autres outils du pathologiste peuvent aider à préciser le diagnostic de ces 1000 tumeurs intermédiaires.
Orateurs : Dr SCHMERLING, Rafael Aron, Dr CINAT, Gabriela
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Thérapie ciblée et immunothérapie au stade III
Dr SCHMERLING, Rafael Aron
Selon la 8e édition de l’AJCC, la probabilité de survie des patients atteints d’un mélanome est de
95 % à 10 ans pour le stade I, de 84 % à 10 ans pour le stade II et de 69 % à 10 ans pour le stade III. En administrant de l’ipilimumab en adjuvant, on observe un pourcentage plus élevé de patients en vie à 8 ans par rapport au placebo, mais il présente un haut degré de toxicité. Nous faisons le même constat en administrant du pembrolizumab et du dabrafenib + trametinib (dans ce dernier cas, le bénéfice observé est plus important aux stades IIIB-C-D qu’au stade IIIA).
Si nous comparons le nivo et l’ipi, nous constatons une meilleure réponse avec le nivo.
En conclusion, le traitement adjuvant du mélanome de stade III est efficace. Le bénéfice est plus important que celui observé pour d’autres tumeurs. Le choix entre les inhibiteurs BRAF/MEK et anti- PD1 chez les patients avec mutation BRAF doit être individualisé en se basant principalement sur la toxicité. Le bénéfice au stade IIIA nécessite une discussion plus approfondie en termes de réduction du risque absolu.
Redéfinir les patients à haut risque : stade IIB/C
Dr CINAT, Gabriela
Selon la 8e édition de l’AJCC, le taux de survie à 5 ans au stade IIB est de 87 %, au stade IIC il est de 82 %, au stade IIIA de 93 % et au stade IIIB de 83 %.
Étude Keynote-716 : il s’agit d’une étude de phase 3 réalisée sur 1182 patients randomisés, en double aveugle, qui évalue le traitement adjuvant par pembrolizumab contre placebo dans les mélanomes de stades IIB ou IIC complètement réséqués, avec un suivi de 27 mois. Elle a montré des résultats favorables pour le pembrolizumab concernant le taux de survie sans récidive ni effet indésirable, mais avec un impact peu important.
Étude CheckMate 76K : traitement adjuvant par nivolumab contre placebo chez des patients atteints de mélanomes de stades IIB ou IIC complètement réséqués. Elle a montré pour tous les éléments évalués (survie sans récidive, survie globale, sécurité, qualité de vie, effets indésirables) un bénéfice avec nivolumab.
Les preuves défendent le traitement adjuvant. Il faut examiner le risque relatif et le risque absolu, en particulier dans certains sous-groupes. Nous devons tenir compte de l’histoire personnelle du patient, de la toxicité associée et de l’accès aux traitements. Malgré l’amélioration considérable de la survie des patients atteints d’un mélanome avancé, supérieure à 50 %, des patients meurent encore de cette maladie.
Les patients au stade IIB et IIC ont un moins bon pronostic que ceux qui sont au stade IIIA, l’AJCC doit s’améliorer.
Le traitement par anti-DP1 peut réduire le risque de récidive.
En ce qui concerne le traitement néoadjuvant, le traitement utilisé au stade IV est efficace aux stades II/III. Il faut effectuer une analyse bénéfices-risques approfondie. La stratégie d’utilisation d’un traitement néoadjuvant est efficace et il faut attendre sa mise en œuvre dans la pratique clinique quotidienne.
Orateurs : María Guillermina Ferraresso, Daniela HANSMAN, Michelle ROBERTS, David CASTILLO MOLINA, María Victoria MONTES, Emily Mira WARSHAUER, Romina MILLER ROVTAR
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Confinement dû à la COVID-19 et son impact sur le diagnostic du mélanome.
María Guillermina Ferraresso, Hôpital italien de Buenos Aires
Introduction et objectifs : En raison du confinement de la pandémie de COVID-19, certaines activités médicales prévues ont été reportées, tant par des directives nationales que par les patients qui avaient peur de se rendre dans les hôpitaux. Pour le mélanome, certaines caractéristiques histopathologiques telles que l’indice de Breslow, l’index mitotique et la présence d’une ulcération sont des facteurs importants qui déterminent le stade et le pronostic. Un retard de diagnostic peut entraîner une augmentation de la morbidité et de la mortalité. Nous avons donc voulu évaluer si les caractéristiques des mélanomes étaient modifiées suite au confinement préventif (PL) établi par le gouvernement national chez les patients traités à l’Hôpital italien de Buenos Aires. L’objectif était de
décrire les caractéristiques histologiques et cliniques des mélanomes diagnostiqués après la fin de la phase 1 du PL et de les comparer à ceux diagnostiqués avant le PL.
Matériel et méthodes : Une étude observationnelle rétrospective a été réalisée chez des patients ayant reçu un diagnostic de mélanome à l’Hôpital italien de Buenos Aires entre le 01/04/2019 et le 30/04/2022. Tous les patients présentant des résultats pathologiques de mélanome ont été inclus dans deux périodes : la période 1, entre le 04/12/2020 et le 30/04/2021, date à laquelle la phase 1 du PL s’est terminée et la période 2, entre le 04/01/2019 et le 19/03/ 2020, date à laquelle le PL a commencé. Nous avons comparé l’agressivité des tumeurs en fonction des caractéristiques histologiques : indice de Breslow, taille de la tumeur, index mitotique, ulcération, métastases ganglionnaires ou à distance.
Résultats : Au total, 273 patients atteints d’un mélanome ont été inclus, 114 correspondant à la période 1 avec un âge moyen de 67 ans, et 159 à la période 2 avec un âge moyen de 61 ans. Les sous-types histologiques de mélanome étaient respectivement en période 1 et 2 : in situ 42 % et
47 %, extension superficielle 26 % et 34 %, nodulaire 19 % et 13 %, mélanome lentigo malin 6 % et 2 %, acral-lentigineux 4 %.
L’épaisseur moyenne de Breslow était de 1,7 mm en période 1 et de 1,1 mm en période 2. Une ulcération a été observée dans 20 % des mélanomes au cours de la période 1 et dans 12 % au cours de la période 2. Le taux d’index mitotique était de 2/mm² pour la période 1 et de 0 pour la période 2. Des métastases des ganglions lymphatiques ont été observées dans 23 % des cas au cours de la période 1 et dans 16 % au cours de la période 2. Des métastases à distance ont été observées dans 7 % des cas au cours de la période 1 et dans 4 % au cours de la période 2.
Conclusion : Dans la présente étude, nous avons observé que les mélanomes diagnostiqués après le confinement présentaient un pourcentage plus élevé de sous-types invasifs par rapport à ceux diagnostiqués avant le confinement. Nous avons également constaté une épaisseur de Breslow plus élevée, un index mitotique plus élevé et un taux d’ulcération plus élevé. En outre, une fréquence plus élevée d’atteinte ganglionnaire et de métastases à distance a été observée après le confinement. Un diagnostic tardif a entraîné une augmentation des facteurs de pronostic négatifs pour le mélanome.
Lentigo malin extra-facial. Vingt-quatre cas. Caractéristiques dermoscopiques.
Daniela HANSMAN, Unité d’oncologie cutanée. Institut Alexander Fleming.
Introduction et objectifs : Le lentigo malin est généralement localisé sur le visage. Le lentigo malin extra-facial (LMEF), variante du lentigo malin, qui se développe sur une peau endommagée par le soleil ailleurs que sur le visage, est moins fréquent. Son diagnostic peut être difficile. Les caractéristiques dermoscopiques du LMEF ont été récemment décrites et tendent à détecter les mélanomes précoces. Le but de notre étude est de décrire les caractéristiques dermoscopiques du LMEF.
Matériel et méthodes : Les critères d’inclusion comprenaient un LMEF confirmé par biopsie avec imagerie dermoscopique. Vingt-quatre (24) lésions ont été trouvées chez 19 patients. Les patients ont été diagnostiqués et traités entre mars 2017 et juin 2022 à l’Unité d’oncologie cutanée, Institut Alexander Fleming, Buenos Aires, Argentine. Les données sur les paramètres suivants ont été consignées : sexe, âge, site et caractéristiques dermoscopiques.
Résultats : Sexe : masculin 11/19, âge moyen : 71,8 ans (fourchette : 54–80), site : tronc 12/24. Caractéristiques dermoscopiques : lignes angulaires 16/24 (66 %), zones bronzées périphériques sans structure 13/24 (54 %), granularité ou aspect de « grain de poivre » 7/24 (29 %), réseau pigmentaire atypique 7/24 (29 %), points agrégés 4 /24 (16 %), structures blanches brillantes 6/24 (25 %), voile bleu-blanc 4/24 (16 %), structures vasculaires 2/24 (8 %), cercle dans le cercle 1/24 (4 %), pas de motif 1/24 (4 %), hyperpigmentation périfolliculaire asymétrique 0/24 (0 %), réseau négatif 0/24 (0 %), critères de kératose séborrhéique 10/24 (41 %).
Conclusion : Les structures les plus fréquemment observées étaient des lignes angulaires et des zones bronzées périphériques sans structure. La dermoscopie permet un diagnostic précoce du LMEF et est utile dans le diagnostic différentiel des lésions pigmentées de la peau chroniquement endommagée par le soleil ailleurs que sur le visage.
Notez la différence entre le lentigo acral et le mélanome lentigineux acral
Michelle ROBERTS - Hôpital italien de Buenos Aires
Introduction et objectifs : Le mélanome lentigineux acral (MLA) représente moins de 5 % de tous les mélanomes. Cependant, il est fréquent de confondre le MLA avec les mélanomes se développant dans les sites acraux (mains, pieds et région unguéale). Nous avons souhaité étudier les mélanomes de ce site anatomique et leurs caractéristiques.
Matériel et méthodes : Une étude rétrospective a été conduite. Les dossiers médicaux électroniques de patients âgés de plus de 18 ans ayant reçu un diagnostic histopathologique de mélanome entre 2007 et 2016 ont été analysés. Les mélanomes situés sur les mains et les pieds ont été sélectionnés. Les mélanomes de stade 0 ont été exclus.
Résultats : Sur 530 mélanomes, 30 (5,6 %) étaient situés dans des sites acraux. 14, 10 et 6 tumeurs présentaient des résultats histopathologiques de mélanome nodulaire (MN), de mélanome à extension superficielle (MES) et de MLA, respectivement. La stadification a été décrite pour
23 tumeurs : 8 étaient au stade I au moment du diagnostic (7 MES et 1 MLA) ; 5 étaient au stade II (4 MN et 1 MLA) ; 4 étaient au stade III (3 MN et 1 MLA) et 6 étaient au stade IV (4 MN, 1 MES et 1 MLA).
Conclusion : La majorité de nos mélanomes acraux étaient des MN. Cela suggère que la topographie acrale peut ne pas correspondre à l’histopathologie.
Caractérisation des cancers de la peau mélanomes et autres que mélanome dans un centre dermatologique colombien, 2016-2020
David CASTILLO MOLINA - FUNINDERMA
Introduction et objectifs : Les cancers de la peau mélanomes et autres que mélanome sont les néoplasmes les plus courants. Notre objectif était de décrire les caractéristiques épidémiologiques d’un groupe de patients présentant un cancer de la peau mélanome ou autre que mélanome traités dans un centre dermatologique colombien.
Matériel et méthodes : Une étude observationnelle rétrospective a été menée dans un centre de dermatologie à Bogota, en Colombie. Nous avons caractérisé tous les cas de cancer de la peau traités dans l’établissement de janvier 2016 à janvier 2020. Nous avons analysé l’âge au moment du diagnostic, le sexe, la profession, le phototype, l’histotype, le site anatomique et le traitement. Nous avons utilisé des fréquences relatives et absolues pour décrire les patients. Les facteurs cliniques ont été comparés à l’aide du test du chi carré et du test t. L’analyse des données a été effectuée dans Microsoft Excel version 16.34 et SPSS26.
Résultats : sur 396 patients, 52,8 % (n = 209) étaient des femmes. L’âge moyen au moment du diagnostic était de 70,4 ans (ET ± 13,8). Les caractéristiques de la population étudiée sont présentées dans le Tableau 1. Le Tableau 2 présente une comparaison entre les patients atteints d’un mélanome et ceux ne présentant pas de mélanome. La fréquence des cas de mélanome était plus élevée chez les patients de phototype II (23,1 %) que chez ceux de phototype III (3,8 %) et de phototype IV (5,5 %) (p = 0,007). Le carcinome basocellulaire (CBC) nodulaire (n = 94), le sarcome à cellules claires (SCC) infiltrant (n = 49) et le lentigo malin (n = 38) étaient les sous-types histologiques les plus fréquents pour chaque variante de cancer de la peau.
Conclusion : Dans la population étudiée, le CBC est le plus fréquent, suivi du SCC et du mélanome, comme le rapporte la littérature. Nous avons également constaté que la fréquence des cas de mélanome était plus élevée chez les patients de phototype II que chez ceux de tout autre phototype.
D’autres études sont nécessaires pour donner la priorité aux politiques de santé directes et améliorer les procédures diagnostiques et thérapeutiques.
Mélanome chez un enfant présentant un nævus mélanocytaire congénital médian
María Victoria MONTES - Hôpital Universitaire Austral
Introduction : Les mélanomes malins chez l’enfant sont extrêmement rares, représentant 0,9 % des différents néoplasmes malins pédiatriques. Les nævus mélanocytaires congénitaux sont l’une des lésions les plus fréquentes observées à la naissance, avec une incidence de 1 nouveau-né sur 100. Leur intérêt clinique réside dans leur association avec le développement de mélanomes malins et avec une atteinte du système nerveux central sous la forme d’une mélanose neurocutanée.
Cependant, très peu de cas de mélanome malin provenant de nævus congénitaux ont été rapportés et on pense que le risque est directement proportionnel à la taille du nævus. Nous présentons un cas de mélanome malin chez une fillette de 9 ans présentant un nævus congénital de taille moyenne, sans antécédents familiaux de cancer de la peau.
Présentation du cas : Patiente de 9 ans suivie pour un nævus mélanocytaire congénital de taille moyenne sur la pointe du nez. Lorsque de nouvelles lésions en relief du nævus sont apparues, une biopsie cutanée a été réalisée sur l’une des lésions, qui a été désignée comme nævus mélanocytaire composé avec des caractéristiques congénitales et une dysplasie modérée à la jonction. Comme il s’agissait d’une biopsie incisionnelle avec un rapport de nævus dysplasique modéré sans indication urgente pour l’ablation de la lésion, il a été décidé de faire deux biopsies des lésions nodulaires restantes. Les deux ont été désignés comme nævus mélanocytaire composé avec des caractéristiques congénitales et une légère dysplasie lentigineuse, l’un d’eux présentant un secteur central de fibrose avec des mélanophages et une angiogenèse. En accord avec les services de dermatologie, de pédiatrie et de chirurgie plastique, une résection complète de la lésion avec marges, une reconstruction avec un lambeau médio-frontal et une greffe de conque auriculaire ont été réalisées. Ensuite, la deuxième étape de la reconstruction chirurgicale a été réalisée avec un lambeau médio-frontal et une structuration nasale. L’anatomie pathologique de l’échantillon a observé un foyer de mélanome en phase de croissance verticale associé à un nævus mélanocytaire composé aux caractéristiques congénitales, Breslow 1 mm, non ulcéré, avec une marge libre à 1 cm de la lésion. Le diagnostic de mélanome dans le cadre d’un nævus congénital nasal a été discuté avec les services de dermatologie, de chirurgie plastique pédiatrique et d’hémato-oncologie pédiatrique. On a considéré que les marges de sécurité de la lésion maligne étaient suffisantes et il a été décidé de demander des examens de stadification, qui ont permis d’exclure une atteinte secondaire, et d’effectuer un suivi clinique dermatologique et muqueux strict. Comme une chirurgie d’élargissement avait déjà été effectuée et que le drainage lymphatique était détérioré, il a été décidé de ne pas effectuer de biopsie des ganglions sentinelles. Enfin, la troisième étape de la reconstruction nasale a été réalisée avec un lambeau médio-frontal, une section pédiculaire et un affinement de la pointe nasale, avec d’excellents résultats esthétiques.
Discussion : Le pronostic des nævus mélanocytaires congénitaux uniques, de taille petite à moyenne,
est généralement excellent, et leur risque de développer un mélanome ultérieurement est estimé à environ 1 %, ce risque étant extrêmement rare avant la puberté. Chez les patients présentant un nævus mélanocytaire congénital de grande taille ou géant, le risque est estimé à environ 5 %, ce risque augmentant avec la taille. Dans ce dernier cas, les mélanomes ont tendance à apparaître plus tôt dans la vie (pendant l’enfance). La dermoscopie est essentielle à leur évaluation, car il s’agit d’une méthode peu coûteuse, rapide et non invasive qui peut fournir au médecin des informations très utiles pour le diagnostic de la transformation maligne précoce. Cependant, ce n’est pas toujours aussi facile. En cas de suspicion clinique de mélanome ou de modification du nævus, une biopsie urgente avec examen histopathologique doit être réalisée. Un diagnostic précoce et un traitement rapide sont nécessaires pour prévenir les métastases. Le stade de la tumeur est le principal facteur de pronostic dans les mélanomes de l’enfant comme dans les mélanomes de l’adulte. Le présent cas souligne le
rôle de la suspicion clinique de malignité et la nécessité d’une surveillance étroite dans ce type de nævus.
Génétique du mélanome de la muqueuse péri-anale
Emily Mira WARSHAUER - Dermatologie de l’enfant, de l’adolescent et de l’adulte
Introduction : Le mélanome muqueux est un sous-type rare et agressif de mélanome qui n’est pas très bien compris. Son pronostic est mauvais, souvent en raison d’un diagnostic tardif et du manque de traitements efficaces. La biologie et les facteurs oncogènes du mélanome muqueux sont différents de ceux du mélanome cutané. Une meilleure compréhension du paysage mutationnel du mélanome muqueux est essentielle pour identifier de nouvelles cibles thérapeutiques et améliorer les résultats cliniques.
Présentation du cas : une femme de 68 ans ayant des antécédents de cancer de l’endomètre et de la thyroïde s’est présentée à notre clinique de dermatologie en octobre 2020 avec un nodule péri-anal large et pédonculé. Son gastro-entérologue a d’abord identifié une lésion anale atypique, ce qui a conduit à l’orienter vers la dermatologie. La biopsie de la lésion a révélé un mélanome péri-anal avancé (pT3b avec ulcération, 5 mitoses/mm² et marges positives). Une deuxième biopsie d’une lésion satellite plus petite était également positive pour le mélanome in situ. Une TEP/TDM n’a montré aucun signe de métastases ganglionnaires à distance, mais elle a révélé un nodule avide de FDG (+) dans le sein côté gauche. L’IRM cérébrale n’a montré aucun signe de métastases. Une biopsie échoguidée du sein a confirmé le diagnostic de carcinome canalaire invasif (CCI) ER+ de grade intermédiaire à élevé (pT1c). Une lumpectomie pour un CCI multifocal ER/PR+ HER2- a été réalisée en décembre 2020 et une nouvelle excision en janvier 2021 en raison de marges positives. Une excision locale large du mélanome péri-anal avec des marges claires a été réalisée ainsi qu’une exérèse des ganglions sentinelles (EGS) négative au niveau de l’aine G. Un traitement adjuvant a été instauré pour le mélanome anorectal primitif à haut risque réséqué avec l’inhibiteur PD-1, nivolumab, en plus d’un inhibiteur d’aromatase pour le CCI. Les tests de diagnostic génétique moléculaire se sont révélés positifs pour les altérations somatiques suivantes : CDKN2A, CDKN2B, NF1, ANKRD11, MSH6, PTPRT et SF3B1.
Discussion : Une meilleure compréhension du paysage génomique du mélanome muqueux, associée
à l’apparition des thérapies ciblées, a révolutionné le paysage thérapeutique de ce mélanome rare et agressif. Dans le cas de notre patiente, des altérations des gènes CDKN2A, CDKN2B, NF1, ANKRD11, MSH6, PTPRT et SF3B1 ont été identifiées. Des mutations de la lignée germinale englobant à la fois CDKN2A et CDKN2B ont été associées à un syndrome de prédisposition au cancer, qui constitue un risque accru de divers cancers. La perte de ces deux suppresseurs tumoraux, telle que confirmée chez notre patiente, peut expliquer en partie le diagnostic de cancer de l’endomètre, de la thyroïde et du sein, en plus du mélanome péri-anal. Bien que les mutations du gène ANKRD11 n’aient pas été identifiées auparavant dans le mélanome, il a été démontré que l’ANKRD11 est régulé à la baisse dans les lignées cellulaires du cancer du sein et active l’expression de CDKN1A. Souvent connue pour être mutée dans les mélanomes, la PTPRT est également altérée chez notre patiente. La patiente a bien répondu à l’inhibiteur PD1, le nivolumab, et à ce jour, l’imagerie ne montre aucun signe de mélanome. De même, la thérapie ciblant PD1 s’est avérée plus efficace dans les mélanomes déficients en MMR, comme cela a été le cas dans ce dossier avec la mutation de MSH6. L’arsenal de biomarqueurs prédictifs est essentiel pour une prise en charge et un traitement efficaces des patients atteints de mélanome. Chez les patients atteints de mélanome muqueux comme dans notre cas, les mutations SF3B1 ont été spécifiquement identifiées comme étant les plus fréquentes et peuvent avoir un effet négatif sur le pronostic. Parfois, on trouve également des co-mutations de NF1, comme c’est le cas chez cette patiente. La perte allélique de NF1 peut entraîner une dérégulation de la voie RAS/MAPK, agissant au moins en partie comme un gène suppresseur de tumeur dans le développement du mélanome malin. Il est intéressant de noter
que le complexe d’épissage SF3b est apparu comme une cible thérapeutique potentielle et qu’il pourrait améliorer les options thérapeutiques du mélanome muqueux et du cancer du sein.
Mélanome acral : analyse rétrospective de 13 cas
Romina MILLER ROVTAR - Hôpital universitaire
Introduction et objectifs : Le mélanome acral est une pathologie rare, définie comme un néoplasme mélanocytaire situé dans la partie distale des membres, quelle que soit sa variante clinico- pathologique. Il se caractérise par son agressivité et son mauvais pronostic, car il est généralement détecté à un stade avancé. Cette étude vise à décrire l’épidémiologie, les présentations cliniques et histopathologiques de ce néoplasme dans notre population.
Matériel et méthodes : Nous avons examiné rétrospectivement tous les dossiers médicaux de
30 patients présentant un mélanome cutané de janvier 2019 à janvier 2022, pris en charge à l’hôpital Dr Federico Abete, et avons inclus uniquement ceux présentant une localisation acrale. Les caractéristiques épidémiologiques, les antécédents personnels, les présentations cliniques et les variantes histopathologiques ont été pris en compte.
Résultats : Au total, 30 patients atteints d’un mélanome cutané ont été diagnostiqués dans notre établissement entre janvier 2019 et janvier 2022. Ceux dont le mélanome cutané était localisé dans les zones acrales représentaient 43,3 % (n = 13) des premiers. La plupart des cas (n = 8) concernaient les pieds, principalement Le gros orteil (n = 4) et la plante des pieds (n = 3), mais aussi la région latérale des pieds (n = 1). L’atteinte des mains ne concernait que les doigts (n = 5). Il y a une prédominance de l’atteinte chez les hommes (n = 9) par rapport aux femmes (n = 4). La tranche d’âge allait de 17 à 89 ans, mais la plupart des patients avaient plus de 60 ans (n = 11). Les phototypes cutanés étaient principalement de type III (n = 7) et de type IV (n = 3), tandis que 3 patients présentaient le phototype II. Aucun n’avait d’antécédents personnels ou familiaux de mélanome, mais certains (n = 4) ont fait état d’un traumatisme local à l’emplacement du mélanome. Un trait distinctif était le diagnostic concomitant de vitiligo chez 3 patients. Le diagnostic histopathologique prédominant était le mélanome nodulaire (n = 6), avant la variante acrale lentigineuse (n = 4), les autres étant indéterminés.
Conclusion : Indépendamment du fait que dans notre contexte socio-culturel, les patients ont tendance à éviter les contrôles médicaux, nous trouvons que le nombre de cas accumulés est très notable, car le mélanome acral est un diagnostic peu fréquente par rapport aux autres mélanomes. En outre, nous avons trouvé intéressant que certains patients aient eu un diagnostic concomitant de vitiligo et des antécédents de traumatisme local à l’emplacement de la tumeur, et qu’aucun d’entre eux n’ait signalé d’antécédents familiaux de mélanome.
Orateurs : Dr Vishal A. PATEL, Dr Chrys Schmults, Dr Ander MAYOR
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Consensus et différences relatives au carcinome épidermoïde à haut risque entre les spécialistes en cancer de la peau
Dr Vishal A. PATEL
Selon le NCCN, les facteurs de risque très élevé de récidive locale et d’atteinte ganglionnaire (un seul facteur est nécessaire pour être considéré comme un risque très élevé) sont :
- Facteurs cliniques : taille supérieure à 4 cm.
- Facteurs histologiques : peu différencié, sous-type desmoplastique, invasion profonde de plus de 6 mm ou invasion sous la graisse, cellules tumorales dans les gaines nerveuses d’un calibre supérieur ou égal à 0,1 mm ou sous le derme, invasion vasculaire ou lymphatique.
8e édition de l’AJCC T1 : moins de 2 cm T2 : entre 2 et 4 cm
T3 : plus de 4 cm, ou invasion superficielle de l’os, ou invasion périneurale des nerfs supérieure à 0,1 mm ou sous le derme, ou invasion profonde supérieure à 6 mm ou sous la graisse
T4a : invasion de l’os cortical ou médullaire
T4b : invasion de l’os du crâne ou du foramen de la base du crâne
BWH
T1 : absence de facteur de risque élevé T2a : 1 facteur de risque élevé
T2b : 2 ou 3 facteurs de risque élevé
T3 : 4 facteurs de risque élevé ou plus, ou invasion osseuse
Bien que tous les systèmes de stadification puissent être utilisés, celui du BWH présente une sensibilité, une spécificité et une VPP plus élevées, c’est-à-dire qu’il a une valeur statistique supérieure.
Examinons les points de consensus par stade entre les spécialistes. AJCC T2N0M0 :
Domaines faisant l’objet d’un consensus important : la chirurgie est recommandée comme traitement
de première intention. La BGS n’est pas recommandée pendant la chirurgie pour détecter les métastases. L’imagerie préopératoire pour détecter les métastases à distance n’est pas recommandée.
Domaines faisant l’objet un consensus modéré : la chirurgie de Mohs est choisie comme traitement de première intention.
Domaines de non-consensus : 59 % ne recommandent pas une échographie préopératoire pour détecter les métastases ganglionnaires chez ces patients et 41 % la recommandent.
AJCC T3N0M0 :
Domaines faisant l’objet d’un consensus important : la chirurgie est recommandée comme traitement de première intention. L’imagerie préopératoire pour détecter les métastases ganglionnaires est recommandée.
Domaines faisant l’objet d’un faible consensus : l’imagerie préopératoire pour détecter les métastases à distance n’est pas recommandée. La chirurgie de Mohs est choisie comme traitement de première intention.
Domaines de non-consensus : 59 % ne recommandent pas la BGS au moment de la chirurgie pour détecter les métastases ganglionnaires infracliniques et 41 % la recommandent. Un traitement supplémentaire est recommandé et avec des marges chirurgicales saines (57 %) contre aucun traitement supplémentaire (43 %). En cas de traitement complémentaire, la radiothérapie est effectuée localement au niveau du site primaire (61 %) vs également au niveau du ganglion lymphatique (31 %)
AJCC T4N0M0 :
Domaines faisant l’objet d’un consensus important : la chirurgie est recommandée comme traitement de première intention (chirurgie de Mohs 40 % vs chirurgie conventionnelle 60 %). L’échographie préopératoire pour détecter les métastases ganglionnaires est recommandée. Une radiothérapie adjuvante postopératoire est recommandée même si la marge chirurgicale est saine.
Domaines de consensus modéré : l’imagerie préopératoire pour détecter les métastases à distance est recommandée.
Domaines de faible consensus : la biopsie du ganglion sentinelle est recommandée en conjonction avec la chirurgie pour détecter les métastases des ganglions lymphatiques.
En conclusion, les spécialistes parviennent à un consensus sur la prise en charge de la maladie avancée, mais la maladie à haut risque présente encore une variabilité significative dans le consensus. Des études cliniques sont nécessaires pour clarifier le rôle des examens d’imagerie, du suivi, de la biopsie du ganglion sentinelle et du traitement adjuvant dans les cas de maladie avancée résécable à haut risque.
Options thérapeutiques pour le carcinome épidermoïde à haut risque du cou de stade N0
Dr Abel Gonzalez
Le pronostic global des patients atteints de carcinome épidermoïde de la tête et du cou est bon, mais 4 % des patients développent des métastases ganglionnaires et 2 % meurent de cette cause.
L’atteinte ganglionnaire et systémique est le facteur pronostique le plus important car elle réduit de moitié le taux de survie. La plupart des décès dus au carcinome épidermoïde de la tête et du cou sont dus à une maladie locorégionale avancée.
Le taux de métastases ganglionnaires et à distance est variable selon le site concerné, étant plus élevé au niveau de la lèvre et de l’oreille. Ce comportement plus agressif peut être dû à son anatomie unique avec une peau fine, un tissu sous-cutané minimal au-dessus des structures cartilagineuses ou musculaires, et sa proximité avec les voies lymphatiques.
À l’intérieur de la lèvre, le vermillon présente un risque plus élevé de métastases (7,6 %) que la lèvre cutanée (1,5 %).
Différentes approches ont été proposées pour la prise en charge des ganglions du cou : Évidement ganglionnaire électif (d’autres examens sont nécessaires pour indiquer ce traitement). La biopsie du ganglion sentinelle peut permettre d’identifier des métastases occultes chez les patients à haut risque, mais son utilité reste à confirmer.
Et une surveillance active. Le suivi doit être effectué tous les mois ou tous les deux mois pendant les deux premières années. Il faut apprendre aux patients à autopalper leurs ganglions chaque semaine et, en cas de doute, à contacter leur médecin.
Prise en charge du carcinome épidermoïde au-delà de la chirurgie : indications actuelles et émergentes pour l’immunothérapie
Dr Chrys Schmults
Les objectifs de cette discussion sont d’analyser attentivement les cas considérés comme non résécables, de comprendre les informations actuelles sur l’immunothérapie dans le carcinome épidermoïde et de savoir quand envisager d’orienter les patients vers l’immunothérapie.
Aux États-Unis, nous enregistrons 1,5 million de cas de carcinome épidermoïde par an, ce qui représente un nombre de cas trop important pour pouvoir les contrôler statistiquement et les étudier tous. Ces chiffres ne sont donc pas aussi bien connus que ceux du mélanome, mais nous savons qu’aux États-Unis, 1 à 4 % des patients présentent des métastases à la suite d’un carcinome épidermoïde et que 1 à 2 % des patients en meurent. Cela représente environ 15 000 décès par an dus au carcinome épidermoïde aux États-Unis, un chiffre probablement plus élevé que les décès dus au mélanome dans cette nouvelle ère de traitements par immunothérapie, où l’on estime à 7 300 le nombre de décès par an dus au mélanome..
Le NCCN recommande un traitement anti-PD1 pour le carcinome épidermoïde dont la probabilité de guérison par chirurgie ou radiothérapie est faible. Comment savoir quels sont les cas qui ont peu de chances de guérir ? Un carcinome épidermoïde localement avancé est considéré comme inopérable lorsque la guérison est improbable, que la reconstruction est trop risquée ou que le traitement entraînerait une perte de fonction intolérable pour le patient.
Dans ces cas, une immunothérapie anti-PD1 peut être utilisée, comme le cémiplimab, autorisé en 2018 aux États-Unis, avec un taux de réponse de 50 % et un taux de contrôle de la maladie de 72 %. Le pembrolizumab, autorisé aux États-Unis en 2020, a un taux de réponse de 34 %, un taux de contrôle de la maladie de 52 % et la plupart des essais sur le pembrolizumab concernaient des patients en deuxième intention.
La réponse complète est inférieure à 20 % avec ces traitements, mais possible.
Tous les cas métastatiques ont-ils besoin d’anti-PD1 ? De nombreuses métastases ganglionnaires ne nécessitent pas de traitement systémique, le stade N1 a un taux de guérison à 5 ans de 92 % avec chirurgie + radiothérapie, les stades N plus élevés sont moins favorables, et les patients immunodéprimés avec une maladie ganglionnaire de stade N2 présentent un taux de survie plus faible.
Deux essais sont en cours pour analyser le traitement adjuvant par anti-PD1 par rapport à un placebo après la chirurgie et la radiothérapie.
Une publication récente du NEJM (27/10/2022) qui étudie le cémiplimab néoadjuvant dans le carcinome épidermoïde de stades II à IV, inclut 79 patients, 60 % avec des métastases ganglionnaires, 4 doses de cémiplimab et ensuite une chirurgie, 51 % de réponse histologique complète lorsque la tumeur a été retirée, et 18 % d’effets indésirables de grade 3/4.
Qui devrait recevoir un traitement néoadjuvant anti-PD1 : tumeurs non résécables, patients présentant une morbidité chirurgicale élevée et un risque élevé de récidive malgré la chirurgie.
Pour conclure, nous pouvons dire que le carcinome épidermoïde tue environ 10 000 personnes par an aux États-Unis. Le cémiplimab et le pembrolizumab sont les seuls traitements autorisés pour le carcinome épidermoïde non résécable, avec un taux de réponse supérieur à 50 %, une stabilisation de la maladie supérieure à 70 % et une réponse complète inférieure à 20 %. Les patients greffés présentent un risque de rejet de 50 % avec ces traitements, ils ne sont donc pas recommandés. Le traitement néoadjuvant donne des résultats prometteurs avec une réponse complète de 50 %.
Épidermolyse bulleuse dystrophique
Dr Ander MAYOR
L’épidermolyse bulleuse est une maladie dont le risque cumulatif de développer un carcinome épidermoïde est de 7,5 % à l’âge de 20 ans, 67,8 % à l’âge de 35 ans et 90 % à l’âge de 55 ans, et dont le risque cumulatif de mourir d’un carcinome épidermoïde est de 57,2 % à l’âge de 35 ans et 87,3 % à l’âge de 45 ans.
Le carcinome épidermoïde de l’épidermolyse bulleuse présente une charge mutationnelle élevée non liée à l’exposition aux ultraviolets. Le micro-environnement du carcinome épidermoïde dans ces cas est caractérisé par des doses élevées d’une composante inflammatoire et de fibrose, avec des doses élevées de TGF-b1 et d’IL-6.
Quelques considérations cliniques sur le carcinome épidermoïde lié à l’EB : l’âge d’apparition est généralement de 32 ans en moyenne, il touche généralement les membres supérieurs et inférieurs, il présente généralement au moins 3 tumeurs simultanément, de plus de 2 cm et bien différenciées histologiquement, avec des taux de récidive élevés et un risque de métastases de 38 %.
Un examen complet de la peau est suggéré tous les 3 à 6 mois pour les formes sévères d’épidermolyse bulleuse, tous les six mois pour les autres formes et tous les trois mois en cas d’antécédents de carcinome épidermoïde.
Il faut faire attention aux plaies qui ne cicatrisent pas et à l’hyperkératose ou aux zones de paresthésie et de douleur accrues. Il est recommandé de consulter un pathologiste spécialisé car il est difficile de le différencier d’une hyperplasie bénigne. Il n’y a pas de données sur la chirurgie de Mohs dans ces cas, mais nous suggérons cette technique. Il n’existe aucune donnée sur l’amélioration de la survie globale avec l’amputation.
Pour conclure, nous souhaiterions mentionner que le carcinome épidermoïde représente un problème important pour les patients atteints d’EB. L’état de fibrose chronique génère un micro-environnement pro-tumoral qui constitue la principale cause de carcinome épidermoïde chez ces patients. Les informations sur la prise en charge de la maladie avancée chez ces patients sont limitées.
Orateurs : Dr Susana Puig, Dr Mazzuoccolo, Dr Roxana del Aguila, Dr Abel Gonzalez
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Rôle du traitement néoadjuvant dans le carcinome épidermoïde avancé et précision thérapeutique dans le carcinome épidermoïde
Dr Susana Puig
Le carcinome épidermoïde est le cancer de la peau le plus fréquent, représentant 80 % des cancers autres que le mélanome et plus de 25 % des cancers dans le monde (ce chiffre est probablement sous-estimé).
Dans les mécanismes moléculaires du carcinome épidermoïde, la signature mutationnelle des UV est connue pour être importante, et le nombre de mutations par mégabase est plus élevé que dans le mélanome. Plus de 90 % des cas de carcinome épidermoïde présentent une activation de la voie Hedgehog, 80 % étant dus à des mutations de PCTH1 et d’autres comme SMO, Gli, SUFU. Il existe différentes molécules qui inhibent cette voie, comme le vismodégib et l’itraconazole.
Nous savons que le meilleur traitement est la chirurgie, et en fonction de la localisation et des sous- types, une technique ou une autre sera choisie, mais les cas avancés peuvent ne pas pouvoir être opérés et ne pas répondre à la radiothérapie. Il faut alors recourir à d’autres options comme la thérapie systémique. Les inhibiteurs de la voie Hedgehog sont actuellement les seuls traitements systémiques approuvés pour le carcinome épidermoïde avancé : le vismodégib approuvé pour le carcinome épidermoïde localement avancé et métastatique, et le sonidégib approuvé pour le carcinome épidermoïde localement avancé et uniquement en Australie et en Suisse pour le carcinome épidermoïde métastatique.
Nous disposons de 2 études sur le traitement par inhibiteur de la voie Hedgehog pour le carcinome épidermoïde avancé : vismodégib (ERIVANCE) et sonidégib (BOLT) avec des profils de réponse majeurs et des profils de toxicité similaires. Certains effets indésirables peuvent être graves, certains dans les premières semaines et d’autres plus tard, comme la perte de cheveux, l’asthénie et la perte de poids. La dysgueusie et les spasmes musculaires sont plus fréquents. Il existe une certaine résistance au traitement et beaucoup abandonnent le traitement en raison des effets indésirables.
De nombreux auteurs suggèrent l’utilisation d’inhibiteurs de la voie Hedgehog dans le traitement néoadjuvant.
Une étude multicentrique, de phase II réalisée en ouvert sur le vismodégib néoadjuvant pour le carcinome épidermoïde localement avancé, administré à des doses standard pendant 4 à 10 mois, montre qu’i peut être bénéfique au traitement chirurgical en permettant de réduire les comorbidités. Les investigateurs ont classé l’approche chirurgicale possible avant le traitement en différents stades, de la gravité la plus importante à la plus basse, et ont constaté que l’état de la grande majorité des patients s’améliorait et que le stade chirurgical était diminué après le traitement.
L’essai VISORB a analysé l’utilisation du vismodégib pour la conservation de la fonction visuelle chez les patients atteints de carcinome épidermoïde périoculaire avancé. Cet essai est une étude de phase IV non randomisée réalisée en ouvert et impliquant des patients atteints de carcinome épidermoïde localement avancé de la région oculaire avec un risque d’atteinte du globe oculaire et des canaux lacrymaux. Un score a été réalisé pour évaluer la fonction visuelle chez ces patients et le
vismodégib a été administré à raison de 150 mg par jour pendant 12 mois, puis les prélèvements chirurgicaux ont été examinés par histologie. Les conclusions de cette étude sont que le vismodégib est efficace pour protéger l’œil et la fonction visuelle, seul ou comme traitement néoadjuvant. Ce traitement doit être envisagé pour les cas de carcinome épidermoïde périoculaire qui peuvent nécessiter une exentération du globe oculaire, ou une perte significative de la fonction visuelle, en plus d’une déformation faciale importante.
Le carcinome épidermoïde présente souvent une charge mutationnelle élevée et une forte expression de PDL1. Les tumeurs présentant une charge mutationnelle élevée ont tendance à mieux répondre aux inhibiteurs de PD1. Les inhibiteurs de points de contrôle tels que le cémiplimab constituent une option pour les patients chez qui le traitement par inhibiteurs de la voie Hedgehog a échoué.
En conclusion, nous pouvons dire que le traitement néoadjuvant par inhibiteurs de la voie Hedgehog pour le carcinome épidermoïde avancé difficile à opérer est efficace car il permet de préserver la structure et la fonction, et les effets indésirables sont contrôlables. La durée du traitement avant la chirurgie n’est pas bien établie. Certaines tumeurs peuvent être essentiellement résistantes et progresser vers un stade ultérieur ou la chirurgie, mais dans ces cas, nous pouvons utiliser l’immunothérapie. La récidive tumorale documentée est supérieure à 30 % à 36 mois.
Résistance aux inhibiteurs de Hedgehog
Dr Mazzuoccolo
Il existe 3 mécanismes de résistance :
- Mutations génétiques : mutation SMO, SUFU, amplification GLI.
- Activation des voies Hedgehog non canoniques.
- Perte des cils primaires.
STEVIE est un essai pivot de phase II, multicentrique et réalisé en ouvert qui évalue la sécurité et l’efficacité du vismodégib chez des patients atteints de carcinome épidermoïde localement avancé ou métastatique. On a considéré que la résistance intrinsèque était supérieure à 20 % du diamètre total et la résistance acquise supérieure à 30 % de la contraction et de la repousse. Chez les patients présentant une résistance primaire, des indices génomiques ont été recherchés et une charge mutationnelle significative a été identifiée chez les patients présentant une résistance intrinsèque par rapport aux patients présentant une réponse au vismodégib. Les patients qui avaient reçu un traitement antérieur par chimiothérapie ou radiothérapie présentaient un risque plus élevé de résistance.
Les variants du gène SMO expliquent la majorité des cas de résistance aux médicaments dans le carcinome épidermoïde, et nous avons constaté qu’il existe des mutations qui n’étaient pas présentes dans les biopsies avant le début du traitement par vismodégib, c’est-à-dire que de nouvelles mutations apparaissent.
Activation des voies Hedgehog non canoniques, le TGFb est un puissant inducteur de GLI1 et GLI2.
Il existe des études sur la façon dont la perte de cils primaires est un mécanisme de résistance aux inhibiteurs de SMO.
Comme stratégie, nous pouvons changer d’inhibiteurs de Hedgehog pour faire face à la résistance lorsque le carcinome épidermoïde avancé est une menace.
En conclusion, nous pouvons dire que différents mécanismes peuvent expliquer la résistance. Il existe certaines stratégies pour la surmonter, mais des études supplémentaires sont nécessaires pour personnaliser les protocoles.
Expérience avec le vismodégib dans la région LATAM et en Argentine
Dr Roxana del Aguila
La FDA a approuvé le vismodégib en 2012, et en Argentine, 2 études ont conduit à l’approbation définitive par l’ANMAT en 2017.
L’une de ces 2 études est l’étude STEVIE, qui est un essai pivot de phase II, multicentrique et réalisé en ouvert qui évalue la qui évalue la sécurité et l’efficacité du vismodégib chez des patients atteints de carcinome épidermoïde localement avancé ou métastatique.
L’autre étude était une étude observationnelle qui a évalué l’efficacité et la sécurité du vismodégib dans le monde réel dans une cohorte de patients atteints de carcinome épidermoïde avancé en Argentine.
Nous disposons également d’une étude multicentrique rétrospective observationnelle et descriptive (Hôpital Roffo, Hôpital Italien et Hôpital Eva Perón) sur le vismodégib à une dose de 150 mg par jour, dans la pratique dermatologique courante, pendant quatre ans.
Pour conclure, nous pouvons mentionner un taux de réponse élevé au vismodégib avec un bon profil de sécurité et des effets indésirables moyens à modérés. Le vismodégib est utilisé en Argentine pour le carcinome épidermoïde localement avancé ou métastatique et également comme néoadjuvant avant la chirurgie de Mohs.
Traitement néoadjuvant par vismodégib dans le carcinome épidermoïde périoculaire localement avancé
Dr Abel Gonzalez
Le carcinome épidermoïde périoculaire localement avancé est la cause la plus fréquente d’exentération oculaire.
La chirurgie de Mohs est le traitement de référence du carcinome épidermoïde périoculaire avec des taux de guérison de 95 à 99 %. Chez quelques patients, il est possible de conserver l’œil avec des marges négatives et les résultats de la reconstruction ne sont généralement pas optimaux.
Il a été démontré que le vismodégib néoadjuvant réduit la taille de la tumeur chez ces patients et permet une chirurgie moins morbide. Le recours ultérieur à la chirurgie de Mohs permet une résection complète de la tumeur avec confirmation histologique de l’efficacité du vismodégib et une reconstruction sûre avec un meilleur résultat fonctionnel et esthétique.
L’essai VISORB a analysé l’utilisation du vismodégib , pour la conservation de la fonction visuelle chez les patients atteints de carcinome épidermoïde périoculaire avancé. Cet essai est une étude de phase IV non randomisée réalisée en ouvert et impliquant des patients atteints de carcinome épidermoïde localement avancé de la région oculaire avec un risque d’atteinte du globe oculaire et des canaux lacrymaux. Un score a été réalisé pour évaluer la fonction visuelle chez ces patients et le vismodégib a été administré à raison de 150 mg par jour pendant 12 mois, puis les prélèvements chirurgicaux ont été examinés par histologie. Les conclusions de cette étude sont que le vismodégib est efficace pour protéger l’œil et la fonction visuelle, seul ou comme traitement néoadjuvant. Ce traitement doit être envisagé pour les cas de carcinome épidermoïde périoculaire qui peuvent nécessiter une exentération du globe oculaire, ou une perte significative de la fonction visuelle, en plus d’une déformation faciale importante.
Orateurs : Dr PUIG SARDÁ, Susana, Dr SANCHES, José Antonio, Dr PELLACANI, Giovanni
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Dépistage du cancer de la peau
Permet un diagnostic précoce du mélanome et améliore le taux de survie
Dr PUIG SARDÁ, Susana
Qu’est-ce qui caractérise un patient à haut risque de mélanome ? Selon différentes publications, la présence de 20 nævus sur les bras constitue une règle simple pour identifier les jeunes patients de moins de 50 ans à haut risque de mélanome.
Chez quels patients faut-il pratiquer un examen physique complet ? Les facteurs de risque sont un âge supérieur à 50 ans, le nombre de nævus, les antécédents personnels de mélanome ou de cancer de la peau non mélanique, une exposition chronique au soleil pendant de nombreuses années et des kératoses actiniques.
Selon une étude DERMA RISC, qui portait sur 400 patients adultes dont 26 étaient atteints d’un cancer de la peau, 12 % des participants ont signalé des antécédents familiaux de cancer de la peau et 6 % des antécédents personnels. Un scanner cutané sur le corps entier a été effectué chez 20 % des participants. 44 % des participants présentaient 10 lésions pigmentées ou plus sur un bras, ou plus de 20 entre les deux bras, et 21 % des patients évalués présentaient des lésions solaires chroniques. Plus de 80 % des mélanomes, 95 % des CBC et 100 % des CEC ont été diagnostiqués dans le groupe de patients de plus de 45 ans.
Cet outil (le questionnaire d’évaluation des risques et examen physique de la peau des bras et des autres zones exposées) a une valeur prédictive négative de 98 % et une sensibilité de 92 % pour la détection du cancer de la peau.
Selon une méta-analyse publiée dans The Lancet, la dermoscopie améliore l’efficacité du diagnostic du mélanome de 35 % par rapport à l’examen effectué à l’œil nu.
En conclusion, bien que le dépistage du cancer de la peau dans différentes populations soit minime et controversé, nous devons améliorer l’accès des patients atteints de mélanome et de cancer de la peau à un traitement approprié. Responsabiliser la population vis-à-vis de sa santé implique de l’éduquer, afin d’essayer de reconnaître les lésions cutanées suspectes et de prendre ses responsabilités en allant consulter un dermatologue afin de ne pas manquer l’occasion d’un diagnostic précoce.
Vers un surdiagnostic et une augmentation de l’incidence du mélanome
Dr SANCHES, José Antonio
Le mélanome est-il surdiagnostiqué ?
Swerlick et Chen ont été les premiers à suggérer en 1997 que l’« épidémie de mélanomes cutanés » rapportée est plus apparente que réelle. Plus de deux décennies plus tard, cette augmentation rapide continue à faire débat sans consensus.
L’impact de l’augmentation du nombre de diagnostics de mélanome a fait l’objet d’un débat : le diagnostic précoce peut améliorer le taux de survie des patients, mais le sur diagnostic peut être préjudiciable pour le patient, car un diagnostic de cancer peut entraîner un traitement médical excessif et un stress psychologique pour le patient, et pour le système de santé, le diagnostic de cancer entraîne une augmentation des coûts et des ressources utilisées.
Si nous comparons l’incidence et le taux de mortalité de ces dernières années, nous constatons que de 1975 à 1989, l’incidence du mélanome a augmenté de 73 % et le taux de mortalité de 29 %. De 1989 à 2013, l’incidence du mélanome a augmenté de 77 % et le taux de mortalité n’a pas évolué. De 2013 à 2017, l’incidence a augmenté de 6,6 % et le taux de mortalité a diminué de 22 %.
Selon une étude américaine, au cours des 10 dernières années, le taux d’incidence du mélanome a augmenté en moyenne de 1,5 % par an et le taux de mortalité a diminué en moyenne de 2,5 % chaque année entre 2007 et 2016.
L’incidence du mélanome est aujourd’hui 6 fois plus élevée qu’il y a 40 ans. De nombreuses questions se posent quant à savoir si cette augmentation de l’incidence représente une véritable épidémie de mélanome ou une épidémie de surdiagnostic de mélanome. L’augmentation des diagnostics de mélanome ne concerne que le mélanome cutané, tandis que les mélanomes non cutanés restent stables. Ce désaccord en termes d’incidence peut provenir d’une différence d’accessibilité aux examens visuels de la peau qui rendent le diagnostic du mélanome cutané plus accessible, la peau du sujet étant plus exposée que les sites de mélanome non cutané.
Les facteurs possibles liés à cette augmentation de l’incidence des mélanomes sont une exposition plus importante aux ultraviolets, un plus grand nombre de biopsies cutanées effectuées par le dermatologue, un développement du diagnostic histopathologique en raison d’un aspect juridique pour le pathologiste, l’absence de diagnostic de nombreux mélanomes par le passé qui nous permet d’y penser davantage, et le vieillissement de la population.
Inquiets du surdiagnostic, les défenseurs du dépistage font valoir le fait qu’il leur permet de poser un diagnostic précoce en plus de saisir l’occasion de conseiller les patients en matière de photoprotection. Mais le dépistage peut conduire à un surdiagnostic et au sur traitement de maladies cliniquement insignifiantes. Le surdiagnostic du cancer fait référence à la détection de tumeurs qui ne provoquent pas de maladie cliniquement significative si elles ne sont pas traitées.
25 % des décès liés au mélanome sont dus à des mélanomes fins et ne peuvent donc pas être simplement ignorés. Le mélanome in situ peut indiquer la prédisposition d’un patient à développer ultérieurement un mélanome invasif.
L’étude Screen en Allemagne comparait le taux de mortalité dû au mélanome dans une région allemande où le dépistage était effectué avec celui de régions voisines qui ne le pratiquaient pas, et elle rapportait une réduction de 48 % de la mortalité due au mélanome. Toutefois, une autre étude indépendante qui suivait les patients de l’étude pendant 5 années de plus a constaté que cette observation ne persistait pas dans le temps (bien que 37 % des individus aient été perdus de vue pendant le suivi). À partir de cet essai, l’Allemagne a mis en place un programme national de dépistage du mélanome pour les patients âgés de plus de 35 ans. L’incidence du mélanome était plus élevée après le lancement de ce programme, mais la mortalité n’avait pas évolué.
En conclusion, des recherches supplémentaires sont nécessaires pour comprendre pleinement l’impact du dépistage sur le mélanome. Selon l’USA Preventive Service Task Force, nous ne disposons pas de preuves suffisantes pour indiquer un dépistage de la population. La Société américaine du cancer recommande aux adultes de plus de 20 ans de faire vérifier leur peau dans le cadre d’un dépistage général. On sait que certaines populations ont un risque plus élevé de développer un mélanome : plus de 50 ans, antécédents familiaux de mélanome, présence de plus de 100 nævus, présence de nævus dysplasiques et patients immunodéprimés. Dans ce groupe de patients, le dépistage peut être bénéfique.
Marges en cas de mélanome 2022. Que devons-nous faire ?
Marges standard
Dr GONZÁLEZ, Abel
La chirurgie standard pour le traitement local du mélanome primaire consiste en une exérèse large, qui inclut la tumeur, la peau normale environnante et le tissu cellulaire sous-cutané sous-jacent, le principe étant d’éliminer toutes les microsatellitoses éventuellement présentes. Le fait de ne pas retirer correctement le mélanome ou les microsatellitoses entraîne une récidive locale ou des métastases locales.
On observe une satellitose, manifestation d’une propagation lymphatique régionale intracutanée ou sous-cutanée, dans 4 % des mélanomes et elle est associée à un faible taux de survie, la récidive locale étant associée à un taux de survie inférieur à 10 %. Auparavant, les marges d’exérèse des mélanomes étaient plus radicales, puis la marge a commencé à être associée à l’épaisseur de Breslow. Selon le NCCN :
Mélanome in situ - marge comprise entre 0,5 et 1 cm Breslow inférieur ou égal à 1 mm - marge 1 cm Breslow compris entre 1 et 2 mm - marge de 1 à 2 cm Breslow compris entre 2 et 4 mm - marge de 2 cm Breslow supérieur à 4 mm - marge de 2 cm
Et la chirurgie de Mohs comme traitement primaire du mélanome invasif n’est pas recommandée lorsque des marges standard peuvent être pratiquées.
Le European Journal of Surgical Oncology a publié en 2021 un résumé des recommandations relatives aux marges chirurgicales préconisées dans les différentes directives du monde entier. Bien que toutes ces directives suggèrent des marges légèrement différentes. Dans tous les essais, le taux de récidive locale était inférieur à 5 %.
L’essai MelMart vise à déterminer la sécurité d’une marge de 1 cm par rapport à une marge de 2 cm pour les patients présentant un Breslow supérieur à 1 mm et ayant subi une BGS, et les critères d’évaluation primaires sont la récidive locale et le taux de survie spécifique au mélanome. Ce travail visant à inclure 10 000 patients, il faudra donc des années pour le mener à bien.
En conclusion, nous nous basons sur des examens systématiques et des essais contrôlés randomisés pour prendre des décisions.
Marges personnalisées
Dr PELLACANI, Giovanni (Italie)
In vivo, cela s’applique avec le patient alité avant l’intervention chirurgicale et uniquement pour les marges superficielles, par exemple dans le cas du lentigo malin.
Ex vivo, cela s’applique sur des tissus prélevés récemment lors d’une intervention chirurgicale et l’on peut examiner l’épaisseur totale de l’échantillon, par exemple pour le CBC.
La microscopie confocale in vivo est indiquée pour tous les cancers superficiels de la peau sur peau fine.
La microscopie confocale à fluorescence ex vivo est indiquée s’il est nécessaire de détecter rapidement la marge tumorale peropératoire. L’orange d’acridine 1 mM est utilisée pendant 10 à 30 secondes avant d’être rincée avec du sérum physiologique.
Elle est utilisée pour la chirurgie de Mohs, elle peut potentiellement remplacer la congélation classique de l’échantillon chirurgical, et l’image colorée numériquement peut être interprétée par le pathologiste.
Orateurs : Dr OSTERWALDER
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
Mon exposé s’appuie sur cette revue du devenir, de l’exposition et des effets des protections solaires sur l’environnement aquatique et des conséquences de l’utilisation des protections solaires sur la santé humaine.
Les caractéristiques souhaitables d’un photoprotecteur sont les suivantes :
1- Protection contre les effets nocifs des rayons ultraviolets
2- Sécurité lors de l’utilisation humaine
3- Acceptable du point de vue cosmétique
4- Faible risque pour l’environnement
5- Abordable
1- La protection solaire prévient-elle le mélanome ? Nous ne pouvons pas encore l’affirmer, mais nous sommes sur la bonne voie. Ce que nous constatons, c’est qu’il est très important d’appliquer une protection solaire les jours ensoleillés. Il est également important de porter des chemises, des pantalons et des chapeaux pour se protéger du soleil.
Ce que l’on sait, c’est que les protections solaires fonctionnent et aident à prévenir la forme de cancer de la peau la plus importante.
Il existe différents profils de protection, avec plus d’UVB, plus d’UVA, et d’autres plus uniformes, ce que l’on appelle l’homéostasie spectrale, et c’est ce que nous devons rechercher. Toutes les protections offrant le même FPS ne sont pas équivalentes, elles ne protègent pas toutes correctement contre les UVA ou la lumière bleue, et elles n’utilisent pas toutes les mêmes concentrations des différents filtres pour obtenir ce FPS.
2- Sécurité chez l’homme et absorption par la peau. Le benzophénone 3 : une teneur de 6 % n’est pas sûre pour les grandes surfaces du corps, mais elle l’est pour les petites surfaces comme le visage ou les mains. La loi actuelle définit un teneur d’homosalate de 10 %.
3- Le marché définit qu’elle est acceptable du point de vue cosmétique, la tendance montre un choix de plus en plus important pour des filtres minéraux et colorés.
4- Faible risque pour l’environnement : la NAS (National Academy of Science) recommande à l’EPA de procéder à une évaluation du risque écologique pour tous les filtres actuellement sur le marché et tous les nouveaux filtres à venir, et de partager ces informations.
5- Aux États-Unis, il existe des filtres coûtant plus de 20 dollars l’once et l’Allemagne travaille à la fabrication de filtres moins coûteux, jusqu’à moins de 2 dollars l’once.
Orateurs : Dr MALVEHY, Josep
Article rédigé par Dr Maria Manuela MARTINEZ PIVA
La microscopie confocale est rapide et ne nécessite pas de laboratoire complexe. Elle peut guider la chirurgie de Mohs pour le traitement du cancer de la peau sans mélanome.
On utilise l’orange d’acridine, qui fournit un contraste important entre le noyau, le cytoplasme et le derme, et qui n’affecte pas l’imagerie par la congélation ultérieure de l’échantillon si nécessaire.
Elle permet de réduire la durée de l’intervention chirurgicale, de diminuer le nombre de biopsies et de limiter les retraits de tissus incorrects, et elle remplace d’autres méthodes moins sensibles et spécifiques.
Procédure : l’échantillon est coloré avec de I’orange d’acridine 0,6 mmol pendant 20 secondes, puis rincé avec du sérum physiologique. De l’acide acétique à 50 % y est ajouté pendant 20 secondes, puis il est rincé à nouveau dans du sérum physiologique, et observé au microscope confocal.
Cela permet de poser un diagnostic rapide des tumeurs cutanées et d’évaluer les marges dans les cancers de la peau (CBC, CEC, DFSP) même dans des sites spécifiques comme les paupières, la conjonctive et les ongles. Cette méthode peut être utilisée pour le diagnostic d’autres tumeurs comme le sein, la prostate, le cerveau, la thyroïde, le côlon, pour le diagnostic d’infections telles que la mucormycose, la dermatophytose, l’herpès, l’aspergillose, et pour des maladies telles que la vascularite, la maladie vésiculeuse, le psoriasis, le lichen plan, le lupus, et même pour les injections d’acide hyaluronique.
La microscopie confocale ex vivo permet un examen pathologique rapide et un télédiagnostic entre la salle d’opération et le laboratoire.