3 professionals
Coup d’œil du congrès IMCAS 2025
Coup d’œil du congrès IMCAS 2025
Améliorez vos connaissances professionnelles en profitant de nombreux services exclusifs dans le domaine de la dermatologie : plus de 500 visuels de pathologies, des cas cliniques, des vidéos d’experts…
Bénéficiez d’options uniques telles que l’offre de contenus audio et de supports à proposer à vos patients.
Restez informé(e) des événements et des webinaires à venir, des dernières publications scientifiques et des innovations produit.
Vous avez déjà un compte ? Se connecter
Comptes rendus rédigés par les Dr Ana Reymundo (Dermatologue, Espagne), Dr Lidiya Todorova (Dermatologue, Bulgarie) et Dr Marina Thomas (Dermatologue, France).

Sujets liés
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Session animée par : le Dr Editta Buttura Da Prato (chirurgien esthétique spécialiste du visage, Italie) ; le Dr Diala Haykal, MD (France)
La session s’est terminée par un échange de vues sur les bonnes pratiques esthétiques à mettre en œuvre en tenant compte des différences entre générations.
Intervenante : Dr Diala Haykal (France)
En guise d’introduction à sa conférence, le Dr Haykal a expliqué que les générations Z et Alpha ont grandi en étant très exposées à l’influence des médias sociaux. Ce sont les premières générations à avoir connu Internet depuis l’enfance et cela a une influence notable sur les standards de beauté, l’image corporelle et la perception de soi.
Puis le Dr Haykal a commencé à évoquer les différences entre les générations et les pratiques en matière de soins de la peau que la génération X, les milléniaux, la génération Z et la génération Alpha appliquent actuellement et en particulier l’impact des années de naissance sur les routines de soins de la peau et les procédures esthétiques qu’ils privilégient, ainsi que les résultats qu’ils visent en termes de perception des standards de beauté.
Elle a mis en lumière les différents standards de beauté selon les générations ainsi que les changements générationnels, en soulignant que :
Invention du terme « préjuvénation » : ce terme vieux de dix ans est défini comme un moyen de rechercher des moyens actifs de prévenir les signes de vieillissement dès le plus jeune âge afin de préserver la beauté naturelle. En esthétique, cette « approche » est principalement influencée par les médias sociaux (MS) et toutes les pratiques de soins de la peau présentées sur différentes plateformes de MS. Cependant, les non-professionnels qui recommandent des produits et des procédures de soins de la peau peuvent être à l’origine de traitements dangereux. Par conséquent, il existe un fort besoin d’éducation sur ce qui fonctionne vraiment et ce qui ne fonctionne pas. L’objectif devrait consister à accueillir la diversité et à se protéger de la désinformation véhiculée par les MS, ainsi qu’à promouvoir la positivité corporelle et la responsabilité de prendre des décisions éclairées.
Le temps passé sur les médias sociaux peut déclencher des troubles dysmorphiques et des pensées obsessionnelles liées à l’apparence physique. Cela a également conduit à un intérêt croissant pour l’utilisation de soins de la peau par des personnes de plus en plus jeunes et on peut s’inquiéter de l’usage de ces traitements inadaptés (voir Figure 1). Nous devrions aider les jeunes à acquérir les outils leur permettant d’évaluer de manière critique le contenu qu’ils consomment sur les médias sociaux afin d’éviter les pressions sociales et l’utilisation de traitements souvent inutiles.

Figure 1. Publicité conçue pour faire prendre conscience que les soins de la peau ne sont pas nécessaires chez l’enfant.
Le Dr Haykal a souligné la responsabilité des médecins lorsqu’il s’agit de répondre aux préoccupations suivantes :
Pour donner aux jeunes des compétences essentielles leur permettant d’évaluer le contenu des médias sociaux et d’assurer leur sécurité, le Dr Haykal a proposé un effort de collaboration impliquant des professionnels de santé, des parents, des décideurs, des leaders de l’industrie, des développeurs informatiques, des consultants culturels et des éducateurs.
Les prestataires de soins esthétiques doivent assumer la responsabilité du contenu qu’ils publient sur les médias sociaux, car ils possèdent une expertise inestimable et peuvent lutter contre la désinformation et offrir des informations concernant les procédures cosmétiques. Ils peuvent également mettre en évidence les risques potentiels. Ils ont pour mission de lancer des campagnes de sensibilisation aux pratiques de sécurité en dermatologie esthétique et à la nécessité de tenir compte de l’âge. Les écoles et les informations inscrites dans les programmes scolaires pourraient jouer un rôle important pour protéger la génération Alpha. Le rôle de l’industrie dans la protection de la génération Alpha consiste à déterminer les techniques de marketing qui ont une incidence sur les tendances cosmétiques chez les jeunes. Par exemple, certaines entreprises du secteur mènent actuellement des campagnes de sensibilisation aux tendances néfastes publiées sur les MS.
Conclusion :
Pour aller plus loin, le Dr Haykal suggère de se référer à l’article suivant : Haykal et al., Educational strategies to combat harmful cosmetic dermatology trends in Generations Alpha and Z, https://doi.org/10.1016/j.clindermatol.2024.05.004
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Intervenant : Dr Khaled Othman (Consultant en dermatologie, andrologie et médecine esthétique, EAU)
Le Dr Khaled commence sa présentation en indiquant que la préjuvénation est une tendance qui a vu le jour en 2021. La préjuvénation consiste à prévenir l’apparition du vieillissement dès le plus jeune âge, à l’aide de techniques mini-invasives avec la perspective de ne pas avoir à corriger les signes de l’âge plus tard avec des techniques plus invasives. Cette tendance touche également les hommes et est influencée par les médias sociaux. Il est inquiétant de constater que 85 % des informations sur la préjuvénation sont diffusées par des personnes qui ne sont pas des professionnels de la santé.
Des études montrent que la génération Z se lance dans des traitements esthétiques à un âge plus précoce par rapport aux générations précédentes. Leur vieillissement prématuré est influencé par des modes de vie malsains, le stress et l’exposition constante aux écrans numériques. En fait, au cours des 5 dernières années, on a observé une augmentation de 92 % des traitements de comblement dermique et de 236 % des injections de neurotoxine chez les milléniaux et les membres de la génération Z.
Principales préoccupations esthétiques de la génération Z :
Pour améliorer le bien-être général, on privilégie désormais une approche holistique associant alimentation, santé mentale, exercice physique et soins de la peau. Plusieurs traitements innovants révolutionnent le domaine de la préjuvénation pour la génération Z :
Le Dr Khaled a également évoqué certains problèmes croissants dans l’industrie :
Pour l’avenir, l’industrie se concentre sur des approches plus sûres et plus naturelles, telles que :
Les hommes sont les plus préoccupés par la perte de cheveux, mais il existe également une tendance croissante à l’utilisation de produits de comblement et de toxine botulique, ainsi qu’à l’amélioration de la qualité de la peau grâce à des produits topiques, des peelings et des lasers. Pour ces groupes, il est important d’être bien conseillé sur les traitements nécessaires et ceux qui ne le sont pas.
Conclusion :
Pour aller plus loin, le Dr Khaled suggère de se référer aux articles suivants :
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Intervenant : Professeur David J Goldberg (États-Unis)
Le professeur Goldberg a établi une classification des différentes générations afin de distinguer le concept de préjuvénation, qui est plutôt associé aux générations Alpha et Z, nées avec un accès à Internet dès leur plus jeune âge (Figure 2.). Ces générations sont généralement plus préoccupées par leur apparence en photo qu’en réalité. Les milléniaux se soucient également de leur image et adoptent le concept de préjuvénation, mais ils utilisent également des traitements correctifs quand ils sont plus âgés.

Figure 2. Segmentation des « générations » par âge/année de naissance.
Le professeur Goldberg est également revenu sur la définition de la préjuvénation, inventée par Ken Arndt en 2013 : l’utilisation de soins de la peau et de traitements cosmétiques non invasifs pour prévenir ou retarder les signes de l’âge. Il s’agit d’une approche proactive qui privilégie la prévention par rapport à la correction pour préserver ou améliorer les caractéristiques esthétiques de la jeunesse, généralement par le biais d’un protocole topique et de procédures cosmétiques. Comme mentionné précédemment, cette tendance est très influencée par les médias sociaux. Il se concentre sur l’utilisation de soins cutanés anti-rides, du baby botox, de boosters cutanés et du laser avec un temps d’immobilisation minimal.
Le rajeunissement conventionnel correspond plutôt à la génération X et aux baby-boomers. Ils présentent déjà des dommages cutanés qu’il s’agit de corriger. Par conséquent, il est plus courant de recourir aux lasers ablatifs tels que le CO2, les produits de comblement dermique ou même la chirurgie (Figure 3.).

Figure 3. Techniques conventionnelles de rajeunissement et groupes cibles.
Le professeur Goldberg conclut que, si les deux approches se ressemblent pour certains, elles n’ont en réalité rien à voir l’une avec l’autre. La première consiste à effectuer des procédures moins invasives afin de prévenir le vieillissement, et l’autre consiste à corriger le vieillissement déjà installé.
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Intervenante : Professeur Maria Jose Pelli (dermatologue, Argentine)
La cosmétorexie, qui touche principalement les jeunes filles entre 8 et 17 ans, est une obsession compulsive pour les cosmétiques et les soins de la peau, influencée par des facteurs sociaux et culturels. Bien qu’elle ne soit pas encore reconnue officiellement comme un trouble mental, elle présente des défis à la fois sur les plans dermatologiques et psychologiques. Cette pathologie a fait l’objet d’une attention particulière en raison de l’augmentation du temps passé devant les écrans durant la pandémie de COVID-19, des influenceurs sur les médias sociaux, de l’industrie cosmétique et de critères de beauté peu réalistes. Le diagnostic et l’intervention précoces par des professionnels de santé, ainsi que les conseils parentaux, sont essentiels en termes de prévention et de prise en charge.
Qu’est-ce que la cosmétorexie ?
C’est l’utilisation compulsive de produits cosmétiques et/ou faits maison en raison d’influences sociales et culturelles qui peut révéler un trouble sous-jacent compulsif ou dysmorphique. La maladie touche principalement les jeunes filles âgées de 8 à 17 ans. Le Dr Pelli a expliqué que la pathologie se traduit par une obsession de l’apparence physique, des soins de la peau excessifs et des dépenses importantes en produits cosmétiques. La maladie n’est pas encore reconnue comme un trouble mental.
À titre d’exemple, le Dr Pelli, a présenté un cas tiré de sa pratique, celui d’une patiente de 12 ans souffrant d’acné exacerbée par un excès de traitements cosmétiques à domicile. Les lésions étaient irritatives et prurigineuses. L’évaluation psychologique a révélé des tendances compulsives et de l’anxiété liées à la beauté. Grâce à ce cas, la conférencière a souligné la nécessité d’aborder à la fois les aspects dermatologiques et psychologiques dans le traitement de la cosmétorexie.
Aspects clés de la cosmétorexie
Le Dr Pelli a poursuivi son exposé en présentant les trois principaux aspects de la cosmétorexie :
Les patients souffrant de cosmétorexie sont souvent atteints de :
La cosmétorexie peut être un indicateur précoce de problèmes de santé mentale, tels que :
Pourquoi la cosmétorexie est-elle un problème émergent ?
Plusieurs facteurs ont contribué à l’émergence de la cosmétorexie en tant que problème répandu :
Comment les médecins peuvent-ils identifier la cosmétorexie ? Comment la traiter et la prévenir efficacement ?
Le Dr Pelli a décrit les indicateurs clés permettant aux médecins de suspecter une cosmétorexie chez de jeunes patients :
La prise en charge de la cosmétorexie nécessite une double approche :
La prévention commence à la maison, les parents jouant un rôle essentiel pour guider leurs enfants :
Si elles ne sont pas identifiées et traitées correctement à temps, les jeunes filles souffrant de cosmétorexie deviendront probablement des patientes exigeantes, qui ne seront jamais satisfaites et demanderont plus de traitements que nécessaire.
En conclusion, avec l’influence croissante des médias sociaux, des pressions sociétales et d’un marketing cosmétique agressif, les jeunes filles sont de plus en plus susceptibles de développer des comportements obsessionnels en matière de soins de la peau. Par conséquent, les médecins doivent être conscients de l’émergence de la cosmétorexie. Le dépistage précoce, l’intervention de professionnels et les conseils prodigués par les parents sont essentiels à la prévention et à la prise en charge de la maladie.
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Intervenante : Professeur Raheleh Sarbaziha (États-Unis)
Cette conférence avait pour objectif de décrire en quoi consistent les peptides, quels sont les peptides destinés aux injections disponibles sur le marché et comment ils sont réglementés par la FDA. Les peptides sont de courtes chaînes d’acides aminés qui agissent comme des molécules de signalisation dans l’organisme. Ils gagnent en popularité en médecine esthétique pour leur capacité à stimuler les processus cellulaires de régénération, de réparation et de lutte contre le vieillissement.

Figure 4. Peptides injectables les plus célèbres.
Il est important de savoir quels peptides sont autorisés dans le pays où l’on exerce, et de respecter les protocoles pour pouvoir les combiner. Il importe également d’éduquer le patient, car de nombreux peptides sont injectés par voie sous-cutanée et devront être administrés à domicile. Le professeur Sarbaziha les utilise depuis 5 ans et n’a jamais rencontré de problème ni d’altération analytique.
Voici ses principaux messages à retenir sur le sujet :
Le domaine des peptides injectables en médecine esthétique se développe, les recherches en cours permettant d’étendre leur potentiel thérapeutique et d’optimiser les formulations pour des applications ciblées.
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Intervenant : Dr Franck Bonnier (France)
Le Dr Bonnier a parlé d’un projet de recherche en cours visant à évaluer le vieillissement à l’aide de techniques d’imagerie telles que l’échographie et l’OCT. La combinaison des techniques permet d’obtenir davantage de données.
Points à retenir :
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Intervenante : Professeur Rym Benmously Mlika (Tunisie)
Des études récentes ont mis en évidence de nouveaux facteurs impliqués dans la pathogenèse de l’acné, tels que la dysbiose cutanée avec prédominance du phylotype IA1 Cutinobacterium acnes, un déclencheur de l’activation de l’immunité innée et de l’altération de la fonction barrière.
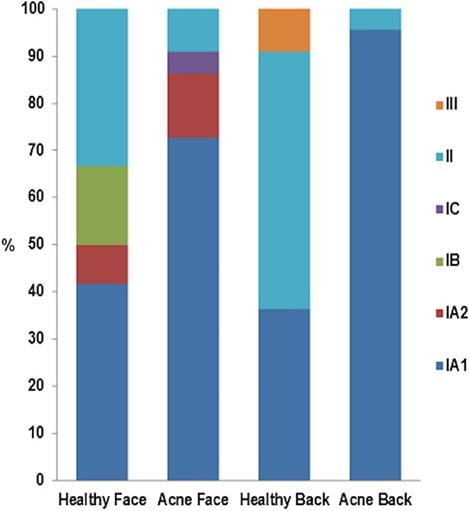
Figure 5. tiré de Dréno et al., The Skin Microbiome : A New Actor in Inflammatory Acne (doi: 10.1007/s40257-020-00531-1). La dysbiose est liée à la perte de diversité des phylotypes de C. acnes sur le visage et le dos des patients acnéiques [13]. Le phylotype IA1 (en bleu foncé) est abondant dans la peau acnéique. Reproduit de [13], avec l’aimable autorisation d’Acta-Dermato-Venerealogica, sous la licence Creative Commons (Attribution-NonCommercial 4.0 International, CC BY-NC 4.0).
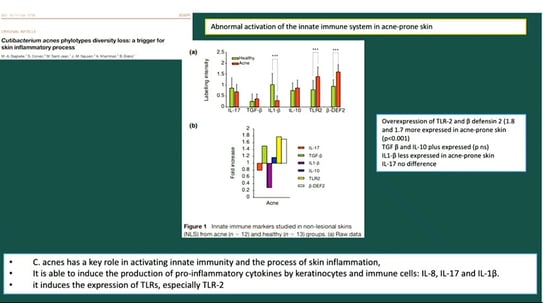
Figure 6. De la perte de diversité des phylotypes de Cutibacterium acnes : un déclencheur du processus inflammatoire de la peau.
Elle a également mis en évidence d’autres facteurs connus tels que l’hyperactivité des glandes sébacées et l’hyperkératose folliculaire.
Intervenant : Dr Iñigo de Felipe (Espagne)
Le Dr de Felipe a souligné le rôle des lasers dans le traitement de l’acné active et leur utilisation en parallèle d’un traitement médical.
Les directives classiques n’incluent pas les lasers dans la prise en charge de l’acné, uniquement les traitements oraux et topiques. Le traitement le plus répandu consiste à utiliser l’isotrétinoïne à fortes doses. Malgré tout, 32 % des patients présentent une récidive de l’acné à l’arrêt du traitement.
Le Dr de Felipe a traité des patients à l’aide d’isotrétinoïne et du laser Nd:YAP 1340 nm (4 à 5 séances) sans observer de récidive lors du suivi à long terme (5 ans). Dans sa pratique, sur 17 540 patients traités par isotrétinoïne à faible dose et laser 1340 nm/IPL, seuls 6,75 % ont connu une récidive après 12 mois.
Conclusion :
Intervenant : Professeur Victor Gabriel Glatici (Roumanie)
Le Pr Glatici a mis en évidence le rôle des lasers dans le traitement de l’acné. Ils servent à contrôler la prolifération de Cutibacterium acnes, à réduire la production de sébum (en détruisant ou en minimisant le nombre de glandes sébacées), à moduler la kératinisation des follicules pileux, la réponse immunitaire et inflammatoire. La combinaison de lasers avec un traitement médical offre les meilleurs résultats dans le traitement de l’acné. (Thiboutot D, Gollnick H, Bettoli V et al. New insights into the management of acne: an update from the global alliance to improve outcomes in acne group. J Am Acad Dermatol 2009; 60:51-60).
Les traitements de l’acné grâce au laser et à la lumière peuvent être une alternative au traitement médical pour les non-répondeurs et sont associés à des effets indésirables minimes. Ces dispositifs constituent également une option pour les patients souffrant d’acné modérée à sévère mais qui sont réticents vis-à-vis des médicaments oraux en raison de potentiels effets indésirables.
Avant tout traitement, il faut faire une bonne évaluation et bien s’adapter aux attentes du patient en lui indiquant le nombre de séances prévues et les résultats attendus. Il est important d’étudier toutes les publications en rapport avec l’appareil que vous utilisez en clinique et de tout savoir sur votre patient.
Intervenante : Dr Asma Sioud (Tunisie)
Voici une revue fantastique concernant l’utilisation des lasers dans l’acné qui met l’accent sur les nouveaux lasers de 1726 nm ayant une affinité avec les sébacées et ceux plus particulièrement adaptés aux phototypes élevés (Goldberg DJ, Andriessen A, Bhatia AC, et al. Treatment of mild to severe acne with 1726 nm laser: A safe alternative to traditional acne therapies. J Cosmet Dermatol. 2023;22(11):3026-3032. doi:10.1111/jocd.15964).
Tableau 1. Récapitulatif des procédures à base de lumière qui ont été utilisées dans l’acné inflammatoire. Extrait de (Goldberg DJ, Andriessen A, Bhatia AC, et al. Treatment of mild to severe acne with 1726 nm laser: A safe alternative to traditional acne therapies. J Cosmet Dermatol. 2023;22(11):3026-3032. doi:10.1111/jocd.15964).
| Appareil | Mode d’action | Effets indésirables |
|---|---|---|
| Laser CO2 fractionné | Photothermolyse des glandes sébacées | Douleurs, érythème, saignement, HPI passagère |
| Laser au potassium-titanyl-phosphate (KTP) | Lésion thermique des glandes sébacées, réduction de C. acnes | Aucun signalé |
| Laser à colorant pulsé (LCP) | Cible les vaisseaux sanguins du derme, augmente le facteur de croissance | Douleurs, érythème, œdème, desquamation, croûtes, cloques, HPI passagère |
| Laser infrarouge Nd : YAG 1064 nm | Destruction des glandes sébacées, réduction de la couche cornée périfolliculaire, réduction de l’inflammation | Érythème, sécheresse, brûlure, formation de croûtes, HPI passagère |
| Laser infrarouge Nd : YAG 1450 nm | Destruction des glandes sébacées | Érythème, œdème, HPI passagère |
| Laser infrarouge 1540 nm | Destruction des glandes sébacées | Érythème, œdème, sensation de chaleur |
| Laser fractionné non ablatif 1565 nm | Destruction des sébocytes, réduction de C. acnes | Érythème, œdème, croûtes, HPI passagère |
| Laser diode 800 nm avec microparticules d’or | Destruction sélective de l’infundibulum pilosébacé et des glandes grâce à des microparticules de silice recouvertes d’or avec une forte absorption à 800 nm | Érythème, généralement bien toléré |
| Lumière bleue 407–420 nm | Photoactivation des porphyrines bactériennes, réduit C. acnes, réduction de l’inflammation | Érythème, picotements |
| Lumière rouge 620–700 nm | Effets anti-inflammatoires | Peu d’effets indésirables en soi, gêne légère à sévère suite à l’utilisation d’un sensibilisant topique |
| Lumière intense pulsée (IPL) 400–1200 nm | Photothermolyse des glandes sébacées, activation des porphyrines bactériennes, réduction de C. acnes | HPI passagère, susceptible d’aggraver les lésions nodulokystiques |
| Thérapie photopneumatique (IPL avec aspiration) | Expulse les comédons par aspiration, destruction thermique des follicules, réduction de C. acnes | Érythème, œdème |
| Photothérapie dynamique (PDT) après application topique d’acide aminolévulinique (ALA) ou de méthylaminolévulinate (MAL) | Destruction des glandes sébacées ; réduction de C. acnes ; réduction de l’inflammation | Douleur (intolérable avec ALA 20 %), érythème, œdème |
Il existe de nombreux lasers et traitements à base de lumière susceptibles d’être utilisés dans la peau de couleur. Le laser 1726 nm est la meilleure option pour traiter l’acné sur tous les phototypes. Étant donné que le pic d’absorption de la glande sébacée se situe entre 1700 et 1720 nm, le laser de 1726 nm est particulièrement adapté au traitement de la glande sébacée mais très coûteux (Goldberg D, Kothare A, Doucette M, et al. Selective photothermolysis with a novel 1726 nm laser beam: A safe and effective solution for acne vulgaris. J Cosmet Dermatol. 2023;22(2):486-496. doi:10.1111/jocd.15602).
Il existe beaucoup d’autres options : il faut cependant adapter les longueurs d’onde à la peau de la couleur.
Peaux foncées à Les lasers infrarouges sont plus sûrs. Les lasers restent absents des recommandations concernant les options thérapeutiques dans l’acné en première et en deuxième intention.
D’autres études devraient être poursuivies non seulement à ce sujet, mais aussi pour inclure la couleur de la peau.
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Intervenant : Professeur Leonardo Marini (Italie)
Il est possible d’utiliser des dispositifs laser et à base d’énergie pour traiter les cicatrices. En effet, le laser et la lumière peuvent interagir avec la cicatrisation de différentes manières et au cours de différentes étapes. La meilleure approche thérapeutique consiste toujours en une stratégie de combinaison personnalisée puisque chaque cicatrice et chaque patient sont uniques. Le meilleur moment pour intervenir est le plus tôt possible (Figure 7).
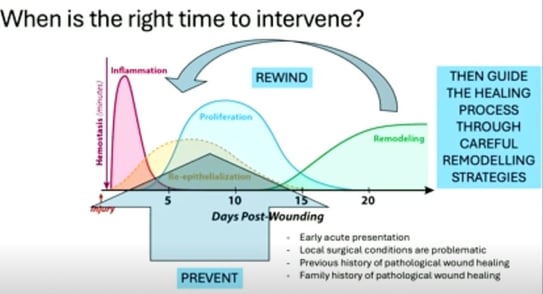
Figure 7. Illustration du moment où les lasers doivent être utilisés idéalement afin d’améliorer la cicatrisation.
Dans sa conférence, le professeur Marini a décrit l’utilisation de lasers picosecondes fractionnés et nanosecondes dans le traitement des cicatrices. Il s’agit de dispositifs à impulsions courtes dotés d’une lentille fractionnée. Ils créent une rupture optique induite par laser (LIOB) dans la peau en stimulant la production de collagène (Figure 8).
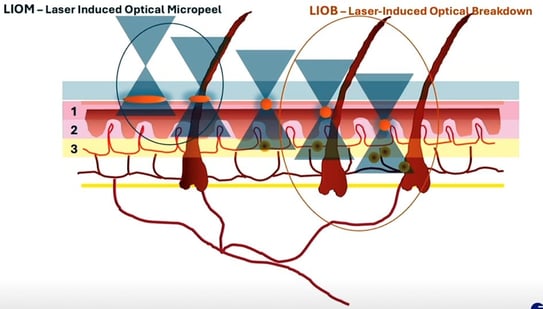
Figure 8. Différence entre le micropeeling optique induit par laser et la rupture optique induite par laser.
Dans le traitement et la prévention des chéloïdes et des cicatrices hypertrophiques, le Pr Marini l’associe aux corticostéroïdes et à l’imiquimod (Figure 9).

Figure 9. Protocole proposé par le Professeur Marini
Il l’associe également à la toxine botulinique A (BTX) hyper diluée afin de diminuer la tension de la cicatrice à la périphérie de celle-ci.
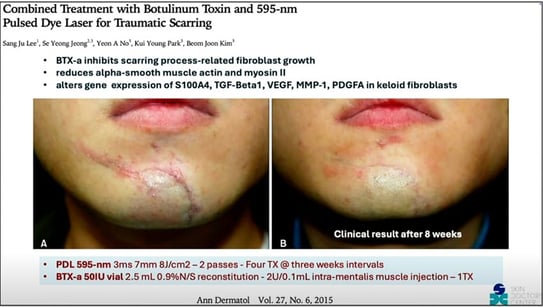
Figure 10. De Lee SJ, Jeong SY, No YA, Park KY, Kim BJ. Combined Treatment with Botulinum Toxin and 595-nm Pulsed Dye Laser for Traumatic Scarring. Ann Dermatol. 2015;27(6):756-758. doi:10.5021/ad.2015.27.6.756
Conclusion :
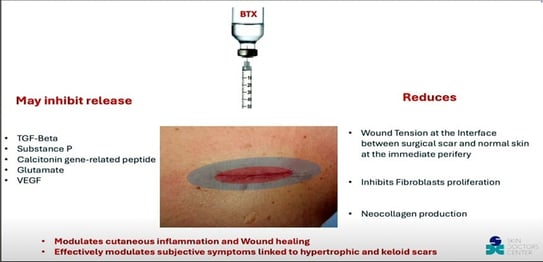
Figure 11. Avantages du BTX dans la prise en charge des cicatrices.
Intervenant : Dr Brian Hibler (États-Unis)
La conférence du Dr Hibler portait sur la manière de traiter les cicatrices lorsque l’on ne dispose pas d’un laser ou d’un appareil à base d’énergie. L’utilisation adéquate de crème solaire pour prévenir l’hyperpigmentation, un nettoyage adapté de la cicatrice pour prévenir l’infection et l’application de gels de silicone sont recommandés. En cas de cicatrices hypertrophiques et de chéloïdes, des médicaments intralésionnels tels que les corticostéroïdes et le 5-FU peuvent être utilisés pour contrôler le volume de la cicatrice.
La vitamine E, l’extrait d’oignon ou la trolamine ne sont pas suffisamment documentés, tout comme la cryothérapie.
Dans le cas des chéloïdes du lobe de l’oreille, le Dr Hibler associe la chirurgie à l’application topique d’une crème à 5 % d’imiquimod. Cette technique donne de bons résultats et l’association réduit le risque de récidive.
Pour l’acné et les cicatrices atrophiques, les rétinoïdes ont montré une amélioration de la texture et de l’aspect des cicatrices. Il a commenté une étude en hémi-face comparant les rétinoïdes au microneedling avec des résultats similaires (Figure 12).

Figure 12. Comparaison des rétinoïdes et du microneedling dans le traitement des cicatrices atrophiques
Autres outils utiles : la subcision, l’utilisation de peelings chimiques comme le TCA ou des techniques chirurgicales comme l’élévation/excision à l’emporte-pièce.
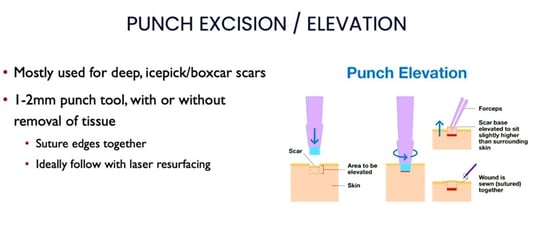
Figure 13. Protocole d’excision/élévation à l’emporte-pièce pour les cicatrices atrophiques.
Conclusions :
Intervenante : Dr Fatima Zahra Belgnaoui (Maroc)
Dans cette conférence, le Dr Zahra a souligné l’importance de la chirurgie dans notre domaine ainsi que l’importance de préparer la peau avant la chirurgie et d’effectuer une désinfection adéquate afin d’éviter autant que possible les infections (il semble que la chlorhexidine soit plus efficace que la povidone iodée pour cela). Ces mesures permettront d’améliorer la cicatrisation, de réduire les temps d’immobilisation et d’améliorer le résultat cosmétique.
Il est également important d’utiliser des sutures de faible diamètre et des techniques chirurgicales pour réduire la tension de la plaie et favoriser la cicatrisation. Une fois la plaie formée, des soins de la plaie appropriés, l’utilisation de gels de silicone ou le recours précoce au laser permettraient d’améliorer le résultat.
Intervenant : Dr Eugenio Gandolfi (Italie)
Le Dr Gandolfi a décrit un nouveau laser de poche à double longueur d’onde 1927 nm/1550 nm. La combinaison des deux améliore l’aspect des cicatrices et le fait qu’il soit portatif le rend plus facile à utiliser.
Il peut également être utilisé pour le traitement des vergetures, le resurfaçage non ablatif et faciliter la prise en charge de l’hyperpigmentation et du mélasma.
Intervenant : Dr Brian Berman (États-Unis)
Le Dr Berman a divisé sa conférence en 3 rubriques.
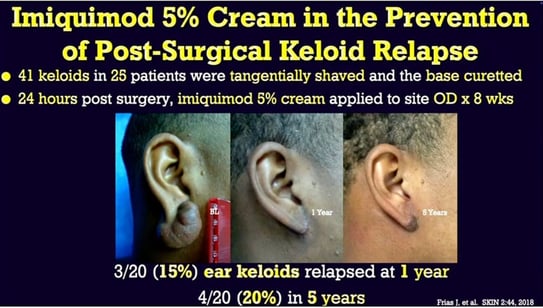
Figure 14. De Stashower ME. Successful treatment of earlobe keloids with imiquimod after tangential shave excision. Dermatol Surg. 2006;32(3):380-386. doi:10.1111/j.1524-4725.2006.32077.x

Figure 15. Yang et al. Annal Plastic Surgery 2024.
Avant la chirurgie, un seul traitement au laser Erbium glass 1540 nm, sur un site d’incision planifié, constitue une stratégie simple, sûre et indolore afin d’améliorer de façon significative l’aspect final de la cicatrice (Friedman et al. Laser pretreatment for the attenuation of planned surgical scars: A randomized self-controlled hemi-scar pilot study. J Plast Rec Aesth Surg 2020; 73 :893-898).
Le traitement à l’aide de lasers ablatifs était plus efficace que les lasers non ablatifs, mais avec une hyperpigmentation plus importante et un temps de cicatrisation plus long.
Le score du Global Acne Scarring System pour un traitement simultané à l’isotrétinoïne et au laser était significativement plus bas que pour le côté traité à l’isotrétinoïne et 6 mois plus tard au laser (Taleb et al. Lasers Surg Med. 2023).
Intervenant : Dr Michael H. Tirgan (États-Unis)
Le Dr Tirgan est un oncologue spécialisé dans le traitement des chéloïdes. Il ne recommande pas la chirurgie comme traitement de première intention en cas de chéloïde précoce, car elle est susceptible d’aggraver la situation. Le laser peut être utile mais il n’y a pas suffisamment de preuves à l’appui (Leszczynski R et al. Laser therapy for treating hypertrophic and keloid scars. Cochrane Database of systematic reviews. 2022; 9.CD011642)
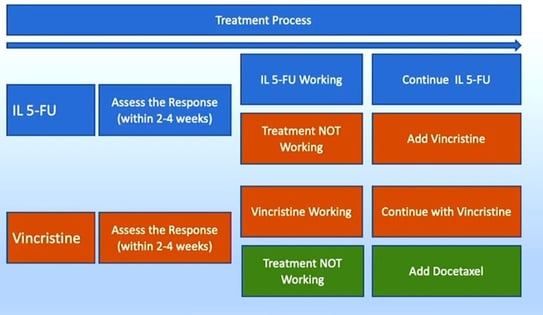
Figure 16. Proposition de protocole pour la chimiothérapie intralésionnelle.
Intervenant : Dr Albert Wolkerstorfer (Pays-Bas)
La façon dont les médicaments sont injectés dans les chéloïdes est importante pour éviter l’atrophie cutanée. Cela peut parfois s’avérer complexe. On sait peu de choses en ce qui concerne la biodistribution (Yin Q et al. The biodistribution of triamcinolone acetonide injections in severe keloids: an exploratory three-dimensional fluorescent cryomicrotome study. Arch Dermatol Res 2024. 8; 316-368) et il existe des astuces simples permettant de l’améliorer, telles que l’utilisation d’aiguilles et de seringues fines et l’application simultanée d’une cryothérapie de contact.
Intervenante : Dr Madiha Frikha Mseddi (Tunisie)
Le Dr Mseddi propose d’utiliser du phénol à 40 % en application hebdomadaire pour le traitement des chéloïdes. Elle emploie cette technique depuis 2010 (Mseddi M et al. Treatment of keloid with phenol: a new therapy. Ann Dermatol Venereol. 2014; 141: 493-499).
La phénolisation est un traitement innovant et prometteur qui permet une régression de plus de 60 % de la cicatrice dans 85 % des cas. Près d’un quart des patients voient leur cicatrice disparaître entièrement. Ce traitement est généralement bien toléré et a un caractère rassurant.
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Conférenciers : Rox Anderson, Jean Carruthers, Sebastian Cotofana
Intervenant : Professeur Sebastian Cotofana (États-Unis)
La conférence du professeur Cotofana portait sur l’anatomie des lèvres et sur la façon dont cette zone est l’une des premières que nous examinons. Il a souligné l’importance de localiser l’artère faciale (Cotofana S et al. Distribution pattern of the superior and inferior labial arteries: Impact for safe upper and lower lip augmentation procedures. Plast Reconstr Surg 2017. 139:1075-1082, Cotofana S et al. Anatomy of the Superior and Inferior Labial Arteries Revised: An ultrasound investigation and implication for Lip Voluminzation. Aesth Surg J. 2020; 40:1327-1335) et son rôle dans la technique d’injection (Ghannam S et al. Treating the lips and its anatomical correlate in respect to vascular compromise. Facial Plast Surg 2019; 35: 193-203).
Pour finir, il a parlé d’une étude récemment publiée portant sur les structures des lèvres et leur potentielle pertinence clinique (Cotofana S. et al. Intralabial Lip Compartments and their potential clinical relevance. Plast Reconstr Surg. 2023). (Figure 17)
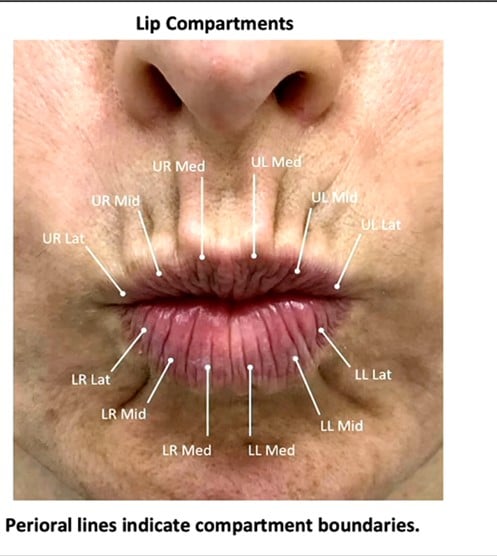
Figure 17. Les rides périorales permettent de localiser les différentes structures des lèvres.
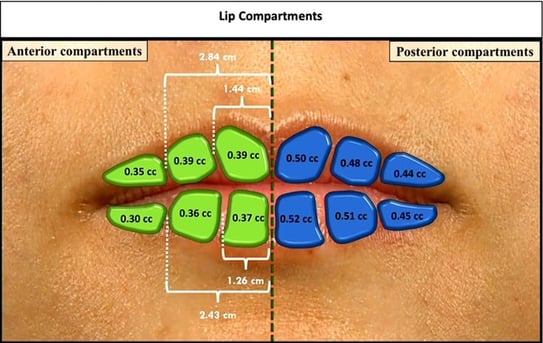
Figure 18. Structures des lèvres.
Il propose que l’injection soit faite dans la structure des lèvres avec une technique d’aiguille verticale pour éviter de rompre les parois entre les différentes structures (Figure 18).
Intervenante : Dr Jean Carruthers
Dans cette présentation, le Dr Carruthers explique comment elle et son mari, le Dr Carruthers, ont décrit l’utilisation de la toxine botulique à des fins cosmétiques pour le traitement des rides d’expression. Au début, on leur a dit que leur idée n’aboutirait pas, mais en 2022, 3 945 282 traitements par neuromodulateurs ont été effectués dans le monde.
Le Dr Carruthers propose que la toxine botulique, associée à d’autres traitements, prolonge les résultats esthétiques.
Elle propose d’injecter dans le muscle platysma et le muscle abaisseur de l’angle de la bouche avant de traiter avec un dispositif à base d’énergie dans le tiers inférieur et le cou, afin d’améliorer les résultats.
Intervenant : Dr Richard Rox Anderson (États-Unis)
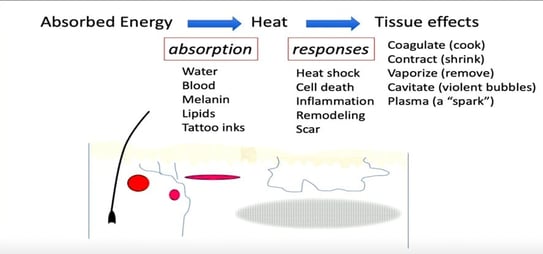
Figure 19. Récapitulatif des principaux effets sur la peau avec les dispositifs à base d’énergie.
En 1983, le Dr Anderson a publié un article révolutionnaire intitulé « Photothermolyse sélective » et, au départ, les gens pensaient qu’il était fou. Il constitue pourtant la base de tous les dispositifs à base d’énergie disponibles aujourd’hui.
Quelles nouveautés ?
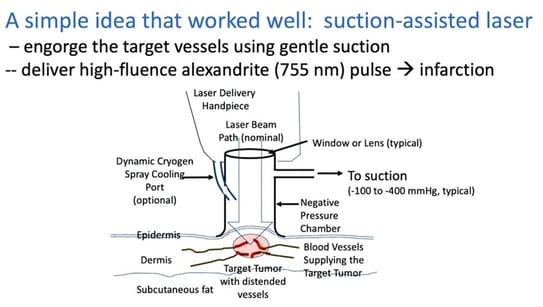
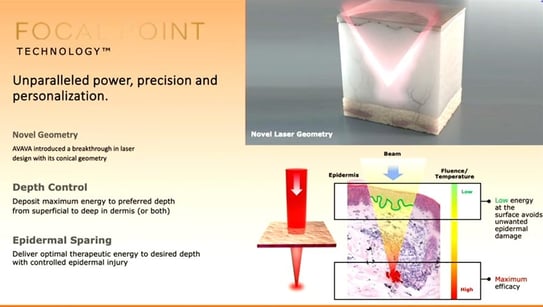
Intervenante : Dr Meryem Ozlem Ozturk (Turquie)
Ces produits ont été étudiés après injection chez des patients transplantés rénaux et des témoins en bonne santé. On utilise 0,5 ml d’acide hyaluronique au niveau de l’arcade zygomatique. Aucune complication n’a été observée ni dans le groupe des patients greffés ni dans le groupe témoin après 6 mois de suivi. La fréquence des effets indésirables était similaire. Les procédures d’injection d’AH peuvent être appliquées en toute sécurité à ces groupes de patients.
Intervenante : Dr Armeela Javaid (Pakistan)
Le bimatoprost 0,03 % a reçu l’approbation de la FDA pour la croissance des cils. Son efficacité et son innocuité ont été étudiées. Il s’agit d’un analogue structurel de la prostaglandine F2. Il est destiné à être utilisé par voie topique et non comme collyre. Il offre une croissance progressive avec des résultats optimaux en 16 semaines.
Le Dr Javaid a recruté 45 patients qui ont appliqué la solution quotidiennement pendant 120 jours. 80 % des patients ont obtenu des cils plus foncés et plus longs. Seuls 4 patients présentaient une légère sécheresse oculaire et des irritations. Le profil d’innocuité était bon.
Intervenant : Dr Maximiliano Maass (Chili)
Le Dr Maass a proposé l’utilisation de stéroïdes intralésionnels (0,1 ml d’acétonide de triamcinolone sur les côtés latéraux au niveau du pli proximal de l’ongle) après une avulsion chirurgicale, afin de prévenir la récidive et les événements indésirables (dystrophie de l’ongle, anomalies de croissance, etc.) et une étude a été menée afin de comparer l’avulsion totale de l’ongle et l’avulsion totale associée à l’injection de corticostéroïdes.
Les résultats préliminaires suggèrent que cette approche combinée peut réduire l’incidence de la dystrophie post-chirurgicale de l’ongle. Les résultats doivent être confirmés par le biais d’essais contrôlés randomisés prospectifs avec des échantillons de plus grande taille.
Intervenant : Dr Saud Aleissa (États-Unis)
L’injection par jet fonctionne par diffusion active, en poussant un flux de liquide à travers une buse de précision. La vitesse et la pression élevées du liquide lui permettent de pénétrer dans un réseau en forme de toile. Une étude a été menée auprès de 15 patients atteints de carcinome basocellulaire qui ont reçu la photothérapie dynamique avec injection par jet (4 PDT + excision et 11 x 2 séances de PDT espacées de 4 à 6 semaines) avec des résultats prometteurs.
Intervenante : Dr Maxine Bennek (Allemagne)
Une étude en hémiface a été menée. D’un côté du visage, on a injecté de l’onabotulinum ou de l’abobotulinum toxine A et de l’autre du letibotulinum, avant de comparer leur capacité de diffusion. Les conclusions indiquent qu’il faut tenir compte des différences au niveau des caractéristiques de diffusion, en particulier lors du changement de produit. Le letibotulinumtoxinA est une toxine très précise et ciblée dont il est possible de prévoir la diffusion.
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Intervenant : Professeur Pablo Boixeda (Espagne)
Avant de traiter ces maladies, il est important de poser un diagnostic précis. Le professeur Boixeda propose quelques principes à appliquer dans le traitement des manifestations cutanées dans les maladies systémiques :
Granulome facial : il peut être traité au laser picoseconde, au laser ablatif, et même au laser vasculaire.
Nécrobiose lipoïdique : le laser à colorant pulsé peut être utilisé mais en utilisant un faisceau large et de longues impulsions. Le critère d’évaluation est l’érythème. Il est conseillé d’utiliser des paramètres sous-purpuriques afin d’éviter les ulcérations.
Sarcoïdose : les lésions chroniques du visage peuvent être traitées au PDL en combinaison avec un laser CO2.
Hidradénite suppurée :

Psoriasis : il s’agit d’un traitement de 2e ligne, mais il peut être utile en cas de psoriasis de l’ongle.
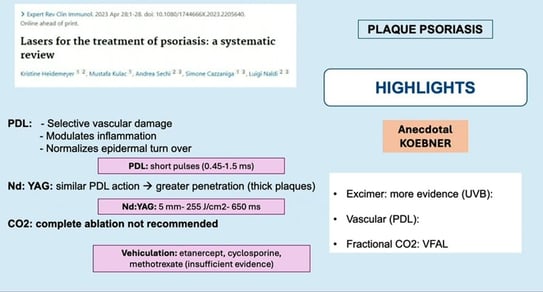
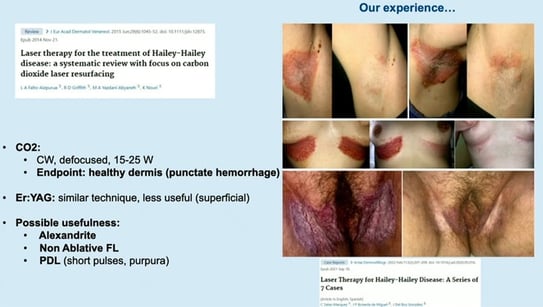
Haley-Haley:
Lupus :

Conclusion : Le laser doit être utilisé avec prudence, en particulier dans les phototypes élevés.
La plupart des preuves consistent en des rapports de cas et de petites séries de cas. Des études plus importantes sont nécessaires pour déterminer l’efficacité de ces traitements.
Intervenant : Dr Claudio Marasca (Italie)
Le terme pseudotumeur englobe les affections dermatologiques qui ne sont pas de véritables proliférations, mais qui ont une ressemblance clinique avec une tumeur connue.
Le nævus mélanocytaire récurrent est défini comme la prolifération des mélanocytes restants, qui se produit après l’ablation partielle d’un nævus mélanocytaire, ce qui entraîne une repigmentation sur le site de l’excision précédente.
Les lésions exophytiques peuvent être traitées à l’aide de lasers ablatifs tandis que les lésions plates peuvent être traitées à l’aide de nano ou picolasers. Des récidives peuvent survenir chez 2 % des patients, en particulier lorsque l’on traite des nævus intradermiques.
La survenue de nævi récurrents était inversement associée à une augmentation de l’âge du patient, à des phototypes plus foncés et à un nævus dermique. Présence d’une couleur brun foncé, de multiples couleurs, de points, de poils terminaux et d’une pigmentation annulaire répartie autour des structures annexes. Mais comment différencier les nævi récurrents du mélanome récurrent ? Grâce à leurs schémas dermoscopiques caractéristiques.
Nævi congénitaux : plus de 4 ans de suivi sont nécessaires pour évaluer l’efficacité des lasers dans le NMC, l’excision partielle et le traitement combiné au laser pouvant représenter une option thérapeutique efficace.
Nævi mélanocytaires après épilation au laser : ils peuvent présenter certains changements dermatoscopiques tels que des taches pigmentaires avec formation de croûte, des taches pigmentaires avec perte ultérieure de réseau pigmentaire, un réseau pigmentaire asymétrique avec des points gris-bleu et un voile rouge laiteux, des zones bleu-gris, une perte de réseau pigmentaire et une morphologie en « grain de poivre ». Le retard ou l’erreur de diagnostic est souvent dû au fait que le pathologiste ne sait pas que la lésion a subi un traitement destructeur local et qu’il diagnostique donc un mélanome au lieu d’un pseudomélanome.
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Intervenante : Dr Monika Fida (Albanie)
Les rougeurs du visage représentent un large éventail de diagnostics différentiels et, s’il s’agit dans la plupart des cas d’une maladie bénigne (rosacée, dermatite séborrhéique ou photodermatose), il ne faut cependant pas oublier les autres causes possibles telles que les réactions médicamenteuses, le syndrome carcinoïde, etc.
Le diagnostic différentiel de la dermatose la plus fréquente est présenté dans le tableau ci-dessous :
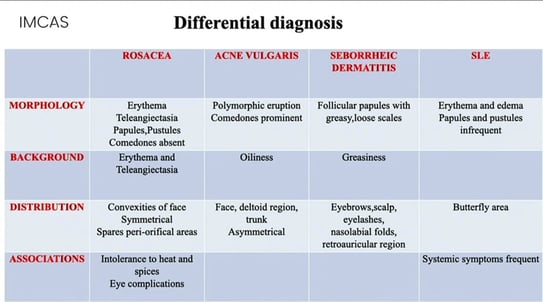
Le Dr Fida a décrit les traitements les plus courants et son approche de la rosacée (antibiotiques, topiques avec de l’acide azélaïque, antibiotiques et nettoyant doux et lasers), de la dermatite séborrhéique (faible taux de corticostéroïdes topiques, agents antifongiques topiques, inhibiteurs de la calcineurine topiques et dans les cas résistants, un test de dépistage du VIH et de l’itraconazole par voie orale peuvent être un traitement efficace), de la dermatite atopique (corticostéroïdes topiques, immunosuppresseurs, anti-interleukine 4 et 13, inhibiteurs de JAK, etc.), du psoriasis et du lupus.
Informations à retenir
La prise en charge de l’érythème facial peut être frustrante tant pour les patients que pour le dermatologue.
La clé du succès consiste à établir un diagnostic clair et à aider le patient à respecter l’observance du traitement.
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Intervenante : Dr Yaryna Turkevych (Ukraine)
Le Dr Turkevych a parlé des stimulateurs de collagène qu’elle divise en deux groupes :
Conclusion :
Il n’existe pas de stimulateurs directs du collagène, qui peuvent provoquer une néocollagenèse physiologique. Si l’on utilise de l’hydroxyapatite de calcium, de l’acide L-polylactique et des dispositifs à base d’énergie, il est nécessaire de les combiner avec des polynucléotides et des exosomes pour des résultats plus naturels et physiologiques. Nous avons encore beaucoup de choses à étudier et à apprendre dans le domaine de la médecine pré-vieillissement.
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Intervenant : Dr Arnaud Lambert (France)
Le Dr Lambert a parlé de l’IPL comme étant le dispositif à base d’énergie le plus acheté en France. Selon lui, cela tient aux possibilités de location et à sa polyvalence (on peut cibler la mélanine et les vaisseaux sanguins).
Dans cet exposé, il défend cet appareil parce qu’il est abordable, accessible et très polyvalent. Les combinaisons sont toujours une bonne idée.
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Intervenant : Dr Alexandre Filippo (Brésil)
Le mode tonifiant avec nano et picolaser favorise la diminution du nombre de dendrites mélanocytaires, la modification de la structure et de la taille des mélanosomes et la cavitation du derme.
Le Dr Filippo propose sa technique de traitement de l’HPI : il combine le mode tonifiant (7 mm fluence 0,6-0,8 J avec plusieurs passages lents) et le mode fractionné (fluence 6x6 1,5 J) afin d’améliorer la matrice extracellulaire.
Il utilise cette approche pour tous les troubles de la pigmentation.
Conclusions
- Les troubles chroniques de la pigmentation restent complexes.
- Les attentes des patients doivent être encadrées et revues à la baisse.
- Le formulaire de consentement et la documentation photographique jouent un rôle très important.
Rapports rédigés par le Dr Ana Reymundo (dermatologue, Espagne)
Intervenant : Dr Paolo Bonan (Italie)
La technologie par micro-ondes peut être utilisée pour traiter les graisses localisées, la cellulite et la laxité cutanée. Elle peut pénétrer en profondeur dans la peau pour traiter les graisses de manière plus sélective et sans endommager l’épiderme (Bennardo L et al. Microwave Therapy for Cellulite: An effective non-invasive treatment. J Clin Med 2022. 11; 515; Nistico SP et al. A new treatment protocol to treat abdominal subcutaneous fat combining microwaves and flat magnetic stimulation. Bioengineering. 2022; 21:182; Zappia E. et al. An innovative microwave technology for the treatment of submental skin laxity. Lasers Med Sci 2025; 40:28). La chaleur générée permet également d’induire la production de collagène et d’améliorer le grain de peau.
Elle peut être associée à un laser CO2 et une diode non ablative 1540 nm, ainsi qu’à des produits de comblement, afin d’augmenter la prolifération des pré-adipocytes.
Intervenant : Dr Anil Ganjoo (Inde)
La technique de resurfaçage a évolué pour passer de l’ablatif conventionnel au non ablatif conventionnel puis à l’ablatif fractionné et du non ablatif à la radiofréquence par microneedling puis à la RF subablative et, désormais, à la RF nano-subablative. Cette évolution résulte de la recherche d’une technique de resurfaçage dépourvue d’effets indésirables, dans la mesure du possible, tout en produisant des résultats optimaux.
Intervenant : Dr Anthony Rossi (États-Unis)
L’intervention du Dr Rossi portait sur la possibilité de combiner différentes technologies telles que la toxine botulique, les produits de comblement et les lasers ablatifs. Il a montré différents cas pour lesquels il effectue les 3 procédures en une seule séance. Il commence par la toxine dans le plan musculaire, puis l’anesthésie topique, les produits de comblement et, enfin, les lasers. Comme il travaille sur différents plans (musculaire, sous-cutané et dermique), il peut effectuer sans problème les 3 procédures en même temps (Dempsey A et al. Practice patterns regarding combination treatments and laser and energy-based devices: A survey of American Society for Laser Medicine and Surgery Members. Lasers Surg Med 2023. 55:16-21).
Intervenant : Dr Neeraj Pandey (Singapour)
Au fil des ans et grâce à l’évolution des technologies, le laser est devenu un appareil indispensable, irremplaçable et omniprésent dans la pratique moderne de la dermatologie. À l’heure actuelle, de nouveaux dispositifs sont en cours de développement afin de traiter différents types de maladies.
Les lasers, déjà utilisés, évoluent pour être plus efficaces et utiles dans de nombreux autres troubles.
Certaines utilisations non conventionnelles des lasers sont :
Informations à retenir
Intervenante : Dr Anjali Mahto (Royaume-Uni)
L’approche multimodale est fortement recommandée dans le traitement des cicatrices d’acné. Elle offre des effets synergiques pour des résultats supérieurs (on peut traiter les irrégularités de texture, les pertes de volume et les modifications de la pigmentation).
Le protocole du Dr Mahto consiste à appliquer un polynucléotide avec une subcision douce à la canule afin d’améliorer l’hydratation et l’élasticité en 2 séances, à 2 semaines d’intervalle. Elle utilise le laser pour effectuer un traitement de resurfaçage. Par la suite, elle applique des exosomes topiques pour améliorer la cicatrisation et réduire le temps d’immobilisation.
Les polynucléotides stimulent l’activité des fibroblastes et la synthèse du collagène, améliorent l’hydratation et l’élasticité et favorisent le remodelage de la matrice extracellulaire. Ils agissent comme un soin préparateur du derme.
Les exosomes sont des vésicules extracellulaires riches en facteurs de croissance et en cytokines qui réduisent l’inflammation et l’érythème et améliorent la synthèse du collagène et la réparation du derme. Appliqués après le laser, ils peuvent accélérer la cicatrisation et améliorer la texture, le tonus et les temps de guérison des cicatrices.
Par conséquent, la combinaison de ces trois technologies peut permettre de réduire le nombre de séances et d’améliorer les résultats pour les patients.
Intervenant : Dr Sang Ju Lee (Corée)
Dans cette conférence, le Dr Lee a évoqué les différentes options thérapeutiques pouvant être utilisées pour traiter les vergetures.
Le microneedling, le laser non ablatif fractionné et le laser ablatif fractionné sont tous efficaces contre les vergetures. Parmi ces trois méthodes, le laser ablatif CO2 fractionné était le plus efficace.
L’application de 30 µm de PLLA après un laser ablatif fractionné s’est avérée plus efficace que le laser seul.
Intervenante : Dr Dianne Quibel (États-Unis)
Le Dr Quibel a parlé de la combinaison de différents lasers et dispositifs à base d’énergie en fonction de la couche de peau que l’on souhaite traiter. Dans certains cas, l’association avec les peelings, la toxine botulique, les corticoïdes, la vaporisation peut être très utile.
Rapports rédigés par le Dr Lidiya Todorova (dermatologue, Bulgarie)
Conférenciers : Dr Muriel CREUSOT (dermatologue, Belgique) et Dr Alessio REDAELLI (MD, Italie)
Il s’agissait d’une table ronde axée sur les boosters cutanés, au cours de laquelle des experts ont donné leur avis et leurs recommandations, étayés scientifiquement. Les boosters cutanés sont plus qu’une simple tendance beauté ; il s’agit de traitements scientifiquement prouvés qui renforcent l’hydratation, stimulent la production de collagène et améliorent le grain de peau. Qu’ils soient utilisés seuls ou en combinaison avec d’autres actes esthétiques, ils offrent des avantages significatifs sans risque de fibrose. Au fur et à mesure que les recherches avancent, leur rôle en dermatologie et en médecine régénérative devrait encore s’étendre.
Cette session a pris la forme d’une table ronde à laquelle ont participé des représentants de fabricants de boosters cutanés, dont le Dr Alessio REDAELLI, qui a présenté le thème, le Dr Aude BERNARDIN (Allergan Aesthetics), le Dr Natalia SUKMANSKAYA (Fillmed), Xiaoming LIN (Galderma), le Dr Mimi Rosealie BORRELLI (Merz Aesthetics), le Dr Silvia INNOCENTI (Relife) et le Dr Jimmy FAIVRE (Teoxane).
Après une brève présentation de chacun d’entre eux, le Dr Redaelli a lancé la discussion avec un bref aperçu de chaque produit présenté (détails dans le tableau ci-dessous) :
| Société | Nom de la marque | Indications | Principes actifs |
|---|---|---|---|
| Allergan Aesthetics, une société AbbVie | Juvéderm® VOLITE™ | Ridules et grain de peau | Acide hyaluronique (AH) réticulé, 12 mg/ml, avec lidocaïne (0,3 % m/m) |
| Laboratoires FILLMED | NCTF® 135 HA | Régénération et hydratation intenses des peaux fatiguées ou ternes, comblement des rides superficielles et redensification cutanée | 60 principes actifs essentiels choisis pour leur rôle dans le métabolisme cutané à un dosage précis |
| Galderma Laboratories, L.P. Fort Worth | Restylane® Skinboosters™ Vital, Lidocaïne Vital, Lidocaïne Vital Light | Indications relatives au visage et aux autres parties du corps pour Restylane® Skinboosters™ | AH fabriqué à l’aide de la technologie NASHA (acide hyaluronique stabilisé d’origine non animale) |
| Merz Aesthetics | Belotero Revive® (HA20G ; CPM-HA ; Belotero Revive®) | Amélioration globale de la qualité de la peau et régénération, hydratation, élasticité et fermeté de la peau. Lisser les ridules et les rides superficielles du visage | Glycérol avec une matrice cohésive poly-densifiée d’acide hyaluronique (AH) à une concentration de 20G |
| Teoxanne | RHA®1 | Correction des rides superficielles du visage et de la qualité de la peau | 15 mg/g AH de haut poids moléculaire (4 MDa) |
| Relife | Hydrobooster Definisse™ | Signes de l’âge, préservation de l’hydratation, amélioration du tonus et de l’élasticité, rides du sourire | Hyaluronate de sodium non animal de haut poids moléculaire (> 3 millions Da), obtenu à partir de Streptococcus equi |
La table ronde a commencé par une discussion animée, suivie de questions posées en ligne et sur place, dans la salle de conférence. Les premières questions posées étaient les suivantes : les boosters cutanés sont un mythe ou une réalité, comment fonctionnent-ils et comment tiennent-ils vraiment leurs promesses ? En effet, depuis un certain temps, les boosters cutanés sont devenus un acteur clé de la dermatologie esthétique, promettant une amélioration du grain de peau, de l’hydratation et de la stimulation du collagène. Tous les représentants des marques ont confirmé non seulement que ces produits injectables améliorent la texture et l’hydratation de la peau en stimulant l’aquaporine 3, et qu’ils améliorent également l’élasticité de la peau et de l’activité des fibroblastes qui stimulent la production de collagène et la matrice extracellulaire (MEC). Les qualités hydratantes des boosters cutanés peuvent également s’expliquer par la capacité naturelle de l’acide hyaluronique à attirer l’eau. De nouveaux essais cliniques confirment la formation de nouveau collagène, tandis que l’examen par ultrasons prouve l’amélioration de la texture, de l’hydratation et de l’épaisseur de la peau. De plus, les boosters cutanés améliorent également la régulation du derme, les sensations cutanées ainsi que la fonction barrière, et peuvent accélérer les processus de cicatrisation des plaies. En effet, des études ex vivo et in vitro montrent que les fibroblastes migrent vers les gels d’acide hyaluronique en l’espace de deux semaines et qu’ils sont donc capables de former de nouveaux tissus.
La question suivante portait sur la stimulation du collagène. La capacité des boosters cutanés à stimuler la production de collagène est un facteur clé de leur efficacité dans le rajeunissement de la peau. Les marques ont exploré l’influence de leurs formulations sur la synthèse du collagène et la qualité de la peau, avec des résultats prometteurs. Les boosters cutanés stimulent la production de pro-collagène, du collagène de types 1 et 3, et ce, sans induire la formation de tissu fibrotique. Des études ont montré une légère inflammation lors de l’injection dans des modèles animaux et en conditions ex vivo. Cependant, il n’y a pas de tissu cicatriciel fibrotique notable autour du gel, ce qui favorise la formation naturelle de collagène. Il a également été mentionné que les boosters cutanés stimulent la production de collagène en occupant de l’espace dans le derme. Lors de l’injection, la première réponse implique la production de collagène 3 (associée à la cicatrisation), suivie par la synthèse de collagène 1.
En termes de volumisation, les experts ont convenu que, tout en agissant principalement comme des biostimulateurs, les boosters cutanés exercent également une action mécanique en étirant et en créant du volume dans les défauts cutanés afin de produire un effet repulpant grâce à la rétention d’eau et, bien sûr, à la stimulation du collagène, qui améliore la densité de la peau et permet la formation de davantage de tissus dans le même espace.
La discussion a ensuite porté sur le mode d’action. Les boosters cutanés fonctionnent grâce à des signaux de transduction mécanique, qui augmentent la teneur en eau dans la peau. Cette modification de l’hydratation altère les propriétés mécaniques des fibroblastes, ce qui favorise une synthèse accrue du collagène.
Qu’en est-il des traitements combinés ? De nombreux présents à la table ronde recommandent de combiner les boosters cutanés avec des produits de comblement à base d’acide hyaluronique pour obtenir des résultats esthétiques complets. Les boosters cutanés peuvent être appliqués sur les couches superficielles de la peau pour en améliorer l’éclat et la brillance, tandis que des produits de comblement ajoutent du volume. Ces traitements peuvent être réalisés en une seule séance pour des effets optimaux. La combinaison de boosters cutanés avec le NCTF est également une bonne option afin de réduire les complications et les effets indésirables. La combinaison avec des lasers a également été suggérée, où les traitements au laser sont effectués avant les injections de booster cutané afin de préparer la peau. Les traitements combinés améliorent les résultats globaux et doivent être définis individuellement.
Les boosters cutanés ont-ils un effet sur les tissus sous-cutanés ? Ils ne stimulent pas directement les adipocytes. Cependant, l’acide hyaluronique stimule les fibroblastes à l’intérieur du tissu adipeux, ce qui contribue ensuite à la régénération et à la réparation de la peau.
Une question très contemporaine et actuelle a été posée concernant l’utilisation de boosters cutanés chez les patients traités par semaglutide, qui reste toutefois un domaine de recherche en cours. Ce médicament antidiabétique étant relativement nouveau, il n’existe pas de lignes directrices définitives concernant l’intégration des boosters cutanés dans le schéma thérapeutique. Les recommandations actuelles préconisent une évaluation individuelle du patient afin de déterminer le moment et l’approche appropriés.
Dans l’ensemble, la session a fourni des informations inégalées sur le fonctionnement des boosters de peau et sur la raison pour laquelle ils jouent un rôle essentiel en médecine esthétique en stimulant la production de collagène, en renforçant l’hydratation et en améliorant l’élasticité de la peau. Ils peuvent être efficacement combinés avec des produits de comblement à base d’AH, des traitements au laser et d’autres thérapies régénératrices pour un rajeunissement complet de la peau. Grâce aux recherches en cours et aux applications cliniques émergentes, les boosters cutanés continuent de prouver leur efficacité pour améliorer la qualité de la peau et les résultats esthétiques globaux.
Rapports rédigés par le Dr Lidiya Todorova (dermatologue, Bulgarie)
Intervenant : Dr Monika Fida (Albanie)
Le Dr Monika Fida, dermatologue albanaise réputée, a donné une conférence hautement scientifique sur le thème très actuel des exosomes. Elle a expliqué que dans la nature, les exosomes sont une sous-population de vésicules extracellulaires (VE), de particules de taille nanométrique, enfermées dans une couche lipidique, naturellement sécrétées par les cellules après la fusion de corps multivésiculaires intracellulaires avec la membrane plasmique. Les expériences au cours desquelles les VE ont été spécifiquement identifiées comme des « entités biologiques porteuses d’un potentiel enzymatique et fonctionnel » ont débuté dans les années 80 et le terme a été inventé à cette époque.
Par rapport à un traitement dermatologique traditionnel, la thérapie par exosomes acellulaires offre plusieurs avantages : administration ciblée, faible toxicité, réparation des tissus, traitement personnalisé et fonctionnalités multiples, notamment :
Ces avantages font de la thérapie à base d’exosomes une nouvelle méthode prometteuse et relativement sûre pour l’approche thérapeutique individuelle de diverses pathologies cutanées [1], [2].
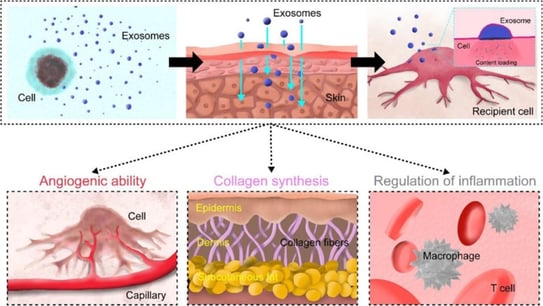
Figure 20. « Représentation schématique montrant les capacités régénératrices des exosomes sur la peau » [3]
Actuellement, les exosomes sont cliniquement efficaces pour la cicatrisation des plaies et des cicatrices, ainsi que dans leur application comme traitement anti-âge, mais la recherche sur les pathologies cutanées inflammatoires et auto-immunes en est encore au stade préclinique.
Les études réalisées confirment leur efficacité dans l’amélioration des rides, de l’élasticité, de l’hydratation et de la pigmentation de la peau. Il est également prouvé qu’ils potentialisent d’autres traitements tels que les lasers CO2 fractionnés pour traiter les cicatrices d’acné.
Fonctionnement des exosomes dans différentes conditions :
Indiscutablement, les exosomes sont l’avenir de la médecine régénérative. Mais quels sont les défis actuels liés à ces traitements ?
Pour conclure, le Dr Fida a souligné que les exosomes sont prometteurs pour la régénération tissulaire, le rajeunissement cutané et les thérapies ciblées, mais que des recherches supplémentaires sont nécessaires pour optimiser leur efficacité en vue d’une utilisation clinique.
Articles utilisés par le Dr Fida lors de sa présentation :
Intervenante : Dr Atchima Suwanchinda (Thaïlande)
Résumé de la conférence : Exosomes de donneurs jeunes ou âgés : quelles sont leurs capacités régénératrices et leurs implications cliniques ? Les exosomes dérivés de cellules souches mésenchymateuses adipeuses (CSMA) ont été explorés pour déterminer de quelle manière l’âge des donneurs affecte leurs profils moléculaires. Les recherches actuelles, présentées par le Dr Suwanchinda, vice-présidente de la Société internationale de chirurgie dermatologique et de l’Association for Dermatologic Surgery en Thaïlande, révèlent les principales différences qui existent entre les exosomes des donneurs jeunes et ceux des donneurs âgés. Les exosomes plus jeunes montrent un plus grand potentiel de régénération en raison de niveaux plus élevés de cytokines et de facteurs de croissance, tandis que les exosomes plus âgés conservent leur fonctionnalité mais présentent une diminution des capacités de régénération. Ces résultats pourraient jouer un rôle clé dans l’application future des exosomes en termes de personnalisation des soins et d’indications thérapeutiques.
Quelles sont les différences entre les exosomes issus de donneurs jeunes et âgés ? Ces différences ont-elles un impact sur leur capacité de régénération ? Ces questions ont été abordées dans le cadre de recherches récentes présentées par le Dr Suwanchinda. Son étude explore la qualité des exosomes dérivés des CSMA par rapport à l’âge du donneur, en mettant en lumière leurs caractéristiques fonctionnelles et leurs applications cliniques potentielles.
Les principales conclusions concernant leurs différences structurelles et fonctionnelles sont les suivantes :
L’analyse du profil des cytokines des groupes étudiés a révélé les éléments suivants :
Lorsque le groupe de chercheurs dirigé par le Dr Suwanchinda a comparé le potentiel de régénération des exosomes issus de donneurs jeunes et âgés, il a fait les observations intéressantes suivantes :
Les marqueurs de sénescence et de vieillissement ont été estimés par la mesure de cytokines telles que l’IL-6, l’IL-10 et l’IL-18. Ils ne présentaient aucune différence relative à l’âge, de sorte que leur activité anti-inflammatoire et pro-inflammatoire exosomique peut être maintenue tout au long de la vie. Lors de la mesure de Jagged1 (ligand majeur de la voie de signalisation NOTCH), responsable de la régénération des tissus, de la cicatrisation des plaies et de l’angiogenèse, les scientifiques ont établi qu’elle avait diminué avec l’âge. Cela suggère donc une réduction du potentiel de régénération liée au vieillissement.
Les principales applications cliniques de ces résultats sont les suivantes :
Conclusions :
Les dernières réflexions du Dr Suwanchinda ont mis en évidence les possibilités passionnantes qu’offre la thérapie par exosomes pour la médecine régénérative, la lutte contre le vieillissement et le contrôle de l’inflammation. Alors que les exosomes jeunes présentent un potentiel de régénération supérieur, les exosomes plus âgés ont toujours une valeur thérapeutique significative. Il est essentiel de comprendre et d’optimiser la composition des exosomes afin de pouvoir développer tout leur potentiel clinique.
Rapport écrit par Dr Marina THOMAS (Dermatologue, France)
D’après les communications des Dr Todd SCHLESINGER (Etats-Unis), Diane Irvine DUNCAN (Etats-Unis), Hernan PINTO (Argentine), Tunc TIRYAKI (Royaume-Unis), Hema SUNDARAM (Etats-Unis), et Monika FIDA (Albanie).
Actuellement il y a toujours un vide en termes de régulation, selon les pays, les règles s’appliquent en fonction de mode d’utilisation, de provenance, d’effets supposés.
Aux USA, ils sont commercialisés sous forme topique, uniquement pour un usage cosmétique actuellement, sans approbation de la FDA mais avec une tolérance. Pour l’instant les exosomes ne sont pas autorisés en Europe à visée cosmétique car la législation interdit les produits d’origine humaine pour cet usage. On imagine une approbation par la FDA sous 3 ans dans des indications systémiques gastrointestinales et infectieuses. Les exosomes de synthèses sont à l’essai notamment en cardiologie et en oncologie. A Taiwan, en Corée du Sud et au Japon, les exosomes d’origine humaine sont autorisés comme cosmétiques.
Pour les novices : ces nanoparticules sont une sous population de vésicules extracellulaires, de la taille d’un virus, sont produites par toutes les cellules et servent à faire transiter des signaux dans les tissus (paracrines, modulation de l’expression phénotypique…) jusqu’ aux cellules cibles par endocytose, où elles induisent une réponse transcriptionnelle.
A l’intérieur de ces « morceaux choisis » de cellules, on retrouve pêle-mêle des protéines, de l’ADN, des lipides, des micro-ARNs... Et à la surface de la bicouche lipidique (issue de la fusion d’endosome avec la membrane plasmatique), différents récepteurs membranaires d’amarrage (VEGF, TNF-R, IL10, etc…)
Un exosome humain contient plus de 1500 micro-ARNs différents. Le rôle et l’efficacité des cellules souches dépend de la production et de l’envoi de ces exosomes. Les micro-ARNs ainsi délivrés permettent de réguler l’expression génique (transcription, traduction et conformation, silencing).
On pourrait presque comparer l’exosome à un extrait sec de cellule souche : un produit inerte transportable, plus facile à stocker et à stériliser.
Du fait de sa taille nanoscopique, l’exosome ne comporte pas de marqueur HLA différencié, n’induit pas de réaction immunitaire, s’affranchit donc des barrières d’espèces. Il porte cependant des protéines membranaires permettant l’accostage sur la cellule cible. Il ne comporte pas les risques de cytotoxicité des vecteurs viraux.
Comparativement à une thérapie cellulaire, on évite les problèmes de réplication ou de différenciation et on dispose d’une durée d’utilisation accrue, c’est une technique plus simple, moins couteuse et plus sûre.
Critères discriminants : Puisqu’il n’existe aucun standard de production, ni contrôle qualité, il faut être vigilant sur : lieu de production, source, mode d’extraction et de purification, contenu, conditionnement et conservation.
Les exosomes thérapeutiques sont couramment soit d’origine humaine (issus de placenta, moelle osseuse, cellules souches adipocytaires, plaquettes, globules rouges, fluides (urine, salive, lait maternel)), végétale, animale ou fongique, potentiellement aussi bactérienne ou parasitaire.
Les exosomes issus de sang de cordon comportent le plus de potentiel régénératif du fait du profil d’expression retrouvé dans les jeunes organismes. Les exosomes animaux -compatibles à 98%- présentent potentiellement un risque sanitaire mais permettent de s’affranchir des limitations réglementaires, tandis que les exosomes dérivés des plantes semblent actuellement moins efficaces car ils diffèrent structurellement et peinent à atteindre spontanément les cellules visées.
Pour les isoler on utilise majoritairement l’ultracentrifugation, la filtration, la précipitation ou l’immunofiltration.
Divers processus de purifications (chromatographie, transfert membranaire, filtration électrostatique) visent à éliminer les contaminants polysaccharidiques, la caséine, les lipoprotéines, les stérols et autres impuretés, puis l’exosome subit une phase de lyophilisation
Ils contiennent notamment des micro-ARNs (séquences nucléotidiques courtes et stables d’une vingtaine d’acides, régulateurs post transcriptionnels du génome). L’analyse par PCR, protéomique, ou analyse lipidique permet de déterminer leur contenu, afin de prévoir leur action (il existe des profils d’action, par exemple hsa-let-b-5p est une des séquences antiinflammatoires, d’autres favorisent la prolifération, certains régulent la mélanogénèse, etc.) Il s’agit de signaux paracrines visant à modifier telle ou telle voie intracellulaire (Wnt-catenin, PTEN/PI3K/mTOR, TGFbeta, NFKB, JAK/STAT, MAPK, etc.).
Applications :
L’étude de référence de Park démontre une efficacité de l’administration d’exosome par microneedling en hémiface sur les rides, l’élasticité, l’hydratation et la pigmentation par uprégulation de la synthèse du collagène, activation de la voie TFG-beta1/Smad réduisant le strass oxydatif et inhibant la voie MAPK/AP1.
Dans la dermatite atopique, l’utilisation des exosomes vise à réduire les cytokines inflammatoires, l’épaisseur épidermique, et augmenter l’hydratation et de la production de céramides, ou par exemple à réduire l’érythème induit par le dupiliumab par ADSC (adipose derived stem cell exosomes)
Dans les cicatrices hypertrophiques et chéloïdes par inhibition de la voie TFG-beta1/Smad et diminution de la synthèse collagène
Dans la sclérodermie systémique : l’administration d’exosomes issus de fibroblastes réduit la fibrose dermique
En cicatrisation on utilise des exosomes dérivés de plaquettes (PEP : platelet exosome product ) pour augmenter la réépithélialisation et l’angiogenèse et diminuer les espèces réactives de l'oxygène (pour rivaliser avec le PRP, une des hypothèses étant que c’est la fraction exosomale qui est thérapeutique dans le PRP, comme dans la fraction vasculaire stromale). Une étude de phase 2 en cours dans le traitement du pied diabétique, et de phase I dans l’infarctus myocardique.
Dans le traitement de l’hyperpigmentation, on agit par stimulation de la voie NRF2, mais aussi dans le vitligo, la surexpression des microARN exosomaux est utilisée comme biomarqueur d’activité de la maladie.
Dans le lupus, de la même façon, la surexpression exosomale signe l’activité de la maladie, et l’utilisation d’exosomes de cellules souches mésenchymateuses médullaires induit une polarisation macrophagique M2 et une diminution de la réponse T tissulaire.
Dans le traitement de l’alopécie, l’apport exogène de protéine Wnt par exosome administré par voie intradermique permet l’induction de beta caténine et donc le maintien en phase anagène. Les résultats sont retrouvés in vitro, in vivo chez l’animal, et montrés chez l’homme par des cas cliniques publiés ainsi que des études, encore sans groupe contrôle (augmentation significative de la densité et de l’épaisseur)
En pathologie des muqueuses, les applications des exosomes dans la réjuvénation génitale mais également le syndrome post ménopausique, le lichen scléreux, la vulvodynie font l’objet de diverses publications
Le marché est en pleine expansion, il faut se figurer à l’aube de 2032 un marché mondial atteignant les 3500 milliards de dollars. Actuellement plus de 100 laboratoires dans le monde commercialisent déjà plus de 400 produits différents, de qualités complètement hétérogènes.
En l’absence actuelle de régulation, beaucoup de compagnies font des allégations mensongères, d’autres font figurer les exosomes comme simples excipients pour vendre à prix d’or un principe actif dépourvu d’efficacité. La plupart maintiennent l’opacité sur l’origine des exosomes qu’elles commercialisent et revendiquent des propriétés non démontrées scientifiquement.
En fait très peu de publications solides sont actuellement disponibles. A l’heure actuelle, il n’existe par exemple aucune courbe dose/réponse, on ne sait pas s’il existe un point de saturation.
Une recherche exhaustive sur Pubmed, Scopus, Medline, google scholar, web of science et EBSCO portant sur les exosomes en esthétique retrouve actuellement 15 revues de la littérature et aucune méta-analyse. Les données portent principalement sur des exosomes d’origine humaine administrés par voie topique en Corée ou en Chine, dans une indication de réjuvénation.
En ce qui concerne l’internalisation des exosomes : hormis la liaison aux récepteurs de surface spécifiques, les autres mécanismes sont aspécifiques (clathrine, rafts, fusion membranaire, phagocytose, macropinocytose, caveole). Que penser alors des promesses de sélectivité, et de la sécurité ? On n’a finalement pas d’idée sur le rôle des exosomes dans la progression tumorale ou les processus infectieux.
Les risques potentiels : introduction dans les cellules de fragments d’ADN, stimulation de carcinogénèse et du potentiel métastatique (les cellules tumorales excrètent potentiellement des exosomes leur permettant de modifier leur micro-environnement, de stimuler l’angiogenèse, l’évasion immunitaire ou la résistance aux traitements)
On sait que les adénovirus détournent la synthèse cellulaire des exosomes pour se propager et échapper au système immunitaire. Les exosomes peuvent transporter des virions ou du génome viral.
Conservation : les premières recommandations émergentes proposent une température de -80°C : les exosomes sont très fragiles, potentiellement dégradés dans les heures qui suivent leur production.
Administration intraveineuse des exosomes : courte demi-vie plasmatique avec une clairance plasmatique rapide de 2 heures due à leur propension à l’agrégation entrainant une phagocytose macrophagique, puis une accumulation dans les organes (foie rein poumon). Les exosomes semblent cependant très stables dans l’organisme, ils sont protégés des dégradations enzymatiques par la bicouche lipidique et peuvent outre passer la barrière hémato encéphalique.
Pour obtenir une libération prolongée, on utilise des hydrogels.
Il est nécessaire de développer un ciblage plus efficace en cas d’utilisation comme vecteur thérapeutique, de définir des doses thérapeutiques.
Le couplage de liposomes avec des exosomes (permet un doublement de la capacité de régénération, selon le contenu des liposomes, et une augmentation de l’activité de la télomérase et une reprise du cycle cellulaire et des capacités de prolifération de cellules sénescentes) ou la modification d’exosomes par CRISPR/Cas9 ou plasmides, l’utilisation comme système de délivrance de médicaments après chargement par électroporation ou transfection virale. Certains exosomes peuvent aussi être synthétiques : une bicouche lipidique vide est emplie à la demande de micro-ARN, protéines, etc.
Orateur : Dr Jane YOO (Etats-Unis)
Actuellement, il n’existe pas d’exosome approuvés par la FDA :
Des cas de septicémie chez des patients ayant reçus des exosomes issus de placentas post césariennes ont été rapportés, ainsi que plusieurs cas de granulomes post injections, difficilement traitées par dermocorticoïdes (rôle des impuretés mais aussi d’une réponse inflammatoire T médiée dans le cas d’exosomes allogéniques). Du fait de leur taille nanoscopique, l’exosome n’induit pas de réaction immunitaire, par contre leur agrégation peut être responsable d’une réaction inflammatoire.
Orateur : Dr Po Han Patrick HUANG (Taiwan)
Plusieurs cas cliniques d’applications en dermatologie ont été présentés. Il s’agissait dans tous les cas de patients réfractaires au traitement, avec une maladie active et stable depuis plusieurs mois ou même années : morphée, hidradenite suppurée, cellulite disséquante, dermatite atopique sévère et rosacée
Rapports rédigés par le Dr Lidiya Todorova (dermatologue, Bulgarie)
Session animée par : Jeremy Magalon (Pharmacologue, France) ; Dr Sophie Menkes (MD, Suisse) ; Dr Hernan Pinto (PhD – Chercheur, Espagne)
Intervenante : Dr Shadi Kourosh (dermatologue, États-Unis)
Le Dr Shadi Kourosh, dermatologue américaine de renom, a donné la conférence inaugurale de la session « Innovations liées au PRP », en évoquant le rôle du plasma riche en plaquettes (PRP) et du sécrétome dans la restauration capillaire et le rajeunissement de la peau. Elle a analysé certaines données récentes, mettant en évidence à la fois des avancées et des controverses dans les protocoles utilisés en esthétique régénérative. Elle a conclu sa présentation en donnant des conseils d’experts sur les recherches futures dans le but d’encourager l’innovation dans les soins aux patients.
Dans son exposé, le Dr Kourosh a salué les conseils du professeur Maria Hordinski, dermatologue reconnue pour son expertise et ses recherches sur les maladies des cheveux et le système nerveux périphérique en relation avec la biologie du follicule pileux, et a présenté une approche structurée de l’esthétique régénérative à travers le concept des « 7 S » :
Elle a souligné le potentiel régénérateur du sang, en particulier sa capacité à transmettre des signaux de jeunesse tout en réduisant les phénotypes sécrétoires associés à la sénescence (SASP). La parabiose, ou la circulation partagée de deux organismes, a été évoquée comme un concept émergent dans l’amélioration des capacités de régénération. Les objectifs sont de transmettre des signaux de jeunesse aux tissus, de diminuer les signaux sénescents (SASP) et d’augmenter les capacités de régénération de l’organisme. Le sang contient tout le nécessaire : facteurs de croissance (GF), ARNm, plaquettes, sécrétome, exosomes. Le PRP, une méthode largement utilisée, reste contradictoire en raison des variations au niveau de sa composition, de sa préparation et des protocoles d’application, qui sont influencés par des facteurs tels que :
Le Dr Kourosh a décrit les principaux défis liés à l’utilisation du PRP, notamment la fréquence du traitement, les critères de sélection des patients, la stabilité des facteurs de croissance, le mode d’administration et l’efficacité dans l’alopécie non androgénétique. Elle a souligné la nécessité d’une standardisation dans la préparation et le dosage du PRP afin d’assurer des résultats optimaux en termes de régénération. Les approches actuelles recommandent une phase d’induction de trois traitements à intervalles mensuels, suivie d’une phase d’entretien d’un traitement tous les 3 à 6 mois.
Les polythérapies apparaissent comme une stratégie efficace. Le PRP associé à l’acide hyaluronique stabilise les facteurs de croissance, ce qui renforce le rajeunissement. De plus, le PRP utilisé en parallèle des lasers fractionnés (1550 nm et 1927 nm) stimule les cellules souches folliculaires et les facteurs de croissance et donne des résultats remarquables dans le traitement de l’alopécie androgénétique et de l’effluvium télogène. Le traitement au laser de faible intensité (photobiomodulation) présente une option à domicile peu risquée pour la restauration des cheveux, qui donne des résultats étonnants lorsqu’il est associé au PRP.
Les questions et les défis clés pour l’avenir de la médecine régénérative sont les suivants :
La conférence du Dr Kourosh a mis en évidence l’immense potentiel du PRP en médecine régénérative tout en soulignant le besoin urgent de normalisation et d’optimisation. Au fur et à mesure que ce domaine évolue, le perfectionnement des protocoles et l’intégration de traitements complémentaires seront essentiels pour obtenir des résultats cohérents et efficaces. À l’avenir, le PRP devra s’adapter aux besoins individuels des patients, tout en conservant son rôle de principal déclencheur des capacités de régénération.
Intervenant : Dr Patrick Yam (dermatologue, Canada)
Le Dr Patrick Yam est un expert reconnu dans le domaine de la préparation et de l’utilisation du plasma riche en plaquettes (PRP). En tant que conférencier invité au congrès IMCAS 2025, il a donné une conférence sur la façon dont la concentration plaquettaire dans le PRP influe sur l’efficacité clinique et sur les moyens d’améliorer la qualité du PRP à l’aide de repères visuels simples et de réglages des centrifugeuses. Le public a reçu des conseils pratiques pour améliorer la concentration de PRP et les résultats cliniques, ainsi que des informations facultatives sur le moment et la manière dont l’analyse hématologique pourrait être bénéfique.
Le Dr Yam, deuxième intervenant de la session « Innovations liées au PRP », a commencé son exposé en expliquant son utilisation quotidienne d’un analyseur d’hématologie pour divers traitements esthétiques et médicaux à base de PRP. Il a ensuite fait référence à la définition conventionnelle de Marx (1998) qui définit le PRP comme une concentration élevée de plaquettes dans le plasma, où les niveaux de plaquettes dépassent 1 million par microlitre, atteignant des concentrations 4 à 5 fois supérieures aux valeurs de référence. La préparation du PRP consiste à prélever du sang dans des tubes, à séparer le plasma des globules rouges par centrifugation et à prélever immédiatement le PRP. Une deuxième centrifugation facultative peut être effectuée pour obtenir une concentration encore plus élevée.
Pour autant, tous les PRP ne se valent pas. Le Dr Yam a cité un article du professeur Magalon [1], qui a analysé 36 systèmes PRP et a constaté que la dose de plaquettes variait considérablement, de 0,6 à 12,8 milliards (soit une différence de 21 fois). La concentration variait de 79 à 2310x10 ^3 (soit une différence de 29 fois). Moins de la moitié des systèmes produisaient du PRP à forte concentration, et certains produisaient même du plasma pauvre en plaquettes, avec des niveaux inférieurs aux valeurs de référence. Un seul système a toujours produit du PRP de haute qualité et à haute concentration. Intrigué par ces découvertes, le Dr Yam a effectué sa propre analyse de laboratoire, qui a révélé des différences de concentration plaquettaire de plus de 300 fois entre les échantillons de PRP les plus bas et les plus élevés testés. Les concentrations variaient de 5 k/µL (99 % en dessous des valeurs de référence, essentiellement du plasma acellulaire) à plus de 4 millions/µL (soit une différence de plus de 800 fois). Ses recherches ont également identifié des variations dans la composition, y compris la contamination des globules rouges et des leucocytes. Bien que la diminution de la contamination des globules rouges et des leucocytes ait amélioré la qualité du PRP, elle ne devrait pas se faire au détriment de la concentration plaquettaire.
La qualité du PRP est essentielle, mais l’estimation des facteurs de croissance (GF) est complexe et chronophage. En revanche, la numération plaquettaire est un indicateur fiable, car elle est directement corrélée aux taux de GF. De plus, certains indicateurs visuels permettent d’évaluer la qualité du PRP sans recourir à l’analyseur hématologique.
Comment sont calculées les plaquettes ? Le Dr Yam a fourni une formule simple :
Dose = concentration x volume
Par exemple : 1 mL x 1 million/µL = 1 milliard de plaquettes.
Il a également présenté un tableau illustrant le fait qu’un petit tube de sang ne contient pas suffisamment de plaquettes pour la plupart des traitements, en précisant que son équipe prélève généralement 50 ml par traitement.
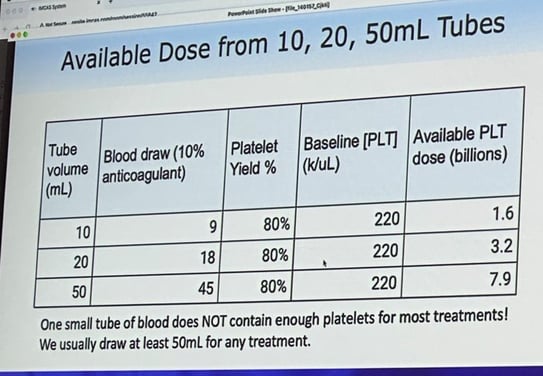
Cela conduit à une conclusion essentielle : si la concentration plaquettaire est inférieure à la valeur de référence, l’échantillon est en fait un plasma pauvre en plaquettes, ou « mauvais PRP ». Les caractéristiques du « mauvais PRP » sont notamment les suivantes :
Après avoir analysé plus de 11 000 échantillons, l’équipe de recherche du Dr Yam a constaté que le « mauvais PRP » était très courant. Bien que l’analyse hématologique reste le critère de référence pour détecter le PRP de mauvaise qualité, il existe un test visuel pratique : le PRP transparent est toujours très peu concentré. Un autre test simple consiste à vérifier la présence d’un culot plaquettaire visible et la présence de globules rouges. Le PRP préparé dans des tubes contenant des gels subit souvent une centrifugation excessive qui emprisonne les plaquettes dans le gel, ce qui entraîne des concentrations plus faibles et un rendement médiocre.
Le Dr Yam a ensuite posé la question suivante : quels sont les paramètres recommandés ?
Les paramètres optimaux de centrifugation dépendent de facteurs tels que la concentration plaquettaire de base, l’hématocrite, la viscosité, la taille du tube et la température. Un point de départ suggéré est de 6 minutes à 600 g pour les petits tubes.
Pour optimiser le potentiel du PRP, les praticiens doivent :
Pour conclure, le Dr Yam souligne l’importance de la concentration plaquettaire dans l’efficacité du PRP. Ses recherches montrent que le PRP de mauvaise qualité est répandu, mais avec des techniques appropriées, son efficacité peut être considérablement améliorée. En comprenant la posologie plaquettaire, en utilisant les bons réglages pour la centrifugeuse et en évitant les pièges courants tels que la centrifugation excessive et les tubes à faible rendement, les cliniciens peuvent optimiser les traitements au PRP afin d’offrir de meilleurs résultats à leurs patients.
[1] Magalon J et al. Technical and biological review of authorized medical devices for platelets-rich plasma preparation in the field of regenerative medicine. Platelets. 2021 Feb 17;32(2):200-208. doi: 10.1080/09537104.2020.1832653.
Rapports rédigés par le Dr Lidiya Todorova (dermatologue, Bulgarie)
Conférenciers : Pr Andrew F. Alexis (dermatologue, États-Unis) ; Dr Seemal R. Desai (dermatologue, États-Unis) ; Dr Albert Wolkerstorfer (dermatologue, Pays-Bas)
Intervenant : Dr Nicolas BACHOT (France)
Le Dr Nicolas Bachot, dermatologue français de renom, spécialiste de l’hyperpigmentation et du vieillissement cutané, a donné une conférence très instructive sur la prise en charge de l’hyperpigmentation périorbitaire (HPO) à l’aide d’acide tranexamique. Il a présenté les données d’une étude clinique en cours qui donne de l’espoir quant au traitement de cette pathologie complexe.
L’hyperpigmentation périorbitaire (HPO) est un problème très répandu, avec peu de traitements scientifiquement prouvés offrant des résultats durables. L’hyperpigmentation périorbitaire affecte de manière disproportionnée les peaux riches en mélanine par rapport aux peaux caucasiennes et sa prévalence est estimée à 30 % chez les Indiens. En raison de son étiologie multifactorielle et de la présence de mélanine dans le derme et l’épiderme, cette pathologie reste difficile à traiter. Malgré la forte demande de traitements efficaces, il existe peu de solutions validées scientifiquement.
À la recherche d’une solution, le Dr Bachot a eu l’idée d’entreprendre une étude clinique multicentrique pour évaluer la sécurité et l’efficacité du microneedling (MN) combiné à l’acide tranexamique (TXA) et à la niacinamide pour le traitement de l’HPO. Le public présent lors de la session a été le premier à prendre connaissance des résultats préliminaires.
L’essai de phase I a eu lieu au Japon et en Malaisie et portait sur 46 patients. Le protocole de l’étude consistait en trois séances de MN, chacune réalisée à un mois d’intervalle, suivies d’un traitement à domicile entre et après chaque séance de MN. Le MN a été réalisé à une profondeur de 0,5 à 0,7 mm, et la solution utilisée au cours de la procédure était composée de niacinamide à 10 % et de TXA à 5 %, tous deux connus pour leurs propriétés anti-inflammatoires et dépigmentantes. Au cours du premier mois, le traitement à domicile comprenait un léger peeling dépigmentant (composé d’acide lactique à 8,5 %, de TXA à 5 % et d’acide férulique à 2 %). Du deuxième au cinquième mois, on a demandé aux patients d’appliquer un concentré dépigmentant (composé de niacinamide à 10 % et de TXA à 5 %). L’évaluation finale a eu lieu au 5e mois.
Les méthodes d’évaluation incluaient :
Le Dr Bachot a présenté des résultats préliminaires après seulement deux séances de MN, révélant une réduction significative des niveaux de HPO. Une amélioration de 43,3 % a été enregistrée par rapport au groupe témoin, 65 % des patients présentant une amélioration allant de bonne à excellente. L’efficacité du traitement a augmenté après la deuxième séance de MN. Notamment, aucun patient n’a développé d’hyperpigmentation post-inflammatoire, et un seul patient a présenté un fort érythème, tandis que deux autres ont signalé de légères rougeurs et des tiraillements, qui ont disparu en quelques semaines. Malgré les séances de MN, les niveaux d’érythème ont diminué de 20,3 %, ce qui indique une réduction de l’inflammation sous l’œil. Dans l’ensemble, 47 % des patients ont présenté un érythème nul ou léger après la deuxième séance de MN, ce qui montre une tendance à l’amélioration avec la poursuite du traitement.
L’étude a conclu que :
La poursuite du traitement à domicile est essentielle pour confirmer l’efficacité à long terme du traitement à différents niveaux de sévérité de l’HPO. D’autres recherches devront déterminer la nécessité d’un traitement continu à domicile et son rôle dans l’optimisation des résultats au fil du temps.
Rapports rédigés par le Dr Lidiya Todorova (dermatologue, Bulgarie)
Conférenciers : Dr Yolanda Gilaberte Calzada (dermatologue, Espagne) ; Prof Andy Goren (dermatologue, République tchèque) ; Dr Sergio Vano Galvan (dermatologue, Espagne)
Intervenante : Dr Marisa MATHIEU (dermatologue, Belgique)
Le Dr Marisa Mathieu, dermatologue belge spécialisée dans les troubles des cheveux et des ongles, a donné une conférence instructive sur les derniers traitements de l’alopécie androgénétique (AGA). La présentation comportait de nombreuses images avant-après. Le Dr Mathieu a évoqué les antiandrogènes systémiques tels que le bicalutamide et le dutastéride, les applications de mésothérapie, la toxine botulinique et les traitements expérimentaux innovants.
Elle a également présenté le bicalutamide oral, un antiandrogène non stéroïdien qui bloque les récepteurs des androgènes. Ce médicament, un analogue du flutamide, offre un profil de sécurité amélioré et il a été démontré qu’il améliore la densité des cheveux, réduit la séborrhée et améliore l’acné et l’hirsutisme. La posologie quotidienne recommandée varie de 10 à 50 mg, bien qu’aucun consensus n’ait été établi à ce sujet. Les études cliniques confirment son efficacité dans le traitement de l’AGA chez la femme. Parmi les effets indésirables signalés : une légère augmentation des transaminases, un œdème périphérique, une gêne gastro-intestinale, une mastalgie, une asthénie, une myalgie et une diminution de la libido. Les spécialistes conseillent de surveiller les enzymes hépatiques avant le traitement, un mois après le début du traitement, puis tous les trois à six mois. Bien que le risque d’hépatotoxicité sévère soit faible, il survient généralement au cours des premiers mois de traitement. Les patientes qui envisagent une grossesse doivent arrêter le médicament deux mois avant en raison du risque de féminisation fœtale [1-3].
Autre antiandrogène systémique évoqué : le dutastéride oral, un inhibiteur de la 5-alpha réductase possédant une longue demi-vie de cinq semaines. Le dutastéride bloque les isoformes de type 1 et de type 2 de l’enzyme responsable de la conversion de la testostérone en dihydrotestostérone (DHT), réduisant ainsi l’impact des androgènes sur les follicules pileux. La posologie recommandée est de 0,5 mg par jour, les spécialistes suggérant de réduire à 0,5 mg deux à trois fois par semaine au bout de 12 à 18 mois afin d’améliorer l’observance du patient. C’est généralement dans ce délai que l’on peut observer l’effet maximal du traitement. Une surveillance biologique n’est pas nécessaire, à l’exception des taux d’antigène prostatique spécifique (APS). Le dutastéride n’est pas recommandé chez les personnes sous médicaments hépatotoxiques, aux patients de moins de 40 ans ayant des antécédents familiaux de cancer de la prostate, aux patients afro-américains ou aux personnes âgées de plus de 50 ans. Le candidat idéal est un homme de 18 ans atteint d’AGA. Le Dr Mathieu a également recommandé d’associer le dutastéride oral au minoxidil oral ou topique pour des résultats optimaux [4-5].
La mésothérapie par dutastéride s’est révélée efficace et sûre en pratique clinique lorsqu’elle est administrée à 0,025 % tous les trois mois [6]. Des résultats encore meilleurs sont observés lorsque le dutastéride injectable à 0,01 % est associé au minoxidil par voie orale [7]. En raison de sa longue demi-vie, la mésothérapie est recommandée tous les trimestres. Les effets indésirables potentiels sont notamment l’érythème local, la douleur, le prurit, les maux de tête, l’œdème, l’hématome et la folliculite, mais ils restent passagers et disparaissent généralement en 24 heures. Contrairement au dutastéride oral, la mésothérapie convient aussi bien aux hommes qu’aux femmes, ce qui en fait une option pour les patients réfractaires aux traitements oraux ou présentant des effets indésirables. La combinaison de la mésothérapie avec du minoxidil oral ou topique, des antiandrogènes oraux ou du plasma riche en plaquettes améliore son efficacité.
La mésothérapie au bicalutamide (0,5 %) est une option émergente dans le traitement de l’AGA. Elle est recommandée chez les patientes souffrant de chute des cheveux et peut être utilisée seule ou en parallèle d’autres traitements. Bien que les premières études ne montrent que des améliorations subtiles, les effets indésirables du traitement sont similaires à ceux des injections de dutastéride [8-9].
L’utilisation de toxine botulique de type A dans l’AGA a récemment fait l’objet d’une attention particulière. Étant donné que les zones alopéciques souffrent d’une insuffisance microvasculaire et de niveaux d’oxygène réduits, cet environnement favorise la conversion de la testostérone en DHT, qui à son tour déclenche la production de facteur de croissance transformant bêta1, une substance pro-apoptotique initiatrice de l’AGA [10]. Même si certaines études récentes indiquent que la toxine botulique n’a pas d’effet significatif sur l’AGA chez l’homme, d’autres sont toujours en cours [11].
Plusieurs antiandrogènes topiques prometteurs sont actuellement en cours de développement, notamment le GT20029 et le pyrilutamide. Le GT20029 dégrade les récepteurs des androgènes en les recrutant pour la dégradation, tandis que le pyrilutamide inhibe la liaison des androgènes aux récepteurs des androgènes dans les follicules pileux et les glandes sébacées. La technologie des petits ARN interférents (siRNA) est également explorée comme moyen de neutraliser des gènes spécifiques en dégradant leur ARN messager (ARNm). Dans l’AGA, les siRNA inhibent l’ARNm du récepteur des androgènes, réduisant ainsi son expression et bloquant la signalisation des androgènes. Un autre développement connexe, le SAMiRNA, cible les récepteurs des androgènes à l’aide de micelles auto-assemblées d’ARN inhibiteur, qui empêchent la synthèse des protéines et réduisent la présence des récepteurs des androgènes dans les cellules de la papille dermique [12].
Le CosmeRNA, un produit cosmétique certifié par l’UE, a été conçu pour être appliqué toutes les deux semaines afin d’inhiber la synthèse des récepteurs des androgènes par le biais de l’ARN inhibiteur. La thérapie par exosomes, qui utilise des vésicules extracellulaires contenant des protéines, des lipides, de l’ARNm et des ARNmi, apparaît également comme un traitement potentiel. Les exosomes favorisent la régénération des follicules pileux, améliorent la prolifération cellulaire et facilitent l’angiogenèse. Ils possèdent également des propriétés anti-inflammatoires, contrecarrant la miniaturisation folliculaire, et procurent des facteurs de croissance clés tels que le VEGF, l’IGF-1 et le FGF, qui favorisent la santé folliculaire.
Le Dr Mathieu a conclu son exposé par un aperçu de l’algorithme de traitement prévu pour l’AGA chez l’homme en 2025, qui reflète les progrès établis dans le domaine et l’avenir prometteur des polythérapies pour une restauration optimale des cheveux :
Articles utilisés dans la présentation de ce conférencier :
Rapport écrit par Dr Marina THOMAS (Dermatologue, France)
Orateur : Pr Andy GOREN (République Tchèque)
Seul le minoxidil topique a l'autorisation de la FDA dans le traitement de l'alopécie masculine ou féminine. La réponse est visible au bout de 16 à 24 semaines chez au maximum 40 % des patients (sans doute un peu moins chez la femme) permettant souvent une conservation plus qu'une repousse des cheveux.
Le minoxidil est une pro drogue convertie en sulfate de minoxidil dans la gaine externe pilaire par une sulfotransférase endogène SULT1A1. Appliquée localement cette petite molécule rentre directement dans la cellule. On peut prédire la réponse au traitement topique avec une VPN de quasiment 98 % une VPP de 72 % en mesurant le seuil d'activité dans le cheveu : en deçà d'un certain seuil de cette enzyme les patients ne sont pas répondeurs car ils ne peuvent convertir la molécule en substance active.
La plupart du minoxidil ingéré est métabolisé au niveau du foie, organes où SULT1A1 est le plus exprimé puisqu'il sert à augmenter la solubilité des xénobiotiques en vue de leur efflux. 80 % de la dose ingérée est éliminée par voie urinaire dans l'heure suivant la prise. Le reste est sulfaté transit par voie sanguine.
Lors d'une prise orale, ce sont donc les individus exprimant SULT1 à un niveau élevé mais exprimant donc également peu de transporteurs d'influx des produits sulfatés (plus fréquemment les femmes), qui vont moins bien répondre.
L'hypoxie semble quasiment doubler la capacité d'influx de produit sulfaté des cellules, peut-être par le biais de la production d'HIF. La voie HIF serait donc un possible levier pour augmenter la sensibilité au minoxidil oral.
Minoxidil oral :
On a maintenant un recul de 10 ans du minoxidil par voie orale, l'efficacité étant au moins équivalente à l'usage topique.
Les doses recommandées de minoxidil oral vont de 0,25 à 2,5 mg/j chez la femme et de 2,5 (à 5 mg) chez l’homme.
Il existe un très bon profil de sécurité, que ce soit chez la population générale chez les sujets âgés ou même chez l'enfant et l'adolescent le principal effet secondaire étant l'hypertrichose. Il existe un très bon profil de sécurité le principal effet secondaire étant l'hypertrichose dans 15 à 40 % des cas, réversible à l'arrêt et dose dépendante. L'étude de Vano Galvan,Rob Sinclair et al. dans le JAAD en 2021 retrouvait pour plus de 1400 patients un taux d'interruption de traitement de seulement 1,7 %, l'absence de tout effet indésirable et un taux moyen d'effet indésirable de 20 %. Lorsqu'ils surviennent les effets secondaires sont échelonnés dans le temps dans les premières 24 heures sur une tachycardie dans la première semaine une lipothymie entre 2 et 3 semaines des céphalées entre 1 et 3 mois maximum l'hypertrichose et des œdèmes.
Chez les patients hypertendus, en vie réelle, une étude multicentrique regroupant 254 patients retrouvait seulement 2 patients ayant nécessité une modification ou un arrêt du minoxidil et pas plus d'effets indésirables que dans la population générale.
On propose pour les patients hypertendus une prise au coucher pour minimiser le risque d'hypotension orthostatique, de débuter à faible dose, d'adapter à la tolérance, avec un maximum de 5 mg/jour pour les hommes.
Une attention particulière est à prêter aux patients polymédiqués sous trithérapie antihypertensive et les patients sous doxazosine : préconiser un auto-contrôle tensionnel initial un électrocardiogramme de référence et une consultation préalable avec le cardiologue traitant.
Enfin on déconseillera le minoxidil oral même à faible dose chez les patients avec antécédent de myocardite, de maladie coronaire, d'insuffisance cardiaque avec fraction d'éjection réduite, de valvulopathie sévère ou d'une néphropathie avancée.
L'auteur conclut même en proposant le minoxidil oral en première intention pour la quasi-totalité des alopécies en consultation tout venant.
Anti androgènes systémiques :
Le bicalutamide est un anti androgène non stéroïdien, qui bloque le récepteur aux androgènes recommandé chez la femme à la dose orale de 10 à 50 mg quotidienne avec une amélioration de la densité capillaire, de la séborrhée, l’acné et de l’hirsutisme avec un bon profil de tolérance. Une surveillance de transaminases est recommandée à M0, M1 puis tous les 3 à 6 mois. Quelques œdèmes, des troubles digestifs, une mastodynie peuvent être rencontrés. Le traitement doit être stoppé 2 mois avant toute conception pour éviter tout risque de féminisation fœtal. Ce traitement peut être proposé aux femmes non ménopausées qui présentent plusieurs symptômes d’hyperandrogénie. L’adjonction au minoxidil topique permet de corriger l’hypertrichose induite.
Le dutasteride est un inhibiteur de la alpha réductase (1 et 2) à longue demi-vie (5 semaines), il entraine une diminution des taux de dihydrotestostérone. A la posologie de 0,5 mg par jour, il est efficace (majoritairement sur la couronne et en frontal) et relativement bien toléré chez l’homme. Ce traitement peut être proposé en attaque quotidiennement puis après obtention entre 12 et 18 mois de l’efficacité maximale, à dose réduite de 2 à 3 jours par semaine, idéalement combiné avec le minoxidil local ou oral. La surveillance du PSA est recommandée après 50 ans ou après 40 si antécédent familial de cancer de la prostate.
L’usage en mésothérapie du dutasteride : Il peut être proposé aux hommes comme aux femmes, seul en cas de refus ou d’intolérance d’un traitement oral, ou combiné, pour une plus grande efficacité. Les effets indésirables sont locaux (douleur, prurit céphalées, et résolutives en 24h). 2 études rétrospectives présentent des résultats positifs chez l’homme, administrée tous les 3 mois, à 0,025% seule ou 0,01% en association avec le minoxidil oral si effet secondaire du systémique du bucalitamide : on le réservera aux femmes, et son efficacité semble encore plus modéréede la toxine botulique : son efficacité est controversée dans l’AAG. Elle permettrait de lutter contre l’hypovascularisation capillaire et la production anormale de testostérone, de DHT et donc de TGF beta proapoptotique. Une méta-analyse de 2023 concluait à une possible efficacité, mais une étude randomisée en hémi-crâne et en monothérapie de 2024 (sur faible effectif) ne constatait aucune amélioration.
Produits en développement :
Des études de phase 1 et phase 2 de médicaments topiques par un laboratoire chinois ciblent le récepteur aux androgènes, soit en augmentant sa dégradation, soit par blocage du récepteur
L’utilisation de siARN (small interfering RNA) pour silencer le gène du récepteur aux androgènes est une approche élégante non hormonale de grande spécificité, potentiellement moins pourvoyeuse d’effets secondaire mais elle rencontre encore des problèmes de stabilité, de délivrance à la cible. Il n’existe à ce jour pas de données long terme d’efficacité et de tolérance. Un cosmétique certifié UE et utilisant cette technologie est commercialisé ?
En cas d’atteinte légère ou de réticence au traitement oral on peut proposer une faible dose de dutastéride 2 fois par semaine ou un traitement uniquement topique, et chez les patients jeunes le finasteride 1mg quotidien associé au finastéride/minoxidil ou local.
En cas d’antécédent de cancer du sein : minoxidil oral + spironolactone
Chez tous les patients, les traitements adjuvants sont à envisager en cas d’insuffisance de réponse (mésothérapie, PRP, PBM, mesothérapie micro needling).
Alopécies cicatricielles :
Dutasteride : De nombreuses équipes proposent en première ligne le dutasteride oral ans l'alopécie frontale fibrosante. Une revue systématique de la littérature avec méta-analyse publiée dans le JEADV 2024 montrait que 63 % des patients étaient stabilisés sous dutastéride et 36 % étaient même améliorés.
Dans le JAAD en 2020, l'équipe de VANO GALVAN a publié une étude rétrospective sur une cohorte de plus de 200 patients suivis sur deux ans qui montrait que le dutastéride était le traitement le plus efficace de l'alopécie frontale fibrosante avec un effet dose dépendant (2 vs 3, 5 ou 7 jours par semaine).
On peut également discuter un traitement intralésionnel par dutastéride.
Mode d’action incertain : les inhibiteurs de la 5 alpha réductase pourraient lutter contre la fibrose périphérique induite par les androgènes, réduire le métabolise xénobiotique et posséder un effet immunomodulateur.
PRP pour AFF et cicatricielles : Une étude rétrospective de 120 patients montrait une repousse significative après PRP contre placebo et une réduction de l'inflammation du scalp.
JAK inhibiteur dans l'alopécie frontale fibrosante et le lichen plan pilaire : Les inhibiteurs de JAK fonctionnent dans les pathologies lichénoïdes où l'infiltrat est superficiel contrairement à la pelade où l'infiltrat est plus profond.
Naltrexone orale : Une étude rétrospective sur quasiment 230 patients retrouvait une efficacité de faibles doses de naltrexone(4,5mg/j) notamment sur le prurit, la trichodynie, l'érythème périfolliculaire chez plus de 50 % des patients de façon significative et potentiellement une stabilisation de la maladie à confirmer dans des études ultérieures.
Minoxidil : Des données rétrospectives suggèrent l'intérêt de faible dose de minoxidil en traitement adjuvant pour augmenter la densité chez les patients souffrant de pathologies lichénoïdes.
Greffe dans l'alopécie fibrosante : données d'étude rétrospective multicentrique sur une cinquantaine de patients : On note une satisfaction élevée des patients de 82 % malgré seulement 41 % des greffons maintenus après cinq ans.
Folliculite décalvante
Adalimumab : En 2022, une série de 23 patients a été publiée dans le JAAD traité par adalimumab (anti-TNF) à la dose hidradénite : tous étaient répondeurs dont 52 % de très bonne réponse. Les données précédentes de la littérature montrent toutefois une rechute à l'arrêt de traitement.
Dapsone topique : Formulée en gel à 5 % (pour réduire les effets secondaires hématologiques) appliqué trois fois par semaine pendant 12 mois, elle permettait de réduire le nombre de poussées de façon significative dans une étude rétrospective sur 14 patients publiée dans le JAAD en 2021.
Alopécie cicatricielle centrale centrigue (CCCA)
L'orateur est revenu sur les propositions de traitement formulées à l'AAD 2024 : dermocorticoïdes de très forte activité, injection intra lésionnelle de corticoïdes, doxycycline mais également metformine à la dose de 500 mg/jour par activation de la voie des map kinase pour lutter contre la fibrose.
Orateur : Pr Roxanna SADOUGHIFAR (Iran)
L’auteur conseille de dépister régulièrement le diabète, les facteurs de risque cardiovasculaires, les dysthyroidies et l’atopie chez les patients souffrant de pelade.
On rappelle qu’en janvier 2024, le JEADV a publié un consensus d’experts européens dans le traitement systémique de la pelade, mais qui montrait surtout que seulement 5% des propositions faisaient consensus !
Les traitements traditionnels comprennent bien sûr dermocorticoïdes, corticoïdes intra lésionnels ou systémiques en pulse, immunothérapies topiques, mais aussi la photothérapie, les statines, les immunosuppresseurs, les faibles doses de naltrexone, l’imiquimod, de façon anecdotique le dupiblumab et les anti-TNF.
En cas d’atteinte limitée de moins de 20 % du scalp, on rappelle des techniques d’injection intradermique de 2,5 à 5 mg de triamcinolone intra lésionnelle : bolus rétrogrades de 0,1 ml ; les atrophies parfois retrouvées régressent en 8 à 16 semaines.
Prudence en cas d’injection dans la zone auriculo-temporale, des cas d’occlusion rétinienne ont été rapportés avec ce médicament dont les particules de grande taille s’agrègent plus volontiers.
Un traitement systémique doit être envisagé en cas d’atteinte modérée à sévère ; un début rapide étant gage d’une meilleure réponse au traitement. Le taux de réponse sous anti JAK augmente quand il existe encore des cheveux présents à l'initiation du traitement.
La pelade est considérée comme modérée à sévère en cas de SALT supérieur à 20 (modérée)/50 (sévère), surface>30%, mais également en cas de présence d'un ou plusieurs facteurs suivants : atteinte des sourcils et des cils, absence de réponse dans les six mois de traitement, atteinte rapidement progressive et test de traction diffus, impact psychosocial important.
Pour prévenir la déminéralisation sous corticoïdes il recommande 70 mg hebdomadaires d’alendronate, et une supplémentation vitamino calcique.
En Europe, en cas d’échec des corticoïdes on proposera un début des anti JAK dans les 6 mois.
Nb du rédacteur : en France, le baricitinib et le ritlécitinib sont remboursables dans le traitement de la pelade sévère respectivement de l'adulte, et de l’adulte et l’adolescent de plus de 12 ans.
Les anti JAK semblent plus efficaces chez les sujets jeunes. En moyenne, au bout d’un an et demi de traitement, ils permettent une repousse complète ou quasi complète (+ de 80 % de repousse) chez environ 50% des patients : baricitinib (anti JAK 1/ 2) 2 à 4 mg/j, ritlecitinib (anti JAK 3 TYK 2, attention aux interactions avec certaines statines, les benzodiazepines et les immunosupresseurs) 50 mg/j, deuroxolitinib (anti JAK 1/ 2) 8 mg pas encore approuvé. Le tofacitinib ne possède pas d’autorisation dans cette indication mais on sait qu’il permet aussi 50% de repousse chez 30-65% des patients.
Un bilan pré thérapeutique est nécessaire, notamment compte tenu des alertes cardiovasculaires et oncologiques dans d’autres indications (rhumatologiques). On rappelle qu'à ce jour aucun effet secondaire majeur de ce type n'a été observé chez les patients traités pour des pelades ne présentant pas les mêmes facteurs de risque que les patients rhumatologiques, et traités par des anti JAK plus sélectifs.
La mise à jour vaccinale inclut également le vaccin anti VZV
Les effets indésirables sont souvent tolérables : infections des VAS, céphalées, nausées, JaKné
Les anti JAK2 entrainent plus de prise de poids et d’hyperlipidémie. Un contrôle du bilan lipidique à quatre semaines est proposé.
Les formes topiques d’anti JAK semblent insuffisamment efficaces dans la pelade.
Les traitements de nème ligne restent la ciclosporine 3 à 5 mg/kg/j, le methotrexate, notamment chez l’enfant, et l’azathioprine.
Parmi les 45% de patients SALT >20 après 2 ans de traitement par anti JAK, la plupart sont des répondeurs précoces.
Il existe également des réponses tardives à ces traitements systémiques, et ils doivent être tentés 6 (classiques) à 9 (anti JAK) mois avant de conclure à un échec de ligne, et de pratiquer une escalade thérapeutique.
Le minoxidil oral peut dans tous les cas être proposé en adjuvant
Un traitement long est la clé de la réussite (minimum 12 semaines, mais pouvant atteinte 3 à 7 ans si nécessaire), l’arrêt se doit d’être lent et prudent sous peine de récidive, quel que soit le traitement utilisé. Idéalement l’arrêt se fait au moins 6 mois après la réponse complète.
La plupart des patients récidivent à l'arrêt des anti JAK, quelques semaines à quelques mois après l'arrêt du traitement parfois brutalement et sévèrement. La repousse est ensuite lente et même parfois mais rarement absente.
En cas de décision d'arrêt des anti JAK il faut donc effectuer une réduction extrêmement lente des doses et des paliers d'au moins quatre mois.
Les traitements immunomodulateurs topiques par diphénylcyclopropénone ou le dibutyl ester de l'acide squarique sont encore parfois envisagés, ils demeurent éprouvés, parfois efficaces (pas en situation aiguë) et peu coûteux ; leur effet peut être augmenté par l’utilisation d’anti histaminiques (ebastine, fexofenadine).
De même la photothérapie, antiinflammatoire est parfois proposée.
Orateur : Dr Monika FIDA (Albanie)
La réponse est : rien.
L’effluvium telogène est une chute non cicatricielle anormale au-delà des 100 à 150 cheveux par jour attendus, révélée par une perte de densité. Il peut être anagène ou plus fréquemment telogène augmentation du nombre de follicules en phase telogène)
L’effluvium aigu : (post infectieux, stress, grossesse, anesthésie ou procédure, arrêt de contraception, dysthyroïdie)
La chute survient 2 à 3 mois un phénomène aigu qui a induit le passage brutal de plus de 20-25% des bulbes en phase télogène, visible au trichogramme. Il n’y a ni alopécie, ni trichodynie. Le test de traction est positif (+ de 6/60) et la repousse normale se fait en 6 à 12 mois après disparition du facteur causal. On peut aussi utiliser le test de lavage : chute de plus de 10% de duvets (moins de 3 cm) après lavage 5 j après le dernier shampoing. On élimine les diagnostics différentiels par trichoscopie in vivo (pas d’anisotrichie de l ‘AAG, pas d’érythème péripilaire ou de gaine coulissante du lichen, le cuir chevelu est normal). Souvent une seule tige pilaire est retrouvée par unité folliculaire. Aucune biopsie n’est recommandée.
Il faut également rechercher des prises de médicaments : beta bloquants, inhibiteurs calciques, rétinoïdes, antidépresseurs, AINS.
Dans l’effluvium chronique (plus de 6 mois), il faut rechercher une carence martiale ou une dysthyroïdie. La chute est diffuse mais la perte de densité prédomine dans les zones temporales, épargnant la zone frontale.
On peut proposer le minoxidil topique (ou oral, prévenir de la tachycardie et des œdèmes des membres possibles)
Les points jaunes (follicule vide) sont présents à la fois dans l’effluvium et dans l’AAG.
Orateur : Dr Lidiya TODOROVA (Bulgarie)
Il ne faut pas négliger le traitement du cuir chevelu dans les pathologies capillaires.
On peut donc effectuer des peelings (uniquement superficiels pour ne pas altérer le bulbe !) pour exfolier jusqu'au derme superficiel (60 µm) en séances mensuelles à 3 ou 4 reprises.
On peut utiliser des peelings aux acides de fruits AHA (alpha -hydroxyacides) :
- pour rééquilibrer le pH du cuir chevelu sensible, augmenter l'hydratation, traiter les érythèmes superficiels, les dommages actiniques, en préparation pour la mésothérapie en augmentant la microcirculation et en stimulation dans l'effluvium chronique avec une application mensuelle à l'acide lactique occasionnant moins d'inconfort ou également pour les états pelliculaires/la xérose à l'acide glycolique de 30 à 50 % à neutraliser; l'exfoliation survient après quelques jours et la réépidermisation en une semaine.
- en cas d'hyperséborrhée bimensuels à l'acide mandélique qui pénètre de façon plus uniforme dans les zones riches en lipides, occasionne moins de desquamation, réépithélialisation en 5 jours.
Ou des bêta-hydroxyacides contenant de l'acide salicylique concentré de 10 à 30 % sans neutralisation très lipophile pénétrant rapidement et profondément la barrière lipidique jusqu'aux cornéocytes il a une action antimicrobienne kératolytique anti-inflammatoires et modérément analgésique pour le traitement de l'hyperséborrhée de l'inflammation et de l’hyperkératose. L'exfoliation survient en bout d'une semaine avec épithélialisation en 14 jours et utilisation mensuelle en 3 à 4 applications.
Il peut être utilisé pour les états pelliculaires, le prurit et l'irritation du scalp, l'effluvium chronique inflammatoire, l'hyperséborrhée, dans le but d’espacer les poussées dans la dermite séborrhéique, le psoriasis, l'acné ou les folliculites.
Les procédures peuvent être répétées ad libitum selon l'effet souhaité, notamment pour soulager durablement un prurit de l’acide azélaïque : bactériostatique, il diminue la production de radicaux libres, kératolytique, puissant inhibiteur de la 5 alpha réductase il est très bien toléré et l'absence de photo toxicité permet son administration en été. L'exfoliation survient en une semaine l'épithélialisation en 2, l'application est mensuelle.
Sur cheveux humidifiés pour faciliter la pénétration, le peeling est appliqué et laissé poser pendant 5 à 10 minutes, rincé puis séché.
Les contre-indications des peelings sont l'alopécie frontale, les alopécies cicatricielles, les allergies, les infections actives et plaies, et de façon relative la grossesse et l'allaitement l’âge et l'atopie.
Dans les minutes ou heures post procédure peuvent apparaître des signes irritatifs mineurs : sensation de brulure, érythème, œdème, prurit ou bulle, puis de façon plus retardée en jour sous semaines, des éruptions acnéiformes, infections, érythème persistant, milium.
Il s'agit de peelings superficiels donc sans risque d'effets indésirables majeurs.
Orateur : Dr Carmen CASTILLA (Etats-Unis)
La plupart des patients qui consultent pour alopécie androgénogénétique sont automédiquées en première intention par supplément vitaminique dont principalement la vitamine B.
L'industrie des suppléments alimentaires n'est pas régulée, la composition est donc sujette à caution, et les apports en excès peuvent souvent être responsables de troubles des phanères.
La densité capillaire est maximale vers 25 ans puis diminue à partir de la trentaine.
La phase anagène dure entre 2 et 8 ans selon le sexe puis diminue avec l'âge de même que la proportion des follicules en phase anagène.
La cellule folliculaire se divise rapidement et est sensible aux variations d'apport nutritionnel qui peut retentir sur la croissance du cheveu sa texture et sa couleur.
Il n'existe pas d'étude randomisée explorant l'efficacité de la supplémentation nutritionnelle chez les patients sans carence avérée.
La vitamine A ou acide rétinoïque, régule les cellules souches folliculaires. Un excès entraîne une bascule en phase catagène il est donc important à l'interrogatoire de recueillir l'ensemble des suppléments vitaminiques du patient, parfois nombreux. Il existe un stockage graisseux.
La vitamine C joue un rôle encore obscur dans le cycle du cheveu mais on sait également qu'elle augmente l'absorption intestinale de fer cruciale pour la santé capillaire. Il faut recommander au patient une prise du fer tous les jours à l'exception des jours de prise de vitamine C ce qui augmentera l'absorption finale.
La vitamine D : carence très fréquente associée à l'alopécie androgénogénétique effluvium télogène sans étude solide prouvant l'efficacité de la supplémentation. Son excès de l'origine de problème du métabolisme calcique avec notamment des lithiases.
Vitamine E : à la dose requise de 15 mg son rôle antioxydant semble augmenter la densité capillaire (contre placebo effectif de 40 patients 100 mg/jour quotidien). En excès toutefois, elle diminue la fonction thyroïdienne et donc négativement la pousse capillaire.
Iodine : depuis la supplémentation du sel seuls 8 % de carence subsistent. Son excès cause également une dysthyroïdie.
Zinc : les besoins en zinc sont légèrement supérieurs chez l'homme. Il existe une association incertaine entre carence en zinc et alopécie androgénogénétique.
Les acides aminés : la L cystéine contient du soufre, essentiel à la construction des ponts disulfures des cheveux. Il convient également de supplémenter en acides aminés essentiels comme la méthionine et la lysine. Après 60 ans il convient d'augmenter la ration globale en protéines à 1,5 g/kg/jour.
Sélénium : nécessaire également la croissance pilaire il est retrouvé dans les végétaux qui le puisent dans le sous-sol. En trop grande quantité il cause cependant une fragilité des phanères.
Rapport écrit par Dr Marina THOMAS (Dermatologue, France)
Orateur : Dr Peter VELTHUIS (Dermatologue, Pays-Bas)
On peut utiliser les appareils traditionnels de haute précision (ceux des services de radiologie), ou des appareils plus nomades comme ceux utilisés en radiologie interventionnelle, et maintenant la sonde digitale, tout nouveau modèle présenté lors de cet IMCAS.
La tendance va à l’obligation de l’utilisation des ultrasons pour guider les procédures. En Floride, leur usage est obligatoire pour les actes de Butt lift, et le praticien doit en apporter la preuve avec un stockage des images de la procédure.
Lors de l’achat d’un appareil, il faut absolument s’enquérir des conditions de mise à jour et de maintenance, sous peine d’avoir un appareil rapidement inutilisable, ou à un coût important.
Utiliser les ultrasons permet :
Une procédure peut être assistée par ultrasons (vérification à des étapes clés) ou guidée par ultrasons (tout au long de la procédure).
Orateur : Dr Benjamin ASCHER (Chirurgien plastique, France)
Dr Ascher a présenté un tout nouveau modèle de sonde d’échographie, miniaturisée et portée au bout du doigt.
Le marché de l’injectable est toujours en expansion, et dans dix ans, les injecteurs seront semble-t ’il majoritairement des non-médecins. Il est donc crucial d’apporter des réponses aux problèmes de complications qui sont eux aussi bien sûr en augmentation. Compte tenu du nombre d’injections, le risque actuel de complication vasculaire est estimé à entre 26 000 et 164 000 cas.
Par exemple l’implantation des artères labiale inférieure et coronale inférieure sont majoritairement postérieures sur le plan musculaire, côté muqueux, mais un contrôle ultra-sonographique permet de déceler les 2 et respectivement 18% ou elle se trouve en cutané antérieur, ou intra orbiculaire.
Une solution échoguidée miniaturisée est plus adaptée à l’activité dermatologique que les sondes issues de la cardiologie ou de la radiologie conventionnelle. Les sondes traditionnelles ne sont pas conçues pour la médecine interventionnelle, elles immobilisent une main de l’utilisateur et bloquent une large surface de contact.
Le nouvel appareillage présenté est miniaturisé et léger, il permet une position physiologique de l’utilisateur. Il fonctionne comme un prolongement du doigt qui sert habituellement à la palpation. Il s’agit d’une sonde courbe 15 MHz, qui peut être portée sous un gant stérile, et permettant une utilisation en mode B, doppler, et doppler énergie.
Per procédure, on peut identifier les différentes couches tissulaires, les rapports anatomiques entre elles, la position des structures vasculaires, et suivre en dynamique les contractions musculaires et la mobilisation des produits injectés. On repère le bout des canules ou aiguilles et on peut mesurer le volume injecté et sa localisation.
Les développements à venir comportent des techniques de coloration des images pour aider au repérage des structures, des techniques d’entrainement assistées par l’IA, le contrôle vocal et la création d’une version sans fil…
Rapport écrit par Dr Marina THOMAS (Dermatologue, France)
Orateur : Dr Seemal R DESAI (Etats-Unis)
Dr Seemal R DESAI, le président de l'AAD, nous rappelle que le mélanome est une dermatose inflammatoire chronique. La conséquence est une surproduction de mélanine par hyperactivité de la tyrosinase.
Les facteurs déclenchants ou aggravants sont l'exposition solaire, la prise de médicaments, des facteurs hormonaux, ou immunologiques.
Dans la boîte à outils thérapeutique on trouve des rétinoïdes topiques, l'acide azélaïque, l'hydroquinone, les peeling, les cosmétiques, le laser, la dermabrasion.
Le primum movens semble être une vasodilatation entraînant une inflammation, responsable de la surproduction de mélanine. Une étude coréenne sur des biopsies séquentielles montre une expression augmentée de VEGF et d'antigène lié au facteur VIII. Cette vasodilatation extension visible sous la forme d'un érythème démasqué après traitement de l'hyperpigmentation.
Histologiquement on observe dans les mélasma tout débutants une dilatation des capillaires dermiques papillaires semblable à celle du psoriasis. Cela permet l'arrivée des médiateurs inflammatoires dont les mastocytes, responsables de la dégranulation y compris des peptides responsables de la dégradation du collagène de type IV, au niveau de la jonction dermoépidermique, permettant la migration du pigment épidermique jusqu'au derme.
En 2025 hydroquinone reste le traitement de premier choix.
Orateur : Prof Laila BENZEKRI (Maroc)
Le mélasma se traduit par des macules et plaques symétriques pigmentées des zones photo exposées, à bordures irrégulières principalement du visage zone centro faciale, malaire, mandibule).
Le mélasma peut être extra facial touchant le cou, les faces d ‘extension des bras, le haut du dos.
Les diagnostics différentiels sont faits à l'aide de l'examen à la lampe de Wood, du dermatoscope, de la RCM ainsi que des biopsies :
On distingue les pigmentations d’origine inflammatoire :
Mais aussi : érythème dyschromique persistant et dermatose pigmentée de contact.
Et des autres origines :
Ne pas oublier non plus les acanthosis nigricans, lupus discoïdes, photosensibilités, mélanose de friction, mastocytoses, et la poïkilodermie
Orateur : Dr Patricia APT DRUCK (Chili)
Le laser est utilisé en seconde intention dans le mélasma. Il faut utiliser des lasers superficiels ne produisant pas d’inflammation (et donc pas d’érythème) pour les phototypes foncés, sinon on risque l’aggravation sous traitement.
Une étude rétrospective sur 100 patients retrouvait une amélioration significative du MASI après traitement par laser Thulium fractionné 1927 nm. Il possède un coefficient d’absorption de l’eau intermédiaire. Le traitement des lésions superficielles est moins douloureux.
Des lasers combinés erbium et thulium peuvent être utilisés en réjuvénation, mais lorsqu’il s’agit de peaux foncées, on n’utilise uniquement le thulium 1927 nm.
En mode fractionné, on traite uniquement entre 5 et 48% du tissu, laissant le reste intact ; la cible est uniquement dermique, préservant la couche cornée et la jonction. A cette profondeur, on joue sur la pigmentation, la texture, (et éventuellement les kératoses actiniques)
Il faut évidemment prévenir les récidives avec un traitement combiné.
Une méta-analyse de 2022 montrait une efficacité, du traitement par laser du melasma, avec toutefois un risque d'hyperpigmentation chez les patients de phototype élevé.
Orateurs : Dr Mukta SACHDEV (Inde), Dr Valeria CAMPOS (Brésil), Dr Rahul PILLAI (Inde)
L’examen à la lampe de Wood recherche une fluorescence signant un pigment épidermique, prédictif de meilleure réponse au traitement ; en dermoscopie on recherche une pigmentation reticuloglobulaire brune (vs gris ou bleu du pigment plus profond)
On considère actuellement le melasma comme une forme de photo vieillissement plurifactoriel (pollution, hormones, génétique, microbiome, origine vasculaire). On observe des mastocytes au contact des zones d’élastose du melasma. L’histamine libérée provoque également la pigmentation. : la loratadine (anti H1) pourrait être une piste de traitement intéressante
Tous les rayons lumineux participent à la stimulation dans le melasma : les UV produisent des réactifs de l’oxygène, la lumière visible induit une pigmentation plus intense et durable. Le récepteur mélanocytaire au VEGF est activé par les radiations UV.
Le meilleur écran pour s’en protéger est celui qui sera appliqué réellement et avec envie par le patient. Idéalement contenant une protection UV minérale large spectre et visible (oxyde de zinc, fer ou titane) permettant de refléter les rayons et conseiller un fond de teint associé.
Outre l’acide tranexamique oral, la mélatonine, les caroténoïdes, le polypodium sont discutés comme adjuvants.
Le thiamidol est un puissant inhibiteur de tyrosinase. Il n’y avait pas de différence significative de MASI entre l’application locale à 2% 2 fois par jour, et l’hydroquinone (étude contrôlée randomisée).
L’isobionic-amide inhibe à la fois le transfert dans le mélanosome et la tyrosinase. Comparé au Klingman modifié contre placebo, il permet une réduction significative de la sévérité du mélasma.
Le glutathion 500 mg P.O. ou suspension topique à 2% est prescrit pour ses propriétés anti oxydantes et d’inhibition de la tyrosinase. Il permet de rerouter la production de mélanine vers la phéomélanine. Une administration combinée orale et topique a montré une efficacité accrue et statistiquement significative lors d'une étude randomisée en double aveugle de 2021 sur petit effectif.
Les rétinoïdes : le rétinol, le tazarotène, le rétinaldéhyde, l'adapalène et l'ATRA sont utilisés comme dépigmentant dans le mélasma : ils agissent sur la réduction de l'activité de la tyrosinase, du transfert de mélanine, de la régénération des kératinocytes et augmente la perméabilité de la couche cornée.
Le niacinamide/nicotinamide (dérivé de la vitamine B3) accro à la synthèse de céramide et la différenciation kératinocytaire, il possède un effet anti-inflammatoire.
L'acide azélaïque, dérivé du pityrosporum inhibe faiblement la tyrosinase, peut être utilisé chez la femme enceinte ou allaitante à 10 ou 20 % 2 x par jour.
Le nettoyage de la peau joue également un rôle puisque le mélasma semble plus répandu dans les zones de forte pollution.
Le rôle des hormones : les récepteurs aux œstrogènes des mélanocytes stimulent la mélanogénèse. Le mélasma est plus fréquent chez les patientes utilisant une contraception contenant des œstrogènes et chez les hommes traités par des dérivés d'œstrogène pour le cancer de prostate.
Des associations d'antiœstrogènes (tamoxifène ou antiaromatases) et d'inhibiteurs du VEGF (bévacizumab) sont actuellement à l'essai.
Le microbiome influe également négativement le mélasma : certaines familles bactériennes sont plus fréquemment retrouvées au niveau cutané (par exemple Collinsella spp.). Elles pourraient influencer le métabolisme des œstrogènes. Le microbiome digestif pourrait également être impliqué, sous-tendant l'utilisation future de prébiotiques probiotiques et post-biotiques.
La metformine par le biais de la voie des map kinase diminue l'accumulation d'AMPc ce qui inhibe la mélanogenèse. Toutefois sa faible lipophilie requiert de très grandes concentrations pour un usage topique. Une formulation en lotion à 30 % 2 x par jour on fait l'objet d'étude randomisée : il n'y avait pas de différence significative entre la metformine et le trio de Kligman.
La malassezin issue de M. Furfur, Induit une apoptose mélanocytaire. Une étude contre placebo d'une forme topique appliquée 2 x par jour montrait une réduction de l'hyperpigmentation et une absence de récidive à huit semaines.
On retrouve des antécédents familiaux de mélasma chez environ 60 % des patients. On retrouve une dérégulation du gène H 19 et 1 activation des gènes codant pour TYR et MITF. MITF est donc une cible et des crèmes contenant des MITF-siR ont fait l'objet des premières études.
L'acide tranexamique est proposé à la dose de 500 à 1500 mg/jour en 2 ou 3 prises. Des doses bien supérieures ont également montré un profil de tolérance (4,5 g/jour). L'action est visible au bout de 8 à 12 semaines seulement. Il est aussi utilisé sous forme topique entre 2 et 5 % ou intradermique. Il diminue la prolifération vasculaire et l'infiltration mastocytaire, inhibe FGFR et PGE2, stimulant du mélanocyte. Il peut occasionner des troubles digestifs et des irrégularités menstruelles. Son risque thrombophilique le contre indique en cas d'antécédents thrombo-emboliques (personnel ou familial), de prise d'œstrogènes ou de tabagisme.
La combinaison fluocinolone, hydroquinone et trétinoïne est la seule approuvée par la FDA pour le traitement topique du mélasma. L'hydroquinone est un inhibiteur de la tyrosinase qui inhibe la conversion de la tyrosine en mélanine. La trétinoïne renouvelle les kératinocytes. Les dermocorticoïdes réduisent l'inflammation. De très nombreux produits existent sur le marché, d’efficacité inégale.
L’acide kogique, d’origine fongique, a une action anti oxydante et inhibe la tyrosinase. Utilisé à une concentration de 1 et 4%Il est relativement peu coûteux. Son action est visible après 2 à 4 semaines de traitement. Il a toute sa place dans le traitement d'un mélanome débutant.
L'acide ascorbique/vitamine C utilisé à une concentration de 15 à 20 %, il interagit avec le cuivre dans la tyrosinase. Il permet également d'une amélioration de la texture cutanée.
Les exosomes sont bien sûr également une piste pour le mélasma, de même que toutes les nanoformulations.
Le Polypodium leucotomos est utilisé pour son action adjuvante antioxydante et anti-inflammatoire. Il peut être administré en topique ou oralement de 250 mg à 1 g/jour, 30 à 60 min avant une exposition avec prise toutes les 4 heures en cas d’exposition longue.
Le Pycnogenol , extrait de pin maritime : une étude du JEADV contre placebo en 2021 à 75 mg 2f/j suggérait une efficacité devant être confirmée. Il pourrait également être proposé en adjuvant de 50 100 mg/jour pendant trois mois avec un très bon profil de tolérance.
La carcinine, de par son action contre la glycation peut également être une piste intéressante. Les produits de glycation avancée, résultats de la glycation de protéines, lipides ou acides nucléiques, induisent une production de mélanine par les mélanocytes. De plus, plus la peau co tient des produits de glycation, moins elle récupère favorablement après des agressions (y compris les traitements esthétiques, laser, peelings, chirurgie, etc. On peut proposer la carcinine seule à 200 à 10000 mg/j ou en association de 50 à 1000 mg/j.
On peut aussi inciter les patients à enrichir leur régime alimentaire avec des éléments riches en carotènoïdes et en acide ascorbique.
Orateur : Dr Suzan OBAGI (Etats-Unis)
Le melasma est une photodermatose inflammatoire : la production du pigment résulte des signaux inflammatoires produits par les cellules adjacentes du mélanocytes (kératinocytes, fibroblastes et cellules endothéliales) puis des signaux autocrines du mélanocyte activé.
Il faut donc réduire la production de mélanine, son transfert aux kératinocytes, les altérations de la basale ainsi que l'inflammation périvasculaire et la fonction fibroblastique, en augmentant la collagénèse.
Les écrans minéraux permettent de refléter les UV tandis que les écrans chimiques absorbent les rayons en partie, créant ainsi des dommages oxydatifs à l'échelon cellulaire.
Les UVA atteignent la peau quelque soient les conditions météorologiques. La pigmentation résulte de la stimulation à la fois des UV, des HEV/VIS (visibles de haute énergie), et des IR qui pénètrent respectivement de plus de plus profondément selon la longueur d’onde.
Orateur : Dr Carlos Gustavo WAMBIER (Brésil)
L’orateur renvoie aux articles de synthèse du JAAD de 2018 de la société internationale des peeling (IPS), pour retrouver l’ensemble des informations de référence sur les peelings.
Il engage aussi à pratiquer lors d’ateliers (en France, cet aspect de la dermatologie (esthétique ?) ne fait pas partie de l’enseignement pratique pour tous les internes et docteurs juniors et ce conseil n’est pas superflu !). Sur la couleur et le vieillissement dermique l'efficacité d'un peeling est incomparable aux traitements lasers selon l'orateur.
On classe donc les peelings en trois catégories : superficiel, moyen à profond, et profond.
Le peeling profond utilisé est seulement le phénol croton puisqu'il est moins risqué que le TCA à plus de 80 %. De la même façon il existe de très nombreux peelings superficiels, mais seuls les 3 à 4 plus sûrs d'entre eux seront pratiqués couramment.
En action rapide pour renouveler l'épiderme, on utilisera un peeling superficiel qui aura une action temporaire. Le peeling superficiel est donc très efficace sur la pigmentation mais les récidives précoces car l'on supprime le symptôme mais pas la cause. Le peeling à la trétinoïne aussi appelé peeling à l'acide rétinoïque ou peeling jaune, est couramment utilisé. Il est indolore et rapide et peut être utilisé également sur les zones sensibles comme le cou. Le patient effectue un rinçage au domicile après 4 heures, il peut être répétée toutes les semaines à deux semaines en fonction de l'efficacité souhaitée. Les nombreuses marques sont commercialisées, certains peelings comportant des agents éclaircissants : il semble plus intéressant d'appliquer ces agents éclaircissants quotidiennement.
Le peeling superficiel à l'acide glycolique est une procédure efficace et sans risque dans le mélasma (méta-analyse de 24 études sur plus de 1000 patients publiés en 2024). Il peut être une solution adjuvante focalement, après une bonne préparation préalable.
Les peelings moyens à profond sont moins souvent utilisés. Plus l'action est profonde plus on risque l'inflammation et donc une pigmentation post-inflammatoire. On peut toutefois proposer un type superficiel suivi par un TCA (à 15 % dans le mélasma). La courbe d'apprentissage pour les TCA est de 50. On peut le proposer aux phototypes jusqu'à III et IV. On rappelle l'importance d'1 dose test avant le peeling lui-même. La solution de Jessner modifiée comporte de l'acide salicylique, de l'acide lactique, de l'acide citrique et de l'éthanol. Le changement du résorcinol pour l'acide citrique occasionne moins de pigmentation post-inflammatoire, moins d'érythème persistant, d'allergie de contact, et est exempte de toxicité thyroïdienne.
Enfin, l'usage du peeling profond, utilisé également en réjuvénation permet un renouvellement de tout le derme en préservant les follicules pileux : il est plus risqué mais peut permettre une rémission longue, il supprime les fibroblastes sénescents. Il doit faire l'objet d'études contrôlées pourrait être une proposition thérapeutique permettant une réponse durable.
Orateur : Pr Cesar GONZALEZ ARDILA (Colombie)
Le mélasma pouvait affecter l'organisme au-delà de la peau : les patients qui sont sujets aux mélasma ont fréquemment des anomalies métaboliques lipidiques ou glycémiques) associées. Des taux élevés d'acide arachidonique pro inflammatoire et d'acide urocanique (espèces réactives de l'oxygène) sont retrouvés dans le plasma. A contrario les taux d'antioxydants comme la cystéine, la mélatonine, le tryptophane et la phénylalanine sont trouvés abaissés.
L'hydroquinone est une molécule utilisée depuis 1975, le recul est important : aucun cancer n'a été décrit. Lorsque utilisée sous contrôle médical (2 à 5 %), elle n'occasionne pas d'effet indésirable (recul de plus de 20 000 patients en 72 études). Pour éviter les cas d'ochronose, l'usage doit être limité à quatre ans et moins de 4 %. Les effets indésirables sont le résultat de produits alternatifs comportant du mercure des corticostéroïdes et administrés sans contrôle médical.
Toutefois des études récentes montrent une efficacité similaire entre les produits contenant de l'hydroquinone et d'autres topiques (acide tranexamique, cystéamine et acide kojique). Une méta-analyse montre aussi que l'usage de l'hydroquinone seule doit être abandonné, pour préférer une combinaison des lasers par exemple.
Dans tous les cas la prescription d'hydroquinone doit être intermittente, probablement pour 6 à 9 mois.
Orateur : Dr Sabine ZENKER (Allemagne)
Le mélasma est donc lié à une discrimination des signaux intracellulaires (tyrosinase), extracellulaires (voie hormonale : alpha MSH, inflammation : prostaglandine, PKA, thromboxane, leucotriènes), vasculaire : VEGF, tissulaire : histamine et mastocytes.
Les skins boosters dans le mélasma sont proposés en mesures d'accompagnement.
Les allégations sont les mêmes qu'en réjuvénation : acide hyaluronique pour l'hydratation et le volume, polynucléotides pour la régénération, hydroxyapatite, acide polylactique, peptides et acides aminés pour la synthèse du collagène et de l'élastine, vitamines, glutathion, coenzymes (NDA+, Q10) et minéraux comme antioxydants, acide tranexamique et niacinamide pour le contrôle pigmentaire et enfin PRP et exosomes comme substrats autologues.
Les injections d'acide hyaluronique sont considérées comme sans risque en cas de mélasma il est toutefois préférable d'éviter les zones de mélasma dans la mesure du possible, les autres fillers cependant sont à risque d'augmenter l'inflammation et la pigmentation donc injecté profondément et être très prudent pour les phototypes élevés.
Une publication dans Pigment Cell Melanoma Res. de 2024 montre l'effet des UV sur les signaux cholinergiques : L'acétylcholine est relarguée dans la peau après irradiation UV ce qui cause une activation des mélanocytes via les récepteurs nicotiniques et muscariniques, ainsi que des kératinocytes. De ce fait l'activité de MITF est amplifiée induisant une mélanogenèse. L'acétylcholine est également produite dans la peau par les kératinocytes, les mélanocytes et les fibroblastes, les cellules endothéliales et nerveuses.
Utiliser la toxine botulique qui bloque l'acétylcholine pourrait donc non seulement agir sur l’inflammation via la mise au repos musculaire mais aussi agir sur à la fois directement les mélanocytes la mélanome génération UV induite, les kératinocytes, l'afflux sanguin et l'inflammation. Une étude randomisée en hémi face publiée cette année retrouvait en effet une efficacité significative de la toxine botulique intradermique sur les scores MASI après 1 injection.
Rapport écrit par Dr Marina THOMAS (Dermatologue, France)
Orateur : Dr Diala HAYKAL (France)
L'intelligence artificielle peut augmenter les capacités à tout niveau de la prise en charge clinique : la prise de rendez-vous au suivi de traitement en passant par la consultation d'accueil, le diagnostic et la proposition de traitement et sa réalisation. Les médecins sont de plus en plus nombreux à comprendre l'enjeu et intégrer progressivement l'intelligence artificielle dans la pratique.
En cosmétique et en médecine esthétique, la réalité augmentée et la réalité virtuelle offrent la possibilité aux patients d'anticiper les résultats et les suites post-procédure de leur traitement. Ces outils permettent de simplifier les suites opératoires ou post-procédure et d'augmenter la satisfaction du patient.
L'utilisation de laser guidé par intelligence artificielle permet une avancée notable en termes de précision, sécurité et personnalisation du traitement.
L'intelligence artificielle peut être appliquée aux ultrasons pour guider les procédures esthétiques du visage afin de visualiser l'anatomie, minimiser les risques, guider et suivre la procédure en temps réel et personnaliser le traitement offert.
L'intelligence artificielle permet également d'analyser en temps réel, en continu et avec précision les données issues de toutes sortes de capteurs, avec des implications évidentes en dermatologie.
Orateur : Dr Frederic FLAMENT (France)
De 2007 à 2025 des atlas ont progressivement été réalisée grâce à la collecte de données cliniques issues de l'ensemble de la planète. Ils permettent de répertorier les caractéristiques des populations et la variété des signes cliniques, ici appliqués au vieillissement cutané. Ces outils de score clinique rendent possible la standardisation des études cliniques par le biais d'échelles.
L'analyse de l'ensemble de ces données permet d'établir des trajectoires de vieillissement comparées à une ligne classique. Il est établi que le vieillissement est dicté par des caractéristiques biologiques qui sont ici analysées.
Le vieillissement accéléré survient lorsque l'organisme est soumis à divers facteurs aggravants (UV, pollution, stress etc.) qui vont avoir une pondération différente selon l'origine ethnique et les caractéristiques génétiques.
Il est possible après analyse d'une image actuelle de prédire et simuler le vieillissement afin de faire prendre conscience au patient des modifications à venir et attirer l'attention sur les moyens à entreprendre pour l'atténuer.
Il est également possible d'analyser les biomarqueurs disponibles, invisibles, pour prédire l'évolution des fonctions cutanées. Des dispositifs permettent actuellement une analyse en 5 minutes des protéines de surface de la peau (lipocaline, enzyme de dégradation de l’insuline. chitinase 3 like 1, transglutaminase 3 et filagrine 2). Un échantillon est prélevé par scotch test, les biomarqueurs protéiques sont guidés par capillarité jusqu'à des anticorps couplés à des nanoparticules fluorescentes, ensuite analysées par un faisceau laser.
On peut donc établir un âge physique, un âge biologique et un âge chronologique, et adapter les mesures préventives et les traitements selon les facteurs prédictifs de réponse.
Les solutions connectées déclinent un système O+O (off line et on line) : en vie réelle avec des appareils de précision et un contact patient, et en ligne avec le recueil continu des données (localisation, données météorologiques et physiques, données biologiques, retour patient sur les réseaux, etc.)
L'intelligence artificielle doit permettre pour les praticiens d'améliorer leurs pratiques, pour les patients d'éclairer leur choix de traitement, améliorer le suivi la prise en charge autant que de permettre d'isoler de nouvelles voies de recherche.
Orateur : Dr Ofir ARTZI (Israël)
L'orateur a présenté une solution d'intelligence artificielle de simulation des résultats esthétiques après injection par fillers. L'application in vivo de cette solution pourrait permettre à terme d'obtenir une importante base de données exploitables. En effet l'enregistrement des images initiales, puis après que les procédures auront été réellement effectuées ainsi que l'évolution post-procédure, permettra de comparer de façon objective l'efficacité alléguée des produits.
Orateur : Dr Jilliana MONNIER (France)
Plusieurs applications utilisant l'intelligence artificielle sont disponibles sur Internet et proposent une détection des nævi, des éruptions ou de l'étendue de l'acné. Lorsqu'on les utilise, on n'est malheureusement pas informé de la qualité et la quantité des données utilisées pour entraîner l'intelligence artificielle. Des études ont été menées afin d'estimer la sensibilité et la spécificité des applications disponibles : en 2017 les résultats étaient très hétérogènes avec des sensibilités variantes entre 0,3 et 0,7.
Il faut savoir que les performances des tests (sensibilité, spécificité, ainsi qu’aire sous la courbe ROC) dépendent essentiellement de la qualité des données utilisées lors de l'apprentissage de l'algorithme.
L'algorithme peut être entrainé,
Les modèles en deep learning, peuvent fournir des prédictions obtenues sans que l’utilisateur ait pu comprendre le raisonnement utilisé pour parvenir au résultat : il s’agit de black boxes.
Ainsi si les images utilisées pour l’apprentissages sont de mauvaise qualité, comportement par exemple beaucoup d’artéfacts, le deep learning les aura potentiellement pris en compte comme pertinents durant son apprentissage, et les prédictions réalisées à partir d critères non pertinents.
Actuellement, la plupart des prédictions obtenues lors de l’analyse de lésions pigmentées tiennent peu compte des caractéristiques du patient pourtant primordiales en analyse de lésions pigmentées (âge, localisation, sexe, antécédents, mutations, etc.et toutes les autres lésions du patient).
Certains appareils fournissent un naevogramme qui permet d’afficher tous les nævi d’un patient et d’en effectuer la comparaison et le tri, ainsi que des outils de détection des changements au fil du temps. Ici aussi la critique de l’utilisateur est essentielle, car elle permet de remettre des prédictions dans leur contexte : naevus en croissance, régression, etc.)
Les difficultés rencontrées lors de l’utilisation de systèmes de détection sont : le stockage des données, la maintenance informatique, le temps d’examen et d’explication au patient.
Orateurs : Dr Jennifer PEARLMAN (Canada), Dr Anurag Tiwari (India)
L’intelligence artificielle appliquée en médecine permet d’améliorer au moins 6 axes de travail.
Augmenter la connectivité des patients, par le biais d’objets connectés, capteurs, alarmes. Il existe différents types de solutions assistées par IA en dermatologie : analyse et surveillance après cartographie corporelle totale, analyse du visage par miroir intelligent, imagerie 3D ou dermoscopie connectée. Ces appareils permettent des acquisitions simultanées par différents capteurs (lumière polarisée, UV, LED multidirectionnelle, etc.), des quantifications, mesures, comparaisons avec une très bonne reproductivité, certaines applications proposent par exemple un guidage permettant de reproduire la position exacte des photos précédentes.
Augmenter la pertinence diagnostique : une étude récente montre que l’IA (générateurs de diagnostics et LLM) est plus efficace que les spécialistes pour établir des diagnostics difficiles (80 vs 30% de diagnostics corrects effectués à la lecture des cas cliniques du NEJM 2021 à 2024). Pour chaque pathologie dermatologique, des applications ont été développées : dans le cas de la dermatite atopique, l’acné ou du psoriasis, pour quantifier l’atteinte, la sévérité, et proposer un schéma thérapeutique ; dans la rosacée et l’onychomycose par exemple pour asseoir le diagnostic et éliminer les diagnostics différentiels, avec une pertinence de 90% pour cette dernière.
Augmenter la pertinence des traitements : la Mayo clinic et IBM ont établi un partenariat pour élaborer des traitements sur mesure. Des applications proposent, après prises de photos par les consommateurs, une analyse des caractéristiques de la peau puis des suggestions/prescriptions cosmétiques ou thérapeutiques adaptées, voire personnalisées avec une formulation spécifique à l’utilisateur pour un moment et une zone donnée.
Créer de nouvelles thérapeutiques : les vaccins ARN utilisés pour le covid et en oncologie en sont le produit.
Surveiller les données des patients : afin de gagner du temps de soin, et solutionner partiellement les pénuries de soignants
Améliorer les soins : par exemple par chirurgie robotisée assistée par IA. Il existe des solutions techniques permettant à présent une délivrance de médicaments ou une application de topiques automatisée, selon la cartographie établie en direct. Les dispositifs énergétiques (lasers, radiofréquences, etc.) peuvent à présent être robotisés et assistés par l’IA, afin d’adapter selon les individus et les zones la fréquence des pulses, l’intensité, la durée de traitement, et de réduire la fatigue de l’opérateur. L’IA permet aussi l’apprentissage en conditions sécurisées de situations cliniques variées, par les simulations théoriques comme pratiques.
La dernière avancée est celle de l’agent intelligent, voué à diminuer de moitié la charge de travail des professions intermédiaires et supérieures, en réalisant des tâches complexes. Il peut à terme permettre de créer par exemple une présence automatique sur les réseaux sociaux, d’organiser les prises de rendez-vous, et les envois de courriels (informations patients, remplissage de questionnaires en ligne avant ou après la consultation, consignes, conseils post procédure, assistance et réponse aux questions 24/24, coordination des agendas et optimisation du temps médical et des ressources matérielles, etc…)
Le recul sur ces nouvelles technologies est absent, et soulève des problèmes :
Orateur : Maris KLEPETKO (Autriche)
Certains éléments anatomiques du visage suffisent à inspirer la confiance à son interlocuteur (tête du sourcil haute, yeux grands ouverts, commissures relevées). Un algorithme a été développé à partir de plus de 10 000 images standardisées et plus d’un million d’avis : les images ont été classées pour obtenir des notations vis-à-vis de certains traits perçus : séduisant, dominant, en bonne santé, naturel, heureux, reposé, inspirant la confiance, compétent, effrayant. Le processus de validation est une étape cruciale pour le développement de l’algorithme L’IA est ensuite utilisée pour proposer un plan de traitement destiné à modifier ces caractéristiques pour obtenir le rendu souhaité.
Rapport écrit par Dr Marina THOMAS (Dermatologue, France)
Orateur : Dr Aditi A. SHARMA (Etats-Unis)
L’orateur a présenté une application utilisant un algorithme d’apprentissage automatique permettant de prédire l’évolution des cicatrices d’un patient.
Chaque cicatrice est différente : longueur, couleur, topographie, texture, prurit ou douleur, vécu du patient. Après avoir collecté les photos de cicatrices, avec leur évolution au cours du temps, une classification est établie ; l’algorithme est entrainé puis testé. Les applications sont : la prédiction de l’évolution de la cicatrice dans le temps, la prédiction de la meilleure solution de fermeture et la prédiction de l’évolution d’une cicatrice après tel ou tel traitement. Le but est de créer une échelle approuvée par la FDA et servant de référence lors des études cliniques sur le sujet.
Le marché de la cicatrisation est estimé à ce jour à 30 milliards de dollars, et atteindra 76 milliards en 2034.
Orateur : Dr Omar BADRI (Etats-Unis)
Outre Altantique, la problématique du dermatologue est identique à la nôtre : la plupart des problèmes dermatologiques sont traités par des non-dermatologues, ou par automédication. Tout le monde cherche des solutions pour trier les demandes et raccourcir les délais de prise en charge.
Après la publication en 2024 d’un article dans Nature, une application d’aide au diagnostic a été développée. L’article montrait que l’aide de l’IA, permet à tous les médecins (dermatologues ou généralistes) d’augmenter considérablement leur pertinence diagnostique. Le pourcentage de prédictions correctes ou incorrectes pour les 50 diagnostics les plus courants était présenté dans une matrice de confusion.
Dans l’application, la photo transmise par le patient est évaluée, et rejetée si impropre au diagnostic (flou, luminosité, etc.), puis classée en haut ou bas risque. Une téléconsultation peut ensuite être proposée.
Orateur : Pippa HARMAN
Au Royaume Uni, 69% des patients qui ont un problème dermatologique choisissent l’automédication. En moyenne, le patient passe une heure trente pour rechercher le produit adéquat, mais la recherche se solde dans 62% des cas par un achat non pertinent.
Pour répondre à cette problématique, des applications utilisant plusieurs types d’IA ont été développées :
L’oratrice nous a présenté son application qui combine :
Pour éviter les hallucinations (réponse erronée), une base de données de 5 ans d’exemples de réponses a été utilisée.
L'algorithme s’améliore par apprentissage par renforcement à partir du retour d’expérience humain (feedback loop ou RLHF). Il s’agir d’un type de machine learning (ML) qui utilise les retours d’expérience pour optimiser le modèle pour améliorer l'efficacité de l'autoapprentissage.
Les concepteurs de cette application annoncent une amélioration chez 94% des utilisateurs après 6 semaines d’utilisation. Le suivi phot permet aux utilisateurs de constater l’efficacité dans le temps. Le cout d’utilisation est de 20 livres.
Orateur : Dr Monisha MADHUMITA (India)
Pour atteindre des populations isolées et réduire les inégalités d’accès au soin, et répondre au besoin dermatologique en période de pénurie, l’oratrice explique utiliser des technologies complémentaires : diagnostic assisté par IA, téléconsultation, applications médicales mobiles permettant le monitoring, données de géolocalisation permettant notamment d’isoler des zones à risques, des clusters, des zones d’exposition). Les relais humains nécessaires comprennent outre les référents dermatologues, des patients ou des référents non médicaux avec de l’influence sur les populations cibles.
Orateur : Alfonso MEDELA (Espagne)
En Espagne, on compte 3 dermatologues pour 100 000 habitants, avec des zones de déserts, les listes d’attente atteignent 6 à 12 mois. Partant de ce constat, une application avec marquage CE a été développée à destination des soignants, visant à fournir pour chaque cas soumis, les 5 diagnostics les plus probables, parmi 323 maladies dermatologiques référencées, la sévérité, les référentiels et une prédiction de réponse au traitement. Elle permet à des soignants d’ayant par exemple jamais croisé certaines affections rares, de ne pas manquer un diagnostic, d’établir immédiatement un PASI, un SCORAD, etc. et ses variations dans le temps. Elle permet également un triage immédiat des patients
Orateur : Dr Art PAPIER (Etats-Unis)
L’orateur conseille la lecture de l’ouvrage « Thinking, fast and slow » de Daniel Kahneman, pour appréhender le mécanisme qui sous-tend la pensée humaine. Il existe 2 systèmes de pensée :
Le système rapide : sous cortical automatique, lié à l’expérience et la reconnaissance de patterns : préféré par le cerveau humain qui est paresseux.
Le système lent analytique et chronophage (par exemple en médecine, l’élimination des diagnostics différentiels selon l’âge, les traitements, les comorbidités, etc., comme en présence d’un érythème maculo-papuleux)
Le cerveau navigue perpétuellement entre les 2 solutions, rapide et lente.
La solution pour l’humain est l’intelligence augmentée, c’est à dire l’utilisation des outils d’IA pour arriver au diagnostic pertinent. Il existe une différence entre information qui est une donnée qui peut être stockée, déplacée, etc., et connaissance (résultat de l’action humaine volontaire, capacité d’utiliser ces information).
L’IA opère sur des déductions statistiques, elle n’a pas de « bon sens ». La connaissance humaine s’appuie sur le raisonnement, l’adaptation, la contextualisation.
Le risque est la confiance excessive dans les résultats de l’IA et la dégradation de la connaissance humaine. Il faut dépasser cette étape de régression de compétences et utiliser l’IA comme tremplin pour résoudre des problèmes complexes, en construisant une connaissance collaborative IA assistée et une intelligence augmentée.
Les nouvelles applications devront intégrer des techniques de RAG (Retrieval-Augmented Generation ou génération augmentée de récupération) qui extraient des données de sources internes et externes pour augmenter la qualité et la précision des réponses issues de modèles linguistiques génératifs.
Orateur : Dr Jane YOO (Etats-Unis)
Les techniques d’IA et par conséquent la législation inhérente sont en perpétuel changement. En 2021 l’OMS édicte dans son premier rapport mondial avec 6 principes pour l’IA en santé.
En mars 2024, le premier cadre légal au monde sur l’IA est publié par l’Union Européenne. Il encourage l’innovation au sein de l’UE, identifie les risques liés à l’IA et crée un cadre juridique pour sécuriser le marché de l’innovation et le respect des droits fondamentaux. Les systèmes d’IA sont classés en bas, général, (LLM et IA générative) haut risque (les appareils médicaux), et systèmes interdits (comme la notation sociale par points). Les obligations des produits médicaux utilisant IA prennent effet 36 mois après l’entrée en vigueur du texte. Elles comprennent la gestion du risque, la gouvernance des données, la transparence et la supervision humaine. Le législateur a anticipé les problèmes de surveillance, de confidentialité, de documentation et de veille sanitaire.
Aux USA, la nouvelle présidence vient de rebattre la carte avec la révocation des barrières admises depuis 2023 : 100 milliards de dollars sont d’ores et déjà investis dans le développement, avec à terme 500 milliards prévus en 4 ans, et dans moins de 180 jours, un plan sera soumis à la présidence par les experts choisis, visant à assurer le leadership américain en matière d’IA. Le 22 janvier, la présidence américaine a par ailleurs bloqué les communications et rapports des agences nationales en santé (FDA, CDC, etc.).
Du côté de la Chine, le lancement du LLM Deepseek pourrait également des problèmes de sécurité des données et d’indépendance.
La Chine, l’Inde, la Corée du sud, le Japon, l’Australie et Singapour, Brésil, Argentine, Chili, Colombie, EAU et l’Arabie Saoudite possèdent des textes encadrant les pratiques.