0 professionals
Coup d'œil du congrès CARD 2024
Coup d'œil du congrès CARD 2024
Améliorez vos connaissances professionnelles en profitant de nombreux services exclusifs dans le domaine de la dermatologie : plus de 500 visuels de pathologies, des cas cliniques, des vidéos d’experts…
Bénéficiez d’options uniques telles que l’offre de contenus audio et de supports à proposer à vos patients.
Restez informé(e) des événements et des webinaires à venir, des dernières publications scientifiques et des innovations produit.
Vous avez déjà un compte ? Se connecter
Cette année, nous célébrons les 40 ans du CARD ! Cette aventure a débuté à Lyon en 1982 avec la création de la Société de Recherche en Dermatologie (SRD), axée sur la recherche fondamentale, par le Pr Jean Thivolet et la création du Centre de Biologie de la Peau en 1983 par Daniel Schmitt. Le premier congrès a eu lieu à Toulouse en 1983.
En 1992, le premier Forum Peau Humaine et Société a eu lieu, et en 1997, l'instauration du European Journal of Dermatology avec Jean-François Nicolas.
Sujets liés
Modérateurs : Fabien Chevalier & Soline Estrach
Soline Estrach, IRCAN, Nice
La croissance et le maintien du follicule pileux se déroulent selon un cycle en trois phases :
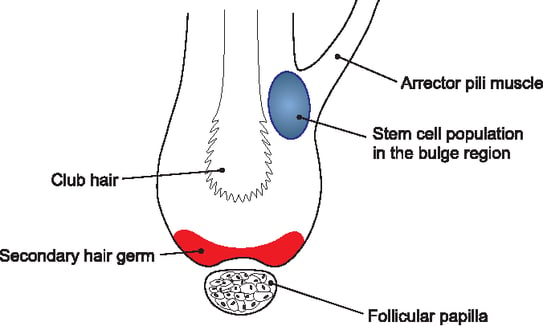
Andrei A. Panteleyev, Colin A. B. Jahoda, Angela M. Christiano; Hair follicle predetermination. J Cell Sci 1 October 2001; 114 (19): 3419–3431. doi: https://doi.org/10.1242/jcs.114.19.3419
Le signal initial d'activation (via la voie de signalisation Wnt) provient de la papille dermique (follicular papilla). Cependant, d'autres signaux d'activation des cellules souches émanent de la niche du follicule pileux (bulge). L'hypothèse est que les cellules souches épithéliales produisent leur propre niche, permettant ainsi le maintien de la structure du follicule pileux.
Pour étudier les signaux conduisant à la formation et au maintien de cette niche, des souris transgéniques pour un gène rapporteur ont été utilisées. Le gène de la GFP (Green Fluorescent Protein) a été inséré à la suite du gène Lrig1 (marqueur des cellules souches épidermiques du follicule pileux). Ainsi, en microscopie à fluorescence, les cellules souches exprimant Lrig1 sont visibles en vert au sein du follicule pileux et peuvent être triées par cytométrie en flux afin de les comparer aux kératinocytes basaux.
La comparaison du profil d'expression des gènes des cellules souches épidermiques par rapport aux kératinocytes basaux montre que les voies de signalisation surexprimées dans les cellules souches impliquent les intégrines (Int), et tous les signaux en aval de la matrice extracellulaire (matrisome), dont la fibronectine.
L'analyse en microscopie à fluorescence de coupes de queue et de peau du dos de souris montre la formation d'un réseau de fibronectine spécifique de la phase d'activation des cellules souches. Chez des embryons de souris où une délétion du gène de la fibronectine est induite avant l'activation endogène de la pousse de poils, il existe une absence totale de pousse de poils avec un affinement notable des poils par la suite (similaire au phénotype observé lors du vieillissement). Lorsque la délétion est réalisée plus tard dans le développement de la souris, les mêmes résultats sont obtenus. De plus, une repousse des poils est observée chez les souris délétées pour le gène de la fibronectine mais transfectées de manière exogène avec ce gène.
En l'absence de fibronectine, une grande partie des cellules marquées Lrig1 se localise au niveau de l'infundibulum du poil (au lieu de migrer vers la matrice du poil, à la base du poil). Cependant, le marqueur de prolifération Ki67 n'est pas augmenté dans ces cellules. Ce n’est donc pas une augmentation de la prolifération des cellules mais un processus de migration qui intervient lors du processus de régénération.
En résumé, l'expression de la fibronectine par les cellules souches épithéliales est nécessaire pour la régénération des follicules, la localisation des cellules souches du follicule pileux (Lrig1 positives) au sein des follicules et le maintien de cette population.
Pour étudier la cascade de signalisation induite par la fibronectine, un modèle de souris KO pour le corécepteur SLC3A a été développé. En effet, il est impossible de déléter directement le gène des intégrines sans risquer de perdre la cohésion des kératinocytes. En l'absence de SLC3A, il n'y a pas de différence d'expression de la fibronectine au niveau de la peau totale des souris, mais un défaut d'assemblage du réseau de fibronectine est observé. Dans ce modèle, les cellules Lrig1 se retrouvent délocalisées dans l'infundibulum, comme observé précédemment chez les souris KO pour la fibronectine, confirmant le rôle spécifique de la fibronectine dans la localisation des cellules souches du follicule pileux.
Ainsi, la création d’un chemin de migration de fibronectine permet l'induction du signal de régénération via un signal de mécano-transduction médié par les intégrines. En l'absence de SLC3A, ce signal de mécano-transduction est perdu. L'activation de la cascade Int/SLC3A2/mécano-transduction participe au potentiel régénérateur des cellules souches.
En conclusion, les cellules souches doivent être capables d'assembler la fibronectine pour induire la signalisation de prolifération et maintenir un état non différencié sans s'engager dans une voie de différenciation.
Chloé Chave, Lyon
Le microenvironnement mécanique joue un rôle crucial dans l’homéostasie des kératinocytes. En effet, il a été démontré que sur un support rigide, les kératinocytes adoptent un comportement prolifératif, tandis que sur un support mou, ils ont tendance à se différencier, tout en conservant leur capacité à proliférer.
La synaptopodine est une protéine exprimée dans les neurones et les podocytes des reins. L’acide rétinoïque augmente l’expression de cette protéine. Des analyses par microscopie à fluorescence et des analyses des ARN montrent qu’elle est également exprimée dans les cellules de la peau, notamment au niveau de la couche basale de l’épiderme. Le but de l’étude présentée dans cette communication orale est d’étudier le rôle de cette protéine dans l’homéostasie des kératinocytes.
Il a été démontré que l’expression de la synaptopodine diminue au cours de la différenciation kératinocytaire. Les kératinocytes KO pour la synaptopodine continuent de proliférer normalement, mais des tests de blessure montrent une réduction de la migration des kératinocytes en l’absence de synaptopodine. La littérature indique que la synaptopodine est liée au cytosquelette, en particulier aux filaments d’actine. En western blot avec immunoprécipitation, la synaptopodine et la kératine 14 co-précipitent, démontrant une interaction entre les deux protéines. Ce résultats est soutenu par la colocalisation dans la cellule de ces deux protéines en microscopie à fluorescence.
La kératine 14 est connue pour être impliquée dans l’adhérence des cellules. La synaptopodine pourrait donc être un régulateur négatif de la kératine 14. Ainsi, dans un contexte de microenvironnement rigide, il y aurait une polymérisation de la kératine 14 et une rigidification de la membrane, avec un rôle de l’acide rétinoïque capable d’induire l’expression de la synaptopodine, exerçant un rétrocontrôle négatif sur la polymérisation de la kératine 14. Ainsi, la synaptopodine permettrait de limiter la rigidité cellulaire promue par la kératine 14 et de maintenir l’homéostasie proliférative de la cellule sans induire de différenciation.
Laure Gibot, SOFTMAT, Toulouse
Le stress oxydatif génère des espèces radicalaires caractérisées par un électron célibataire sur la couche périphérique de l'atome. Ces espèces, instables et potentiellement dangereuses, comprennent deux types principaux : les espèces réactives de l'oxygène (ROS) et de l'azote (NOS). Les espèces oxydantes sont connues pour induire des dommages oxydatifs au sein des cellules, mais paradoxalement, elles jouent également un rôle crucial dans la signalisation cellulaire. En conditions physiologiques, l'équilibre redox est maintenu. En cas de stress oxydatif, un déséquilibre se produit, soit par une production accrue d'espèces oxydantes, soit par une insuffisance d'antioxydants.
Laure Gibot présente un modèle d’épiderme humain reconstruit utilisé pour étudier les effets du stress oxydatif. Les cellules produisent leur propre matrice en présence de vitamine C après quatre semaines, créant ainsi un substitut dermique manipulable sous différentes conditions.
Le premier stress étudié est induit par des champs électriques pulsés, provoquant une électroporation et des défauts au niveau des membranes cellulaires. Ce système, déjà utilisé dans la vectorisation de molécules au sein des cellules (par exemple, l'électrochimiothérapie pour les cancers cutanés), permet également la fusion cellulaire et, dans certains cas, induit la mort cellulaire. Après application du champ électrique, une diminution de la production de TGF-β est observée, accompagnée d'une baisse de la synthèse de procollagène I et de collagène I dans le milieu à 24 heures. Ce changement s'accompagne d'une diminution de l'expression de lysyl oxydase et de la transglutaminase 2, impliquées dans la maturation de la matrice extracellulaire. À l'inverse, l'activité des MMP (métalloprotéinases matricielles) augmente jusqu'à au moins 48 heures après électroporation. En présence d'inhibiteurs des MMP, la production de collagène est normalisée. Il est ainsi démontré que les ROS sont responsables de la diminution de la synthèse de la matrice extracellulaire. L'électroporation semble donc générer un stress oxydatif qui remodèle la matrice extracellulaire par une augmentation de l'activité des MMP, conduisant à la dégradation du collagène et à une diminution de sa synthèse. Le stress physique influence donc la synthèse, la maturation et la dégradation de la matrice via la génération de ROS. Cependant, la nature exacte de ces ROS et le mécanisme de leur formation restent à élucider.
Cette action est réversible et pourrait constituer une approche thérapeutique antifibrotique, ou favoriser la délivrance de molécules anticancéreuses.
Un autre modèle de stress présenté par Laure Gibot est la photothérapie dynamique (PDT). La PDT repose sur l'utilisation d'un photosensibilisateur qui, sous l’action d’une certaine longueur d'onde, génère des ROS. Cette méthode a des applications variées comme les traitements anticancéreux ou antibactérien, ou comme méthode de réjuvénation (comblement des rides). Les photosensibilisateurs – souvent des molécules aromatiques hydrophobes – forment des agrégats délétères pour la génération de ROS. L'utilisation de micelles permet d'éviter ces agrégats et favorise l'intégration des photosensibilisateurs dans les cellules.
Dans cette étude, la phéophorbide (Phéo) est utilisée comme photosensibilisateur. En l’appliquant sur des substituts dermiques, les chercheurs démontrent une bonne pénétration de la forme micellaire encapsulée, contrairement à la forme libre. L'objectif est de déterminer les concentrations de Phéo libre ou encapsulée nécessaires pour éviter la cytotoxicité et obtenir un effet sublétal, générant des ROS.
L'analyse transcriptomique révèle que la Phéo libre n'affecte pas l'expression génique des cellules. À l’inverse, la Phéo encapsulée induit des modifications majeures des transcrits, principalement des gènes impliqués dans les voies de réponse au stress oxydatif.
Ainsi, la PDT peut être utilisée pour moduler localement le stress oxydatif, induisant une réponse antioxydante sublétale intéressante des cellules face à ce stress.
Modérateurs : Marion Salou & Marc Vocanson
Marion Salou, Institut Curie, Paris
Les cellules T invariantes associées aux muqueuses (MAIT, pour Mucosal Associated Invariant T cells) sont des lymphocytes T présents dans les muqueuses (peau, poumons, intestin) ainsi que dans la rate et le foie. Le TCR (récepteur des cellules T) des MAIT a la particularité d’être semi-invariant (une chaîne TCRα invariant associée à un nombre limité de chaines TCRβ), reconnaissant des petits antigènes bactériens, correspondant à des métabolites de la voie de synthèse de la riboflavine. Ces cellules immunitaires possèdent un phénotype mémoire leur permettant d'intégrer les signaux du TCR et des cytokines, et d’y répondre en conséquence. L'acquisition de ce phénotype se fait lors de la maturation dans le thymus, où elles subissent une sélection via les cellules thymiques épithéliales.
En plus de leurs propriétés antibactériennes, les MAIT expriment un programme transcriptomique de réparation tissulaire et favorisent la cicatrisation des plaies cutanées. L’étude présentée par Marion Salou avait pour but de mettre en évidence un éventuel rôle des MAIT dans le processus de cicatrisation et de réparation tissulaire. Pour ce faire, un modèle murin exprimant davantage de MAIT que les souris sauvages a été utilisé afin de se rapprocher des conditions humaines. Les résultats montrent qu'après une blessure, le nombre de MAIT au niveau de la zone lésée est multiplié par dix. En revanche, chez les souris déficientes en MAIT, le temps de réparation tissulaire est prolongé, soulignant le rôle potentiel des MAIT dans la cicatrisation. Cette accumulation de MAIT au niveau de la blessure n'est pas due à leur prolifération, car le marqueur de prolifération Ki67 n'est pas augmenté, suggérant une augmentation du recrutement des MAIT. Les données transcriptomiques indiquent une implication probable des récepteurs CXCR6 et, dans une moindre mesure, CCR2.
Pour vérifier l'implication de CXCR6, une délétion de CXCR6 a été réalisée dans une culture cellulaire enrichie en MAIT, confirmant que le recrutement des MAIT n'était plus effectif en absence de CXCR6. Les MAIT semblent promouvoir la réparation tissulaire en favorisant la prolifération des kératinocytes, comme en témoigne l'augmentation du Ki67 au sein des kératinocytes. Pour déterminer les mécanismes par lesquels les MAIT induisent cette prolifération, des MAIT ont été extraites du thymus et de la peau à l'état basal et après une blessure, afin de comparer l'expression génique par la méthode de Single Cell RNA Seq. Chez les MAIT retrouvées après une blessure, une augmentation du cluster des gènes de « réparation » a été observée par rapport aux MAIT à l'état basal. Parmi ce cluster, deux molécules sont particulièrement impliquées : l'amphiréguline et l'IL-8. L'implication de l'amphiréguline dans la cicatrisation a été démontrée chez des souris déficientes en amphiréguline, dont le temps de cicatrisation est significativement prolongé.
La littérature montre que le TCR peut également jouer un rôle dans le processus de réparation tissulaire médié par les MAIT. Toutefois, les MAIT adoptent le même comportement in vivo même lorsqu'elles sont dépourvues de leur TCR. Ceci suggère que l'expression de la fonction de réparation est probablement indépendante d'une stimulation continue du TCR. Il est aussi possible que l'activation du TCR puisse avoir un effet synergique avec l'activation de CXCR6. En effet, l'ajout de 5-OP-RU −un ligand bactérien du TCR− au niveau de la blessure, augmente la capacité de réparation.
En résumé, les MAIT sont recrutées depuis le sang et les ganglions lymphatiques via le récepteur CXCR6 au niveau du tissu lésé. Leur implication dans le processus de cicatrisation semble être médiée par l'amphiréguline.
Lilian Basso, Institut Infinity, Toulouse
Les nocicepteurs sont des neurones sensoriels dont le corps cellulaire se situe dans les ganglions spinaux le long de la moelle épinière. Leur axone se divise en deux branches, l'une vers la moelle épinière et l'autre vers la périphérie. Ces neurones sont peu ou pas du tout myélinisés, et sont de petite et moyenne taille. Ils sont bidirectionnels, conduisant les signaux nerveux de la périphérie vers le système nerveux central et participant à la réaction inflammatoire en sécrétant des neuropeptides en périphérie. Ils expriment des canaux sodiques spécifiques tels que NaV 1.8. Il existe plusieurs populations de nocicepteurs, répartis en trois groupes distincts : les neurones non peptidergiques, les neurones peptidergiques et les neurones exprimant des récepteurs mécaniques à bas seuil.
Le rôle des nocicepteurs est bien documenté dans le cadre de la dermatite atopique. Par exemple, la détection de micro-organismes comme Staphylococcus aureus ou les acariens conduit à l'activation des nocicepteurs via TRPV1, et à la libération de la substance P, responsable de la dégranulation des mastocytes via leurs récepteurs MRGPRB2. Cela entraîne le recrutement des leucocytes depuis la circulation sanguine et l'initiation de la réponse Th2.
En revanche, les mécanismes à l'origine de la dermatite allergique de contact (DAC) diffèrent. Cette pathologie implique une réponse inflammatoire de type Th1 et Th17 et évolue en deux phases. La première phase, dite de sensibilisation, commence avec la pénétration de l'haptène à travers la barrière épithéliale. L'haptène se lie ensuite à un antigène du soi, formant un néo-antigène reconnu par les cellules présentatrices d'antigènes, telles que les cellules de Langerhans. Ces cellules migrent alors vers les ganglions lymphatiques pour activer les lymphocytes, formant des lymphocytes mémoires résidents. Lors d'un rechallenge par l'haptène déjà rencontré, une réponse inflammatoire caractéristique de la DAC est induite.
Lilian Basso a présenté un modèle de souris déplétées en NaV 1.8, inactivant ainsi les nocicepteurs. Ce modèle permet de mettre en évidence un potentiel rôle des nocicepteurs dans la DAC. Chez ces souris déplétées en NaV 1.8, la réponse inflammatoire est exacerbée, bien que les souris se grattent moins : ceci suggère un découplage entre l'intensité de la réaction inflammatoire et le prurit. Cette réaction inflammatoire accrue est caractérisée par une forte infiltration de polynucléaires neutrophiles.
Dans les ganglions spinaux des souris, il est possible d'isoler ceux innervant spécifiquement la peau, grâce à un marqueur rétrotraçant, le DiI, injecté dans le derme des souris et remontant jusqu'aux ganglions. On obtient ainsi les données transcriptomiques spécifiques de ces neurones innervant la peau. En condition inflammatoire, une nouvelle population de neurones apparaît, maximale au quatrième jour de l'inflammation, avec une signature transcriptomique caractéristique. Cette population semble se former à partir de la dédifférenciation des neurones non peptidergiques préexistants. Les gènes surexprimés sont ceux associés à la régénération neuronale suite à une blessure nerveuse, tels que SOX11 et ATF3 (Activating Transcription Factor 3). ATF3 est un facteur de transcription jouant un rôle important dans la réponse cellulaire au stress et aux lésions. Lorsqu'il est exprimé par les neurones, ATF3 régule l'expression de gènes impliqués dans la croissance axonale et la réparation des tissus nerveux, ainsi que la réponse inflammatoire. Cette réponse est réversible, car 60 jours après le challenge induisant la DAC chez la souris, l'expression d'ATF3 disparaît. Chez des souris où le gène ATF3 a été inactivé, une baisse significative du prurit et de l'infiltration de polynucléaires neutrophiles est observée. Au contraire, chez les souris avec une déplétion des canaux TRPV1, une augmentation de la réaction inflammatoire est notée, décorrélée du comportement de grattage.
En résumé, plusieurs populations de neurones sont impliquées dans le mécanisme de la DAC, incluant les neurones peptidergiques TRPV1 ayant un rôle plutôt anti-inflammatoire et les neurones non peptidergiques produisant ATF3 impliqués dans le comportement de grattage.
Judith Fischer, Université de Freiburg, Allemagne
Les ichtyoses sont un groupe de maladies de la peau caractérisées par une sécheresse extrême et une desquamation anormale. La classification des ichtyoses se fait à plusieurs niveaux. On distingue :
Les ichtyoses peuvent également être classées par leur mode de transmission, certaines formes étant autosomiques dominantes ou récessives, et d'autres liées à l'X. Grâce au développement du séquençage haut débit, il est de plus en plus possible d'isoler des gènes spécifiques impliqués dans la survenue des ichtyoses.
Dans le cas des ARCI, incluant l'ichtyose lamellaire, les mutations identifiées concernent principalement des enzymes impliquées dans le métabolisme des lipides cutanés. Judith Fischer a décrit une nouvelle mutation identifiée, NKPD1, à l'origine d'une ichtyose lamellaire dominante. Les patient·e·s présentent généralement une ichtyose lamellaire légère avec de fines squames sur le tronc, les bras et la tête. Des squames de couleur plutôt grise sont présentes dans le cou. La desquamation augmente à des températures élevées, en conditions humides et lors de la transpiration.
Le gène NKPD1 code pour une protéine NTPase de la famille des KAP avec un domaine « P-loop ». Les P-loop NTPases sont des enzymes impliquées dans de nombreux mécanismes cellulaires, dont la traduction des ARNm, la transduction de signaux, la mobilité cellulaire et la croissance cellulaire. Les domaines P-loop sont caractérisés par deux domaines transmembranaires conservés parmi tous les membres de cette famille. La perte de l'un de ces deux domaines entraîne une perte de fonction de la protéine. Elle est fortement exprimée dans les cellules épithéliales et, dans une moindre mesure, dans les cellules nerveuses centrales et la thyroïde. À ce jour, il n'existe aucune donnée dans la littérature concernant son rôle dans la différenciation kératinocytaire, et ses potentielles interactions avec d'autres protéines ne sont pas connues. L'outil Gene Network Predictions indique qu'elle serait impliquée dans différentes voies, dont la formation de la couche cornée de l'épiderme et le métabolisme des sphingolipides.
Dans les biopsies de patients atteints de cette mutation, le stratum corneum est plus épais avec une acanthose marquée. En immunohistochimie, la protéine est légèrement plus exprimée dans les kératinocytes des couches basale et granuleuse, mais beaucoup moins exprimée dans les mélanocytes. L'analyse des céramides de la peau des patient·e·s atteint·e·s de cette mutation, réalisée par scotch test, ne montre pas de changement significatif par rapport aux individus sains (3 patients), mais il y a une augmentation des céramides liés aux protéines. Ces études sont pour l'instant préliminaires.
En conclusion, NKPD1 est un variant génotypique dont la prévalence est très faible. Toutefois, étant donné les atteintes cutanées très légères, il est probable que les patient·e·s ne consultent pas de médecin pour ce motif. Il existe actuellement plus de 100 formes d'ichtyoses connues. Une grande proportion des gènes impliqués dans la maladie font partie du métabolisme des lipides. Les mutations géniques à l'origine d'environ 10% des ichtyoses ne sont pas encore connues.
Léa Pechtimaldjian, Bordeaux
Les télocytes sont des cellules connues pour assurer un remodelage vasculaire en empêchant le développement anarchique des vaisseaux. Le but de l’étude présentée par Léa Pechtimaldjian était d’évaluer leur rôle dans les tumeurs bénignes infantiles, telles que les hémangiomes. Le travail a été conduit sur des tissus humains de 400 µm d'épaisseur, nécessitant leur transparisation pour les étudier en microscopie photonique. Un marquage vasculaire tridimensionnel a été réalisé afin d’obtenir une reconstruction d’images en 3D.
Il existe un phénomène de normalisation vasculaire en présence des télocytes au sein des hémangiomes. Dans les hémangiomes prolifératifs, les télocytes sont organisés en gaine autour des vaisseaux, contrairement aux hémangiomes involutifs où les télocytes forment un maillage plus lâche.
Une méthode de culture des cellules endothéliales utilise des billes de collagène incluses dans un hydrogel de fibrine. Ainsi, les cellules peuvent bourgeonner au sein du gel et reconstituer une vascularisation in vitro. En co-cultivant les cellules endothéliales et les télocytes, on montre un effet anti-angiogénique via la sécrétion de facteurs dans le milieu. Cet effet est spécifique aux télocytes des hémangiomes, car les télocytes normaux n’ont pas d’impact sur la vascularisation.
La suite consistera à caractériser les facteurs anti-angiogéniques afin de développer un outil de lutte contre la néoangiogenèse tumorale.
Julien Ablain, CRCL, Lyon
Actuellement, le traitement des mélanomes présente trois grands défis :
La surexpression de la voie des MAP kinases (MAPK) au sein des mélanocytes est le principal mécanisme à l’origine des mélanomes, notamment avec des gains de fonction des gènes BRAF, NRAS ou KIT. Parallèlement, l’inactivation de certains gènes suppresseurs de tumeurs agit de manière synergique dans le processus de carcinogenèse. Le gène CDKN2A est muté dans 40 à 60 % des cas de mélanome. Parmi l’ensemble des cancers, le mélanome présente le plus grand nombre de mutations par portion de génome. Il est donc complexe de mettre en évidence toutes les mutations drivers, d’où l'importance de développer des modèles génétiques afin d’étudier le rôle de ces différentes mutations. Julien Ablain a présenté un système de vecteurs permettant de modéliser la génétique du mélanome humain dans le poisson zèbre.
Ce système, appelé MAZERATI, repose sur la combinaison de deux vecteurs permettant la surexpression d’un oncogène et d’un autre gène au choix. Ces vecteurs sont intégrés dans l’embryon du poisson zèbre et s’insèrent de manière stable dans le génome des adultes. L’apparition de tumeurs chez le poisson adulte peut ainsi être observée. On peut générer des tumeurs spontanées avec un génotype similaire à celui des tumeurs humaines de mélanomes, par exemple en surexprimant BRAF V600E et en inactivant un gène suppresseur de tumeurs tel que PTEN ou P53. Avec ces outils, il est ainsi possible de mener des études de génétique humaine chez le poisson et d’investiguer les altérations géniques au sein des tumeurs.
Nous nous intéressons ici au gène SPRED1 (Sprouty Related EVH1 Domain Containing 1), connu pour être un régulateur négatif de la voie des MAPK. Une mutation de ce gène est à l’origine du syndrome de Legius, ressemblant à la neurofibromatose de type 1. SPRED1 inhibe la voie des MAPK, possiblement en interagissant directement avec NF1 et en favorisant l’inactivation de RAS. La mutation de SPRED1 est particulièrement retrouvée en présence d’une altération préalable de KIT. Grâce au modèle décrit précédemment, il est possible de former des tumeurs mélanocytaires avec mutation de KIT, suractivant la voie des MAPK et inactivant SPRED1. Il est montré que, dans ce contexte, la génération de mélanomes se fait plus rapidement qu’avec la seule mutation de KIT. Une pression de sélection semble s’exercer sur les cellules mutées pour SPRED1 lorsque KIT est déjà muté. La perte de SPRED1 induit une résistance aux thérapies ciblées, comme le Dasatinib, inhibiteur de KIT, ce qui souligne l’importance de connaître l’existence de cette mutation.
Une autre délétion fréquemment retrouvée dans les tumeurs mélaniques est la mutation du gène Nectine 1. Nectine 1 est une molécule d’adhérence à la surface des cellules formant des jonctions adhérentes précoces, avant même l’implication des cadhérines. Un niveau d’expression plus faible de Nectine 1 a été mis en évidence dans les métastases par rapport aux tumeurs primitives. En utilisant le modèle décrit plus haut, les tumeurs dans lesquelles Nectine 1 a été inactivée forment des métastases plus fréquemment. La perte de Nectine 1 semble donc favoriser la dissémination des cellules mélanocytaires. Cette hypothèse est vérifiée en injectant des cellules tumorales KO pour Nectine 1 chez des poissons sains, où les cellules tumorales se disséminent davantage que les cellules de mélanomes exprimant Nectine 1.
En culture cellulaire, la migration des cellules Nectine 1 KO est augmentée seulement en l'absence de sérum. En fait, en conditions normales, les mélanocytes ne forment pas de jonctions adhérentes, car ce ne sont pas des cellules épithéliales. En absence de sérum, les mélanocytes subissent un stress qui les conduit à former des jonctions adhérentes. Les cellules KO pour Nectine 1 sont incapables de former ces jonctions en absence de sérum, et adoptent une morphologie plus adaptée à la migration. Il apparaît que l’IGF1 et l’insuline (présents dans le sérum des cultures cellulaires) empêchent la formation des jonctions adhérentes. Ainsi, en présence d’IGF1, la présence ou non de Nectine 1 n’a aucun impact puisque les cellules n’ont pas nécessité de former de jonctions adhérentes. Par contre, en absence d’IGF1, la présence de Nectine 1 est nécessaire pour former les jonctions adhérentes, les cellules étant soumises à un stress. Lorsque les cellules sont KO pour Nectine 1, la perte des jonctions adhérentes conduit à la migration des cellules.
Vincent Flacher, Institut de Biologie Moléculaire et Cellulaire (IBMC) de Strasbourg
On sait désormais que les cellules immunitaires de la peau ne sont pas les seules responsables de la médiation de la réponse inflammatoire dans les maladies inflammatoires cutanées. Le microenvironnement joue un rôle crucial dans l'activation des cellules de Langerhans et la polarisation de la réponse T, avec une grande implication des neurones. Par exemple, dans la dermatite atopique, de nombreuses études ont montré un cercle vicieux neuroimmunitaire dans l’initiation du prurit. Dans le psoriasis, une dénervation accidentelle d’une plaque de psoriasis réduit l’inflammation, suggérant que les neurones médient cette inflammation. Un article récent (Deng et al., 2024) propose que le système immunitaire et le système nerveux agissent de concert dans la réponse allergique. Il est donc crucial de développer des modèles in vitro de peau reproduisant l’innervation cutanée.
Pour ce faire, une matrice de collagène associée à du chitosan est utilisée pour créer des pores suffisamment larges entre les fibres de collagène, constituant ainsi une niche pour les cellules cultivées. Les cellules primaires utilisées proviennent d’abdominoplasties, incluant des cellules endothéliales et des fibroblastes, qui sont initialement ensemencées dans la matrice. Ensuite, des neurones sensoriels issus de la racine dorsale de la moelle épinière d’embryons de souris sont ajoutés à la culture.
Ce modèle de culture cellulaire a été validé en utilisant des marqueurs de différenciation cellulaire tels que les kératines 10 et 14, montrant une organisation tridimensionnelle similaire à celle de l’épiderme humain. Ce modèle peut être enrichi par l’ensemencement d’autres cellules comme des cellules dendritiques (dérivées de monocytes) ou des cellules endothéliales. En associant ce modèle à une plateforme de microfluidique, il devient possible de reproduire la vascularisation et d’étudier la microcirculation.
Le modèle de peau ainsi innervé répond de manière adéquate : la stimulation des neurones avec de la capsaïcine entraîne une augmentation de la production de TNF, ce qui est attendu en conditions physiologiques. De même, en réponse à une stimulation par les cytokines IL-4 et IL-1, il y a une sécrétion de cytokines inflammatoires telles que l’IL-6.
L’utilisation de neurones humains est également envisageable. Dans ce cas, il est nécessaire d’ajouter des cellules de Schwann pour obtenir des dendrites jusqu'à l'épiderme. Dans ce modèle, les neurones sensoriels sont bien différenciés, avec une hétérogénéité parmi la population entre les neurones peptidergiques et non peptidergiques.
La mise au point de ce modèle de culture cellulaire complet et tridimensionnel permet de nombreuses applications. Par exemple, il a permis d’étudier la réponse immunitaire de la peau suite à une piqûre d’arthropodes vecteurs d’arboviroses. Ainsi, il est possible de récupérer le virus lorsqu’un moustique pique une peau artificielle et injecte sa salive vectrice du virus. En immunohistochimie, les zones d’infection dans la peau reconstituée montrent une signature interféron, permettant d’étudier l’ensemble de la physiopathologie de l’infection arbovirale dans la peau.
En somme, il est possible de générer des équivalents de peau humaine incluant des cellules immunitaires et des neurones sensoriels. Cela ouvre la voie à de nombreuses applications, comme l’étude de la physiopathologie de l’infection arbovirale dans la peau.
Morgan Dos Santos, Labskin Créations, Lyon
La peau a été le premier organe reconstruit in vitro, initialement par des cultures en deux dimensions de kératinocytes, puis par des épidermes reconstruits humains, et enfin par des modèles contenant à la fois un derme et un épiderme. Ces dernières années, on observe une complexification de ces modèles avec l'ajout de cellules spécialisées telles que les cellules endothéliales, pigmentaires et nerveuses. Plusieurs stratégies ont été développées pour se rapprocher au plus près des conditions in vivo.
La stratégie top-down repose sur l'utilisation d'un échafaudage en trois dimensions dans lequel les cellules sont ensemencées pour proliférer et créer leur propre matrice extracellulaire. La porosité de ce milieu crée un microenvironnement très favorable aux cellules. Au niveau dermique, cela permet d'obtenir une matrice riche en fibres d'élastine, difficile à obtenir avec les cultures classiques. Les dermes équivalents peuvent être enrichis en cellules endothéliales pour induire une endothélialisation, voire une vascularisation, en utilisant des modèles de microfluidique. Les cellules sont extraites de biopsies de peau en utilisant le marqueur CD31, spécifique des cellules endothéliales. Les cellules lymphatiques −une sous-population des cellules endothéliales− formant les vaisseaux lymphatiques, peuvent également être isolées grâce au marqueur spécifique de la podoplanine. Les capillaires se forment spontanément au niveau du derme papillaire, développant une lumière bien définie au sein de ces structures, qui établissent ensuite des connexions pour former un réseau. La complexité du modèle peut être augmentée par l'incorporation de cellules immunocompétentes, générées à partir d'une sous-population CD34+ issue du sang de cordon, incluses pendant la phase de prolifération des kératinocytes. De cette population dérive notamment les cellules de Langerhans au niveau épidermique.
Par la suite, la fonctionnalité des cellules incluses a été étudiée sous exposition aux UVA et UVB. Après une dose d'UV, les cellules deviennent mobiles et s'agglomèrent dans le derme profond.
Les annexes cutanées représentent une autre composante dermique importante. Il a été possible de reconstituer des glandes sébacées en utilisant des sébocytes générés à partir de cellules souches pluripotentes induites (iPS). Les glandes sont organisées en acini, se rapprochant de leur structure in vivo, et sont fonctionnelles. En microscopie confocale, l'organisation des glandes révèle une expression de la mucine, au centre, et de la cytokératine 7 en périphérie, conformément aux conditions physiologiques. Sous l'effet de l'acide arachidonique, la taille et la maturation des glandes varient proportionnellement à sa concentration.
L'autre stratégie, le bottom-up, utilise des éléments très petits pour reconstruire une structure en trois dimensions. Parmi ces approches, on trouve l'utilisation de feuillets dermiques et épidermiques ou encore la bio-impression 3D. La stratégie d'auto-assemblage permet la formation de feuillets sous l'effet de conditions de culture spécifiques, où les cellules synthétisent leur propre matrice extracellulaire. Cependant, les feuillets sont très fins et il faut les associer ensemble. Cela permet de créer un modèle de cicatrisation par exemple en créant une blessure et étudiant le processus de réépidermisation. La bio-impression 3D utilise une bio-encre déposée goutte à goutte par une machine, selon un modèle informatique préétabli, permettant d'obtenir des formes très précises, une complexité accrue des modèles, une reproductibilité et une rapidité supérieures aux méthodes classiques. La formulation de la bio-encre constitue l'étape la plus complexe, nécessitant des années pour développer une composition comprenant du fibrinogène, de l'alginate et de la gélatine, cette dernière servant temporairement d'échafaudage pendant l'impression. Les techniques d'impression 3D incluent :
Grâce à ces avancées techniques, il est désormais possible de créer des modèles à trois couches (hypoderme, derme et épiderme), et de varier la réticulation afin d’obtenir des propriétés mécaniques se rapprochant des tissus physiologiques. Ces modèles ouvrent la voie à de nombreuses applications, telles que les greffes pour les grands brûlés, ainsi que dans des recherches fondamentales ou toxicologiques.