1 professionals
Coup d’œil du congrès SKIN SUMMIT 2025
Coup d’œil du congrès SKIN SUMMIT 2025
Innovations in Photoprotection: Advancing Solutions for Pigmentation Disorders, Vitiligo and Beyond
Résumés rédigés par Harold Guimfack (Dermatologue, Master Science, Nice)
Sujets liés
Contexte : Le Pr Passeron a commencé par partager une statistique frappante : il y a seulement trois ans, 65% des patients en Europe se sont vu dire qu'il n'existait aucun traitement pour le vitiligo. C'est une information cruciale car le vitiligo affecte environ 0,5% à 2% de la population mondiale, et des traitements existent et d'autres sont à venir. Il est donc essentiel d'informer les patients qu'ils peuvent être pris en charge.
Avancées thérapeutiques
1. Généralités
• Le vitiligo est une dépigmentation acquise de la peau et des cheveux, caractérisée par une perte acquise de mélanocytes, les cellules qui produisent la mélanine, le pigment le plus important de la peau.
• Il existe différents types de vitiligo :
- Vitiligo non segmentaire : Le plus courant, avec des lésions symétriques.
- Vitiligo segmentaire : Représente environ 10% des cas.
- Vitiligo mixte : Environ 10% des patients atteints de vitiligo segmentaire développeront des lésions de vitiligo non segmentaire plus tard, créant une forme mixte. Un exemple a été donné d'une jeune fille ayant un vitiligo segmentaire qui a développé des lésions non segmentaires plusieurs années plus tard.
• L'apparition du vitiligo survient souvent durant l'enfance ou la petite enfance :
- 50% des cas débutent avant l'âge de 20 ans.
- 80% des cas débutent avant l'âge de 30 ans.
• Le vitiligo a un fort impact sur la qualité de vie des patients, entraînant une stigmatisation significative, d'où l'importance de les prendre en charge.
2. Pourquoi les approches combinées et de meilleurs modèles sont nécessaires ?
Pour guérir le vitiligo, il est essentiel de comprendre deux aspects fondamentaux :
1. Stopper la perte de mélanocytes, qui est clairement liée aux atteintes immunitaires.
2. Améliorer la différenciation, la prolifération et la survie des mélanocytes pour induire la repigmentation.
• La repigmentation est un processus qui prend du temps. Il faut généralement 6 à 24 mois pour obtenir une repigmentation optimale avec les traitements actuels, ce qui doit être expliqué aux patients. De plus, environ la moitié des patients connaîtront des rechutes après la repigmentation, rendant la prévention cruciale.
• La physiopathologie du vitiligo est complexe, impliquant une prédisposition génétique et des variations alléliques. Certaines de ces variations génétiques sont également associées à d'autres maladies auto-immunes. Fait intéressant, bien que certains gènes soient liés au mélanome, la variation allélique qui confère un risque de développer le vitiligo protège en fait contre le mélanome. Les personnes atteintes de vitiligo ont trois fois moins de risques de développer un mélanome que la population générale. Il est important de communiquer cette information aux patients, car beaucoup craignent le soleil.
3. Aspects cellulaires et moléculaires
• Dans la peau atteinte de vitiligo, non seulement les mélanocytes sont affectés, mais aussi les kératinocytes et les fibroblastes. Il y a une susceptibilité accrue au stress oxydatif, une production accrue de radicaux libres (ROS), et des altérations du sécrétome (sénescent) et des mitochondries.
• Des recherches ont montré qu'il y a un détachement des mélanocytes de la membrane basale. L'exposition à certaines cytokines comme l'interféron gamma (IFN-γ) et le TNF-alpha induit ce détachement par la perte d'E-cadhérine, processus médié par la production de métalloprotéinase 9 (MMP9).
• Le vitiligo est connu comme une maladie auto-immune adaptative. Cependant, des travaux en laboratoire ont démontré que la peau des patients vitiligo a une réponse accrue aux PAMPs (Pathogen-Associated Molecular Patterns) et aux DAMPs (Damage-Associated Molecular Patterns). Cela induit la production de chimiokines telles que CXCL9 et CXCL10. Ces chimiokines se lient au récepteur CXCR3B, qui est fortement exprimé à la surface des mélanocytes. L'exposition des mélanocytes à CXCL9 et CXCL10 via CXCR3B induit l'apoptose initiale des mélanocytes. Les mélanocytes restants expriment alors leurs propres antigènes, ce qui entraîne l'infiltration des lymphocytes T et l'attaque par le système immunitaire.
• Des résultats récents ont confirmé une expression accrue de CXCR3B dans les mélanocytes des lésions actives de vitiligo par rapport aux lésions non actives et aux contrôles. De plus, le stress oxydatif diminue l'expression de NRF2, ce qui augmente CXCR3B et induit davantage l'apoptose des mélanocytes lorsqu'ils sont exposés à CXCL10. Ces données suggèrent que CXCR3B pourrait être une cible très intéressante pour le traitement du vitiligo.
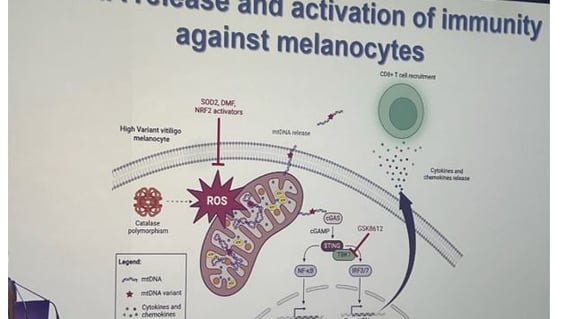
• Le stress oxydatif (ROS) peut entraîner la libération de mtDNA, qui active des voies de signalisation comme STING, IRF3/7, et NF-κB, conduisant à la production de cytokines pro-inflammatoires et au recrutement de lymphocytes T CD8 (figure 1).
Figure 1. Libération d'ADN mitochondrial (mtDNA) et activation de l'immunité contre les mélanocytes.
3. Vitiligo segmentaire : physiopathologie
• Peu de travaux ont été réalisés sur le vitiligo segmentaire (environ 10% de tous les cas de vitiligo). Des biopsies ont été effectuées dans des zones non dépigmentées, dans la partie controlatérale et chez des volontaires sains. Les résultats ont montré que même dans la peau non affectée par le vitiligo segmentaire, il y a une augmentation de l'IFN-γ, CXCL9, CXCL10, et MMP9, ainsi qu'une diminution de l'E-cadhérine.
• Ce qui était différent et exclusivement exprimé dans la partie lésionnelle était :
-Une augmentation de CXCL16, une alarmine principalement produite par les kératinocytes.
-Une augmentation de CXCR3B.
-Une libération d'ADN mitochondrial.
• Ceci explique pourquoi les personnes atteintes de vitiligo segmentaire ont dix fois plus de risques de développer un vitiligo non segmentaire que la population générale, et suggère des altérations en mosaïque dans la peau lésionnelle.
4. Dysbiose cutanée et intestinale
• Pour activer la réponse immunitaire innée, une stimulation par les PAMPs et DAMPs est nécessaire. Des études ont cherché à évaluer la présence de dysbiose intestinale et cutanée chez les patients atteints de vitiligo par rapport aux volontaires sains.
• Dans l'intestin des patients vitiligo, il a été démontré une augmentation du ratio des Firmicutes par rapport aux Bacteroidetes. Cette augmentation a également été rapportée dans d'autres maladies auto-immunes comme le diabète, la sclérose en plaques, le lupus et le psoriasis. Un groupe de Liverpool a utilisé un modèle murin et a montré que la diminution des Bacteroidetes favorise le vitiligo, suggérant que les Bacteroidetes sont protecteurs. Des collègues chinois ont trouvé exactement la même dysbiose intestinale chez les patients vitiligo.
• Concernant la peau, des biopsies ont révélé une forte diminution des bactéries Bifidobacterium dans la peau des patients vitiligo. De l'ADN mitochondrial a également été retrouvé dans la peau de certains de ces patients. Les patients présentant une augmentation de l'ADN mitochondrial et une dysbiose cutanée avaient une production significativement accrue d'IFN-γ, CXCL9, CXCL10, CXCL16. Bien que la relation de cause à effet ne soit pas encore établie, corriger la dysbiose cutanée et intestinale pourrait être une piste thérapeutique.
5. Mitochondries et nouveaux moyens de ciblages
• Des recherches ont confirmé une altération de la fonction mitochondriale dans le vitiligo. Le stress oxydatif entraîne une libération d'ADN mitochondrial, qui active le système immunitaire (NF-κB et interféron de type I), stimulant et recrutant davantage les lymphocytes T CD8 pour attaquer les mélanocytes (figure 1).
• L'utilisation d'antioxydants spécifiques ciblant les mitochondries ou de certains médicaments pharmaceutiques qui préviennent l'activation de la voie en aval peut empêcher l'activation des cytokines inflammatoires de type I et l'attaque des cellules CD8. Cela ouvre de nouvelles voies pour cibler et moduler l'activation du système immunitaire.
6. Facteurs génétiques, exposome et immunité
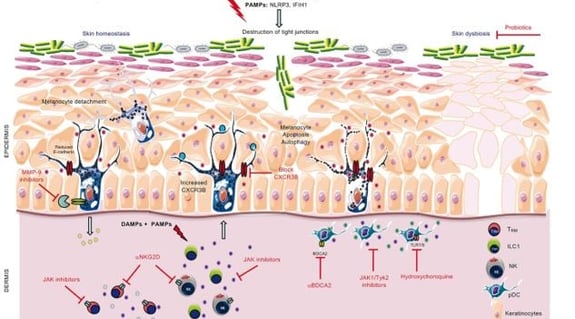
• Des facteurs génétiques prédisposent au vitiligo, mais ne sont pas suffisants. Des facteurs d'exposition (stress, bactéries, virus) induisent l'activation de la réponse immunitaire innée. La réponse innée active ensuite la réponse adaptative (figure 2).
• C'est cette voie immunitaire adaptative qui a conduit au développement de nouveaux traitements, notamment les inhibiteurs de JAK, les premiers traitements topiques approuvés par la FDA. Cependant, les modèles utilisés pour développer ces traitements ciblent uniquement l'activation des CD8 pour reconnaître les mélanocytes, mais la situation est plus complexe chez l'humain. Des modèles améliorés sont nécessaires pour découvrir d'autres cibles.
Figure 2. Schéma récapitulatif de la physiopathologie du vitiligo et des différentes cibles potentielles pour le traitement.
7. Repigmentation : défi et stratégies
• La guérison du vitiligo consiste non seulement à prévenir la dépigmentation (= l'attaque des mélanocytes par le système immunitaire), mais aussi à améliorer la différenciation des mélanocytes pour favoriser la repigmentation. Il a été démontré que la voie WNT est diminuée dans la peau atteinte de vitiligo, or cette voie est cruciale pour induire la différenciation des cellules souches mélanocytaires.
• La meilleure façon de stimuler la repigmentation est de cibler le follicule pileux, d'où les mélanocytes peuvent croître et migrer. Il existe également des cellules souches mélanocytaires dans la glande sébacée et dans l'épiderme (couche basale), qui sont des cibles potentielles pour les zones très difficiles à traiter.
Figure 3. Répartition des cellules souches mélanocytaires au sein de la peau
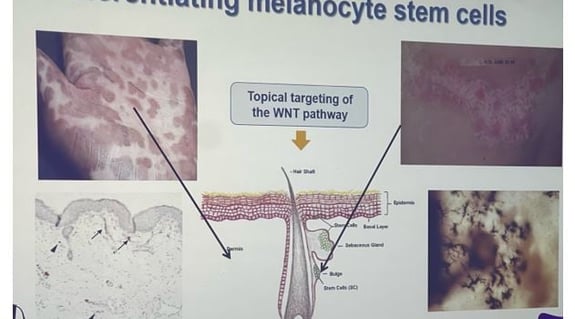
Figure 3. Répartition des cellules souches mélanocytaires au sein de la peau
Avancées thérapeutiques
Approches combinées historiques et actuelles
• Dès 1983, la combinaison de la greffe chirurgicale avec la photothérapie a montré de bien meilleurs résultats que la greffe seule. Des résultats similaires ont été obtenus en combinant le traitement chirurgical avec des approches médicales ou topiques.
• Il a démontré en 1999 que la combinaison de dermocorticoïdes avec les UVA donnait de meilleurs résultats que les UVA ou les dermocorticoïdes seuls. Les mêmes résultats ont été obtenus avec les UVB à bande étroite dix ans plus tard.
• Des études ont montré que la combinaison du laser excimer avec le tacrolimus topique (un immunomodulateur) augmentait la repigmentation de moins de 20% avec le laser seul à près de 70% pour une repigmentation de plus de 75%. Sur les zones difficiles comme les genoux ou les coudes, seules les approches combinées donnent de bons résultats.
• Les méta-analyses confirment l'intérêt de combiner les traitements topiques (inhibiteurs de la calcineurine ou stéroïdes puissants) avec la photothérapie (exposition au soleil ou UVB à bande étroite).
Traitement du vitiligo très actif
• Pour les patients qui se dépigmentent beaucoup/rapidement, la meilleure approche actuelle est de combiner les UVB à bande étroite avec des mini-doses de stéroïdes oraux deux fois par semaine.
• Les inhibiteurs de JAK oraux à venir seront très intéressants pour le vitiligo actif.
Zones difficiles à traiter/résistantes à la repigmentation (mains, pieds, saillies osseuses)
• Des traitements agressifs comme la dermabrasion complète assistée par laser combinée avec le UVB à bande étroite et les stéroïdes topiques ont donné des résultats impressionnants sur des zones comme les mains et le dos, mais présentent des effets secondaires importants (cicatrices hypertrophiques, cicatrisation retardée).
• Ces résultats suggèrent que des facteurs stimulant la pigmentation sont produits par la peau suite à l'abrasion, et qu'il faut trouver des moyens de reproduire cela sans des traitements aussi agressifs.
• Le laser fractionné, une approche moins agressive, donne de meilleurs résultats que le UVB seul, mais moins spectaculaires que la dermabrasion complète. Il indique néanmoins que des facteurs cutanés peuvent améliorer la différenciation, la prolifération et la survie des mélanocytes, même dans ces zones difficiles.
• Ces résultats ont été confirmés par une autre étude en Italie, utilisant le laser excimer dans le vitiligo localisé, qui a également doublé la repigmentation après 6 mois en combinant le UVB avec cet antioxydant.
Afamelanotide : stimulation de la proliferation des mélanocytes
• Les mélanocytes expriment le récepteur MC1R. Un composé appelé alpha-MSH (Afamelanotide, actuellement en phase 3) est capable de stimuler la croissance des mélanocytes.
Une étude de phase 2 a montré que, notamment chez les individus à peau foncée, la combinaison de l'Afamelanotide avec les UVB à bande étroite améliore significativement la repigmentation.
• Ce traitement sera probablement très utile pour les peaux foncées, mais pourrait poser un problème pour les peaux très claires car il provoque un bronzage marqué, rendant le vitiligo presque invisible avant le traitement, très visible après.
Antioxydants
• Le stress oxydatif est bien démontré dans le vitiligo, mais de nombreux antioxydants (vitamine C, sélnium) n'ont jamais été très efficaces.
• Une étude prospective, randomisée, en double aveugle et contrôlée par placebo a utilisé une superoxyde dismutase (SOD) très puissante (protégée de la digestion intestinale) chez des patients atteints de vitiligo étendu. Les résultats ont montré deux fois plus de repigmentation après 6 mois lorsque les UVB à bande étroite étaient combinés à cet antioxydant par rapport au UVB seul.
Ruxolitinib crème
• Significativement plus efficace que le placebo, surtout sur le visage. Le visage est de
loin la partie la plus facile à traiter. Les mains et les pieds restent très difficiles.
• Après un an de traitement (deux applications par jour) :
--> Plus de la moitié des patients atteignent au moins 75% de repigmentation (VASI75).
--> Environ 1/3 atteignent une repigmentation complète ou quasi complète (VASI90).
• Une étude de phase 2 avec la crème de Ruxolitinib seule a montré des résultats limités. La combinaison de la crème de Ruxolitinib avec les UVB à bande étroite a montré des résultats bien meilleurs. Pour les patients n'ayant pas suffisamment repigmenté (moins de 25% après 3 mois) avec la crème seule, l'ajout des UVB a conduit à :
--> Plus de la moitié des patients atteignant une repigmentation complète ou quasi complète après 6 mois.
--> Plus de 8 patients sur 10 obtenant au moins 75% de repigmentation après 6 mois.
Inhibiteurs de JAK oraux (Ritlecitinib, Baracitinib)
• Le ritlecitinib (inhibiteur JAK3/TEC) et le baricitinib (inhibiteur JAK1) sont en phase 3 pour le vitiligo étendu. Les résultats de phase 2 sont positifs, et ceux de phase 3 sont attendus fin de l'année. Ces traitements sont très utiles pour le vitiligo étendu, où l'application d'une crème deux fois par jour est impraticable.
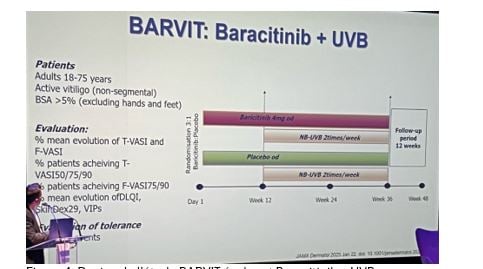
• L'essai BARVIT a étudié la combinaison du baricitinib avec les UVB à bande étroite chez des patients très actifs (figure 4).
--> Sur le visage, le baricitinib combiné au UVB a montré une amélioration de 65% après 36 semaines, tandis que le groupe placebo continuait à se dépigmenter. La moitié des patients ont presque entièrement repigmenté leur visage.
--> Sur le corps, l'amélioration était de près de 45% avec la combinaison contre moins de 10% avec le UVB seul. 1/4 des patients a atteint 75% de repigmentation sur le corps.
--> Malgré ces progrès, les mains et les pieds restent des zones très résistantes.
Figure 4. Design de l'étude BARVIT évaluant Baracitinib + UVB
Etude PREVENT (Greffe de mélanocytes + Ruxolitinib)
• Cette étude intra-individuelle, prospective, randomisée, contrôlée par placebo, a été menée sur 20 patients atteints de vitiligo non segmentaire, ciblant des zones très difficiles à traiter (genoux, coudes, poignets, dos de la main).
Tous les patients ont bénéficié d'une greffe en suspension. La moitié a reçu de la crème de ruxolitinib et l'autre moitié un placebo pendant 12 semaines, après quoi les deux côtés ont reçu la crème de ruxolitinib. L'objectif principal était d'atteindre au moins 50% de repigmentation dans la lésion après 3 mois.
• Après 3 mois, un seul patient a atteint 50% de repigmentation dans le groupe ruxolitinib, et aucun dans le groupe placebo. Après 6 mois, moins de 17% avec l'approche combinée, et aucun dans le groupe véhicule. Les différences n'étaient pas statistiquement significatives.
• Conclusion de l’étude : Apporter des mélanocytes et les protéger n'est pas suffisant pour repigmenter ces zones très difficiles. Le problème ne réside pas seulement dans la différenciation des mélanocytes (puisque des mélanocytes ont été apportés), mais aussi dans leur prolifération et leur survie dans ces zones. Il est donc crucial d'identifier les facteurs locaux qui empêchent cette prolifération et cette survie pour "percer le code" de la repigmentation dans ces zones.
CONCLUSION
Rôle clé de la réponse immunitaire, en particulier l'activation des CD8, mais aussi les
CD4, les cellules T régulatrices (Tregs), les cellules T mémoire (TMs) et les cellules innées.
• Cependant, le système immunitaire n'est pas le seul facteur. Il faut également :
1) Lutter contre les facteurs d'exposition (exposome) lorsque c'est possible.
2) Réparer les cellules épidermiques et dermiques défectueuses.
3) Stimuler la différenciation, la prolifération et la survie des mélanocytes.
• Seules des approches combinées permettent une repigmentation optimale
Figure 4. Design de l'étude BARVIT évaluant Baracitinib + UVB
Contexte : Pr John Harris présente ses travaux de recherche translationnelle sur le vitiligo, maladie auto-immune fréquente (> 1 % de la population) dont la moitié des cas débutent avant 20 ans. Cette précocité impose un suivi thérapeutique au long cours et offre aux chercheurs la possibilité d’observer les cycles de rémission et de rechute sur plusieurs décennies. Le vitiligo partage par ailleurs des voies physiopathologiques avec d’autres maladies auto-immunes ; l’étudier peut donc ouvrir la voie à des traitements pour ces pathologies plus difficiles à explorer. Son laboratoire articule trois volets complémentaires : modèles murins (science fondamentale), analyses de tissus humains (recherche translationnelle) et essais cliniques (recherche clinique) afin de développer de nouvelles thérapies ciblées.
1. Rôle de l'interféron gamma et les inhibiteurs de JAK
• La première découverte majeure fut la présence d'une forte "signature" d'interféron gamma (IFN-γ) dans la peau de souris atteintes de vitiligo. Nous avons observé la même voie dans la peau humaine : interféron gamma, CXCL9, et CXCL10. L'interféron gamma signale via JAK1 et JAK2 pour activer ces chimiokines.
• Nous avons émis l'hypothèse que les inhibiteurs de JAK seraient un traitement efficace en interrompant la signalisation de l'interféron gamma. Nous avons testé cette approche avec le ruxolitinib oral chez un patient atteint de vitiligo. En seulement cinq mois, le patient a repigmenté son visage presque complètement, ce qui est un résultat très impressionnant. D'autres inhibiteurs de JAK ont montré des résultats similaires, justifiant les essais cliniques de phase 2 et 3 pour le ruxolitinib topique, désormais approuvé par la FDA (depuis environ trois ans) et commercialisé sous le nom d'Opzelura. Des inhibiteurs de JAK oraux comme le ritlecitinib, le povorcitinib, l'upadacitinib et le baricitinib sont également en phase de test et progressent vers la phase 3, promettant des options de traitement oral dans un futur proche.
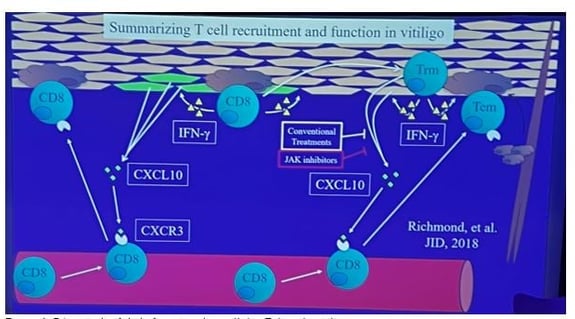
• Récapitulatif de la fonction des cellules T dans le vitiligo (figure 1) : Les cellules T CD8 entrent dans la peau et ciblent les mélanocytes. Elles produisent de l'interféron gamma (IFN-γ). L'IFN-γ active les chimiokines CXCL10 et CXCL9 via CXCR3, qui recrutent davantage de cellules T dans la peau, entraînant la destruction des mélanocytes et la progression de la maladie.
Une sous-population de ces cellules T devient des cellules T mémoire résidentes (Trm), qui restent dans l'épiderme indéfiniment. Lorsque ces Trm interagissent avec les mélanocytes, elles recrutent davantage de cellules T, ce qui entretient la maladie.
Les traitements conventionnels (inhibiteurs de JAK) désactivent ces cellules, améliorant le vitiligo. Cependant, les cellules Trm restent présentes, et si le traitement est interrompu, elles se réactivent, provoquant une rechute.
2. Mémoire cutanée et rôle de l'IL15 : pourquoi le vitiligo rechute-t-il ?
• Lorsque le traitement est arrêté, la maladie revient souvent au même endroit, ce qui suggère une mémoire cutanée. Nous voulions identifier la source de cette mémoire pour développer des traitements qui éviteraient la rechute.
• Nous avions découvert dans le modèle murin, puis confirmé dans la peau humaine, que les cellules T deviennent des cellules T mémoire résidentes (Trm) dans la peau. Ces cellules restent dans la peau de manière permanente.
• Nous avons également trouvé qu'elles nécessitent l'interleukine 15 (IL-15) pour leur signalisation. Nous avons émis l'hypothèse que cibler l'IL-15 pourrait éliminer ces Trm et permettre des réponses durables. Cela s'est avéré vrai dans notre modèle murin, ce qui a justifié le développement de médicaments ciblant l'IL-15 ou son récepteur.
Une molécule ciblant la chaîne bêta du récepteur de l'IL-15 (développée par Atylos, acquise par Incyte) est actuellement en phase 1 d'études chez des volontaires sains, avec des plans pour la phase 2. Ce serait un traitement systémique qui pourrait éliminer la rechute de la maladie.
3. Activités et communications cellulaires
Pr Harris et son équipe cherchent à comprendre comment les cellules T entrent dans la peau, prolifèrent, comment différents clones entraînent la maladie et comment ces cellules communiquent pour coordonner l'attaque des mélanocytes, pensant que cela mènera à de meilleurs traitements pour le vitiligo.
Méthodologie pour l'étude des lymphocytes T
• Collecte d'échantillons : Le travail a consisté à collecter des échantillons de peau auprès de 28 patients. Cela a été réalisé en créant des ampoules par aspiration dans la peau, permettant l'extraction de fluide et de cellules des lésions.
• Techniques d'analyse : Les cellules collectées ont été analysées à l'aide de la cytométrie en flux, du séquençage d'ARN unicellulaire et du séquençage du TCR. La coloration au Dextramer a été utilisée pour marquer les cellules qui ciblent les mélanocytes.
• Identification des cellules T : Une cellule T possède un récepteur de cellule T (TCR) qui reconnaît sa cible. Lors de cette reconnaissance, elle s'active et prolifère, créant davantage de cellules T avec le même TCR, qui sont alors suivies comme un "clone".
• Découverte d'antigènes : Les clones colorés dans l'analyse indiquent des antigènes cibles connus (par exemple, Mark1, PMEL, GP100). Il existe probablement d'autres clones de cellules T attaquant les mélanocytes dont les antigènes spécifiques n'ont pas encore été identifiés, ce qui fait partie d'un programme de découverte d'antigènes.
Comportement des clones T (single cell). Deux comportements généraux (figure 2) :
• Clones hautement cytotoxiques (en rouge) : Ces clones sont caractérisés par leur expression de granzymes (par exemple, granzyme K, granzyme B, granzyme H). Ils sont beaucoup plus abondants dans la peau lésionnelle par rapport à la peau non lésionnelle, ce qui est logique puisque ce sont les cellules activement impliquées dans la destruction des mélanocytes.
• Clones faiblement cytotoxiques (en bleu) : Ces clones montrent une activité cytotoxique moindre.
Figure 1. Récapitulatif de la fonction des cellules T dans le vitiligo
2. Mémoire cutanée et rôle de l'IL15 : pourquoi le vitiligo rechute-t-il ?
• Lorsque le traitement est arrêté, la maladie revient souvent au même endroit, ce qui suggère une mémoire cutanée. Nous voulions identifier la source de cette mémoire pour développer des traitements qui éviteraient la rechute.
• Nous avions découvert dans le modèle murin, puis confirmé dans la peau humaine, que les cellules T deviennent des cellules T mémoire résidentes (Trm) dans la peau. Ces cellules restent dans la peau de manière permanente.
• Nous avons également trouvé qu'elles nécessitent l'interleukine 15 (IL-15) pour leur signalisation. Nous avons émis l'hypothèse que cibler l'IL-15 pourrait éliminer ces Trm et permettre des réponses durables. Cela s'est avéré vrai dans notre modèle murin, ce qui a justifié le développement de médicaments ciblant l'IL-15 ou son récepteur.
Une molécule ciblant la chaîne bêta du récepteur de l'IL-15 (développée par Atylos, acquise par Incyte) est actuellement en phase 1 d'études chez des volontaires sains, avec des plans pour la phase 2. Ce serait un traitement systémique qui pourrait éliminer la rechute de la maladie.
3. Activités et communications cellulaires
Pr Harris et son équipe cherchent à comprendre comment les cellules T entrent dans la peau, prolifèrent, comment différents clones entraînent la maladie et comment ces cellules communiquent pour coordonner l'attaque des mélanocytes, pensant que cela mènera à de meilleurs traitements pour le vitiligo.
Méthodologie pour l'étude des lymphocytes T
• Collecte d'échantillons : Le travail a consisté à collecter des échantillons de peau auprès de 28 patients. Cela a été réalisé en créant des ampoules par aspiration dans la peau, permettant l'extraction de fluide et de cellules des lésions.
• Techniques d'analyse : Les cellules collectées ont été analysées à l'aide de la cytométrie en flux, du séquençage d'ARN unicellulaire et du séquençage du TCR. La coloration au Dextramer a été utilisée pour marquer les cellules qui ciblent les mélanocytes.
• Identification des cellules T : Une cellule T possède un récepteur de cellule T (TCR) qui reconnaît sa cible. Lors de cette reconnaissance, elle s'active et prolifère, créant davantage de cellules T avec le même TCR, qui sont alors suivies comme un "clone".
• Découverte d'antigènes : Les clones colorés dans l'analyse indiquent des antigènes cibles connus (par exemple, Mark1, PMEL, GP100). Il existe probablement d'autres clones de cellules T attaquant les mélanocytes dont les antigènes spécifiques n'ont pas encore été identifiés, ce qui fait partie d'un programme de découverte d'antigènes.
Comportement des clones T (single cell). Deux comportements généraux (figure 2) :
• Clones hautement cytotoxiques (en rouge) : Ces clones sont caractérisés par leur expression de granzymes (par exemple, granzyme K, granzyme B, granzyme H). Ils sont beaucoup plus abondants dans la peau lésionnelle par rapport à la peau non lésionnelle, ce qui est logique puisque ce sont les cellules activement impliquées dans la destruction des mélanocytes.
• Clones faiblement cytotoxiques (en bleu) : Ces clones montrent une activité cytotoxique moindre.
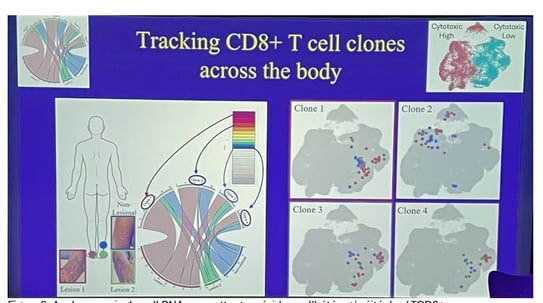
Dans une autre étude, les clones de cellules T ont été suivis sur trois sites différents du corps d'un même patient atteint de vitiligo : une lésion de vitiligo sur le pied droit, une autre lésion de vitiligo sur le pied gauche, et une zone de peau d'apparence normale. Quatre clones différents de cellules T ont été identifiés sur les trois sites :
• Clone 1 : C'était le clone le plus prévalent chez ce patient. Il a été trouvé dans les trois localisations et a constamment montré un comportement faiblement cytotoxique, quelle que soit sa localisation.
• Clone 2 : Ce clone a montré un comportement distinct. Toutes les cellules T du Clone 2, quelle que soit leur localisation (lésion 1, lésion 2 ou peau non lésionnelle), se trouvaient dans la population hautement cytotoxique. Cette découverte était quelque peu surprenante, car elle impliquait que ces cellules étaient "agressives" et tentaient de tuer les mélanocytes même dans la peau apparemment saine et non lésionnelle.
• Clone 3 et Clone 4 : Ces deux clones ont été constamment trouvés dans la population faiblement cytotoxique.
Implications pour le traitement : cibler spécifiquement à désactiver le clone 2 (probablement à l'origine de la réponse immunitaire car il présentait constamment une cytotoxicité élevée) pourrait potentiellement désactiver l'ensemble de la maladie.
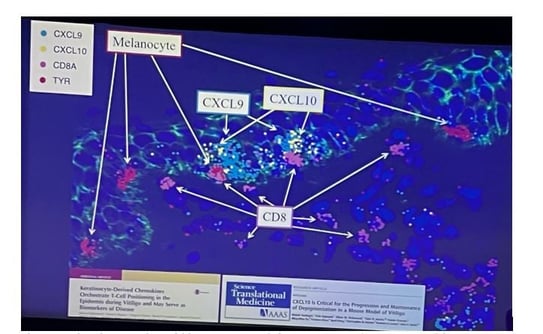
Organisation spatiale des cellules au sein des lésions de vitiligo
• La transcriptomique spatiale a permis de visualiser où les cellules T opèrent et ce qui se passe lorsqu'elles rencontrent un mélanocyte (figure 3).
• Dans ces lésions précoces, les cellules T CD8 entrent dans l'épiderme et attaquent les mélanocytes. Les kératinocytes adjacents activent STAT1, indiquant la production d'interféron gamma.
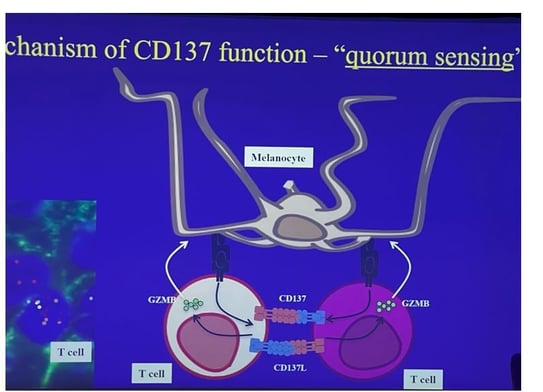
Découverte d'une nouvelle cible : CD137
• Lors de l'observation des cellules T CD8 attaquant les mélanocytes, nous avons remarqué un "point jaune" (TNF RSF9/4-1BB/CD137) exprimé uniquement par les cellules T qui engagent les mélanocytes. L'expression de CD137 est activée uniquement dans la peau lésionnelle, pas dans le sang ou la peau saine. La protéine CD137 est également fortement exprimée dans le liquide des cloques de vitiligo.
• Bloquer CD137 dans le modèle murin a prévenu le vitiligo de manière très significative. Cet effet était spécifique à la peau et n'affectait pas les cellules T dans les ganglions lymphatiques ; les cellules T quittaient la peau.
• Hypothèse du quorum sensing (figure 4) : un mélanocyte présentant son antigène est engagé par une cellule T, qui active alors le récepteur et le ligand CD137. Une seule cellule T ne peut pas tuer sa cible seule car elle ne peut pas se signaler elle-même. Deux cellules T doivent être présentes : l'une exprime le ligand CD137, l'autre le récepteur et le ligand. Elles se signalent mutuellement, ce qui permet la production de granzyme B et la destruction complète de la cellule cible.
Bloquer ce signal protège la cible et arrête la progression du vitiligo, ce qui en fait une cible prometteuse.
4. Prédiction des drivers de l'auto-immunité et les scores de risque polygénique
Pr Harris et son équipe ont mené une étude multiomique à distance, financée par le NIH, pour identifier les facteurs prédictifs du vitiligo avant l’apparition des lésions. Mille participants ont été recrutés : 300 patients atteints et 700 parents à haut risque. Les kits envoyés à domicile ont permis de collecter salive, sang et échantillons cutanés (bandelettes et micro-aiguilles développées au MIT).
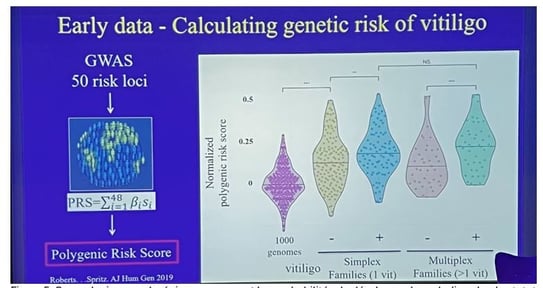
• Les scores de risque polygénique (PRS), basés sur la présence de gènes favorisant le vitiligo, montrent que les patients atteints de vitiligo et leurs membres de famille ont des scores plus élevés que les populations de contrôle (1000 génomes du NIH) (figure 5) :
- Les patients issus de familles "simplex" (un seul cas de vitiligo) ont des scores élevés.
- Leurs membres de famille ont des scores un peu plus bas, mais toujours supérieurs aux contrôles.
- Les familles "multiplex" (plus d'une personne atteinte) ont des scores encore plus élevés, suggérant un risque accru.
5. Développement de nouvelles modalités de traitement
Pr Harris et son équipe cherchent de nouvelles méthodes pour cibler les voies de signalisation connues, en cherchant à "atteindre le bon endroit au bon moment". Ils ont notamment développé un petit ARN interférent (siRNA) capable de bloquer l’expression de JAK1, protéine clé de la voie IFN-γ. Grâce à des modifications chimiques mises au point ces vingt dernières années, ce siRNA est désormais stable in vivo : une à deux administrations par an suffisent déjà pour plusieurs médicaments approuvés par la FDA.
Thérapie par ARN interférent (siRNA) pour l'inhibition de JAK1
• Fonctionnement : le siRNA entre dans la cellule, s’associe au complexe RISC, puis détruit l’ARNm de JAK1, empêchant la synthèse de la protéine.
Dans des cultures cellulaires, il réduit efficacement l’ARNm et la protéine JAK1. Injecté dans la patte de souris modèles de vitiligo, il abaisse CXCL9/CXCL10, limite l’infiltration de cellules T et protège la peau. Sur peau humaine ex vivo, il diffuse à travers épiderme et derme, neutralisant la signalisation IFN-γ.
• Application pour l'alopécie areata: Les inhibiteurs de JAK sont efficaces pour l'alopécie areata, mais les crèmes topiques ne pénètrent pas assez profondément. ALYS Pharmaceuticals (une entreprise que nous avons fondée) a développé ce siRNA. Les premiers patients ont été traités avec le siRNA JAK1 par injection intradermique dans le cuir chevelu, montrant une réduction significative de JAK1.
• Délivrance transépidermique pour le vitiligo via les STAR particules. Ces particules sont intégrées dans un gel et, lorsqu'elles sont frottées sur la peau, elles perforent le stratum corneum, permettant aux médicaments hydrosolubles de pénétrer efficacement.
L'application de siRNA avec les STAR particles sur la peau humaine (ex vivo) et sur la peau de porc vivante a permis de réduire efficacement JAK1 dans l'épiderme et le derme.
Une seule application a réduit la chimiokine CXCL9 pendant trois semaines. C'est une amélioration considérable par rapport aux topiques appliqués deux fois par jour (environ 12 applications par an contre 700).
Anticorps bispécifiques pour bloquer l'interféron gamma localement
• Inspirés par les travaux de John Stanley sur des anticorps non pathogènes dirigés contre la desmogléine 3 (une protéine d’adhérence des kératinocytes), Pr Harris et son équipe ont conçu un anticorps bispécifique combinant : Un bras neutralisant l’interféron γ (pour bloquer la voie inflammatoire clé du vitiligo) + Un bras anti-desmogléine 3 non pathogène (qui fixe l’anticorps aux kératinocytes et le retient localement).
• Chez la souris, l'injection de l'anticorps bispécifique dans une patte a protégé cette patte du vitiligo, tandis que l'autre patte n'était pas protégée. Un anticorps non lié (sans la partie anti-desmogléine 3) se répandait dans tout le système, supprimant l'immunité de manière systémique. Cela démontre la capacité de suppression immunitaire locale de l'anticorps bispécifique.
Conjugaison anticorps-médicament activée par la lumière IR (Photo-immunothérapie):
• L'idée est de fusionner un anticorps ciblant les cellules T avec une substance chimique qui, lorsqu'elle est activée par la lumière infrarouge (IR), provoque la mort de la cellule.
• Des études in vitro ont montré que le NIRA PAC peut tuer les cellules T humaines de manière dose-dépendante avec la lumière IR. Des biopsies de peau humaine ont montré une déplétion sélective des cellules T sans affecter les autres cellules cutanées comme les mélanocytes.
• Cette approche est également envisagée pour le lymphome cutané à cellules T (CTCL). Des biopsies de patients CTCL ont montré une déplétion de 90% des cellules T de lymphome cutané après traitement avec le NIRA PAC et lumière. Dans un modèle murin, cette approche a réduit la croissance des cellules tumorales de manière significative.
CONCLUSION
Contexte : Pr Picardo et son groupe de recherche à savoir si la peau des patients atteints de vitiligo présente des altérations héritées. Ils cherchent également à identifier les facteurs non-immunologiques dans le vitiligo.
1. Pathogénèse du vitiligo
• Des études fondamentales, translationnelles et cliniques indiquent que les mécanismes immunomédiés et le stress des mélanocytes contribuent probablement de manière synergique à la maladie, avec des influences génétiques sous-jacentes (beaucoup plus importante que dans la DA, par exemple) et un rôle probable de l'exposome.
• Les études sur les mélanocytes ont révélés plusieurs anomalies :
- Difficultés à cultiver les cellules
- Niveaux élevés de stress cellulaire
- Présence d'espèces réactives de l'oxygène (ROS)
- Activation de la réponse des protéines dépliées (unfolded protein response)
• La capacité à cultiver des mélanocytes de patients s'est améliorée avec l'ajout de catalase dans le milieu de culture, ce qui indique dès le départ que le stress oxydatif est lié aux mélanocytes des patients atteints de vitiligo.
De plus, l'administration systémique de superoxyde dismutase (SOD) a amélioré la réponse à la photothérapie, suggérant qu'il existe un stress oxydatif systémique dans le vitiligo qui ne provient pas nécessairement de la peau.
• L'interféron gamma (IFNγ) est considéré comme le médiateur majeur des dommages aux mélanocytes dans le vitiligo (figure 1a). Pourtant, son action ne paraît pas purement cytotoxique : dans d’autres dermatoses inflammatoires comme le psoriasis, où l’IFN-γ est aussi présent, on n’observe pas de dépigmentation durable mais plutôt une hyperpigmentation transitoire liée au TNF-α. Cela suggère qu’un facteur supplémentaire, propre au vitiligo (figure 1b), conditionne la vulnérabilité des mélanocytes à l’IFNγ soit via d’autres médiateurs inflammatoires, soit par des modifications durables « héritées » au sein même des cellules.
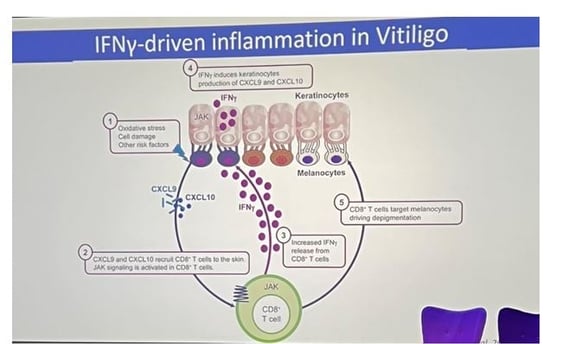
Figure 1a. Place de l'IFNγ dans la physiopathologie du vitiligo
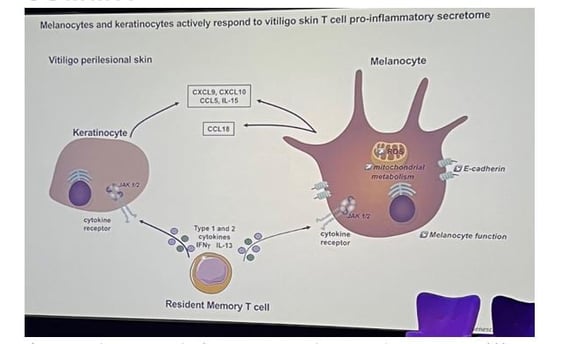
Figure 1b. Réponse des kératinocytes et des mélanocytes à l'IFNγ dans le vitiligo
2. Etude du métabolisme des mélanocytes
L'approche du Pr Picardo se concentre sur le métabolisme car la régénération cellulaire ne peut se produire sans un métabolisme approprié.
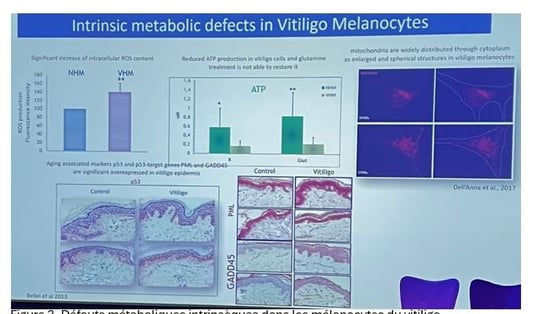
• Des études antérieures ont montré une augmentation significative de la génération de ROS et une diminution significative de la production d'ATP dans les mélanocytes de patients atteints de vitiligo (figure 3). La capacité énergétique et la capacité à proliférer sont significativement diminuées en raison du faible niveau d'ATP.
• L'expression de p53 est significativement augmentée dans la peau des patients atteints de vitiligo, ce qui est associé à des marqueurs de vieillissement tels que PML et GADD45 (figure 3), suggérant un phénomène de vieillissement. Des altérations ont également été observées dans les glandes sébacées, avec une qualité de sébum se rapprochant de celle des personnes âgées.
Figure 3. Défauts métaboliques intrinsèques dans les mélanocytes du vitiligo
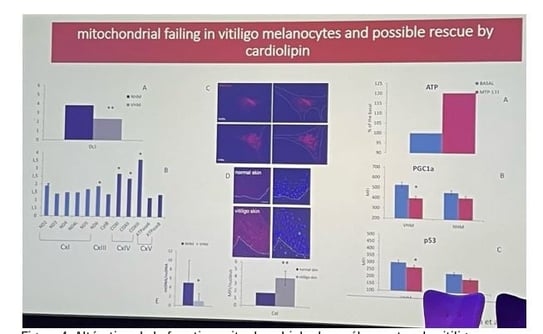
• Des altérations morphologiques des mitochondries ont été observées dans les mélanocytes, les rendant plus grandes et présentant des altérations de la chaîne respiratoire mitochondriale. Plusieurs expériences ont confirmé ces défauts mitochondriaux (figure 4) notamment la diminution du rapport mtDNA/ncDNA (indiquant une diminution du nombre de copies mitochondriales) et des altérations dans l'expression des complexes de la chaîne respiratoire.
• Les mitochondries sont identifiées comme une source fondamentale de ROS en raison de l'expression différentielle des complexes de la chaîne respiratoire. L'altération de la génération d'ATP et de PGC1α est associée à la surexpression de p53 (figure 4). La protection de la composition lipidique des mitochondries, notamment de la cardiolipine, pourrait améliorer leur métabolisme et réduire la génération de ROS.
Figure 4. Altération de la fonction mitochondriale des mélanocytes du vitiligo
2. Implication des fibroblastes et des kératinocytes ?
Le professeur a cherché à savoir si ces altérations métaboliques étaient spécifiques aux mélanocytes ou si d'autres cellules de la peau étaient également impliquées.
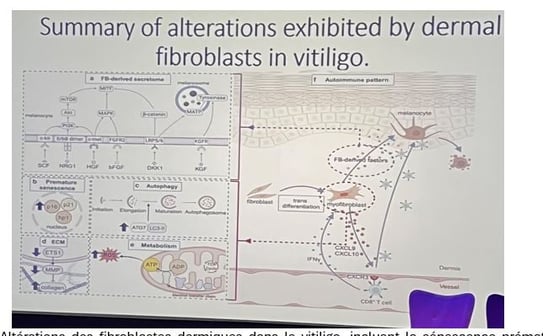
• Les fibroblastes de patients atteints de vitiligo présentent une apparence morphologique différente, exprimant plus d'alpha-SMA (un marqueur de myofibroblastes). Ils ont également une altération dans la production de facteurs de croissance pouvant interférer avec la communication normale entre mélanocytes et fibroblastes, ainsi qu'une génération de ROS et une altération de la production d'ATP (figure 5).
Figure 5. Altérations des fibroblastes dermiques dans le vitiligo, incluant la sénescence prématurée, l'autophagie et des problèmes métaboliques.
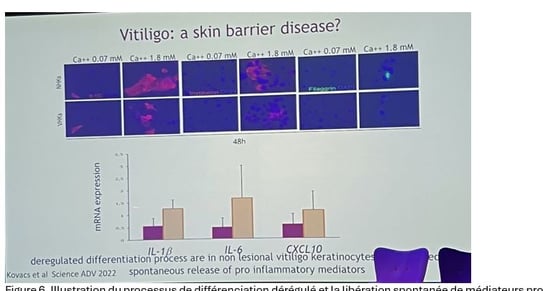
• Les kératinocytes de patients atteints de vitiligo présentent des anomalies dans le processus de différenciation, avec un retard dans l'apparition des protéines de différenciation. Ils libèrent spontanément des médiateurs pro-inflammatoires tels que l'IL-1β, l'IL-6 et le CXCL10, même en réponse au stress de la culture (figure 6).
• Chez les patients atteints de vitiligo, les kératinocytes présentent une réactivité accrue, comme s’ils étaient « prêts » à répondre à toute agression extérieure. Lorsqu’ils subissent un stress léger, tel qu’une simple éraflure, ces kératinocytes libèrent des quantités nettement supérieures de cytokines pro-inflammatoires par rapport aux cellules normales, et ils transmettent ensuite ce signal inflammatoire aux cellules cutanées voisines ainsi qu’aux cellules immunitaires adjacentes.
Figure 6. Illustration du processus de différenciation dérégulé et la libération spontanée de médiateurs pro-inflammatoires dans les kératinocytes non lésionnels du vitiligo
3. Vitiligo et syndrome métabolique
• Pr Picardo et son groupe soulignent le rôle pathogène des voies métaboliques perturbées (glucose, lipides, acides aminés) dans les maladies cutanées inflammatoires chroniques, y compris le vitiligo. Ils ont démontré que la plupart des patients atteints de vitiligo présentent une altération de la situation métabolique, en particulier du métabolisme du glucose.
• Des analyses récentes sur environ 100 patients ont montré que plus de 80% présentaient une altération du métabolisme du glucose, et certains (10%) présentaient une dyslipidémie. L'âge moyen de ces patients était d'environ 41 ans, ce qui est considéré comme très jeune pour de telles altérations métaboliques.
• Une étude sur environ 500 patients a révélé des niveaux plus bas de cholestérol total, une augmentation du cholestérol LDL, et une augmentation significative de la glycémie à jeun et des niveaux d'insuline.
• Une surexpression du récepteur GLUT1 (transporteur de glucose) a été observée dans la peau pigmentée des patients atteints de vitiligo, suggérant une modification plus importante du métabolisme du glucose.
Métabolisme du glucose dans les cellules immunitaires et signalisation IGF1/Insuline
• Le métabolisme du glucose est essentiel à l’activation immunitaire : le basculement vers la glycolyse soutient la prolifération des lymphocytes T et favorise la différenciation des TH17 pro-inflammatoires, tandis que l’inhibition de cette voie freine les TH17 au profit des Treg. À l’inverse, les lymphocytes T au repos ou mémoires dépendent surtout de l’oxydation des lipides.
• IGF-1 stimule nettement la prolifération des fibroblastes, kératinocytes et mélanocytes, qu’ils soient sains ou issus de patients vitiligo. L’insuline, en revanche, n’induit qu’une légère prolifération des fibroblastes et demeure sans effet sur les mélanocytes vitiligo, suggérant une résistance à cette hormone. Pr Picardo précise que l'hyperinsulinémie est considérée comme un médiateur inflammatoire.
• L'équipe a mis en évidence une signalisation intracellulaire IGF-1/insuline altérée dans les cellules de vitiligo, avec une activation plus élevée de la phosphorylation de mTOR et de la protéine ribosomale S6 dans les kératinocytes et fibroblastes de vitiligo (figure 7). Les cellules de vitiligo ont maintenu une tendance à rester dans un état hyperphosphorylé chronique même avec la stimulation par insuline/IGF-1, ce qui indique une activation constitutive des cellules et une résistance à l'insuline.
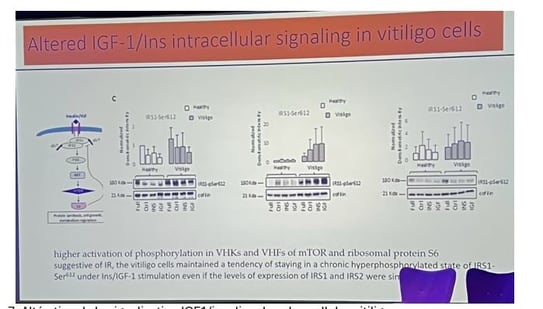
4. Production de ROS par les kératinocytes et rôle de l'ADNmt
• Les kératinocytes issus de peaux vitiligo présentent une production soutenue d’espèces réactives de l’oxygène (ROS). Contrairement aux kératinocytes sains, dont la génération de ROS dépend du glucose, ces cellules maintiennent des niveaux élevés indépendamment de la glycémie, ce qui suggère que la résistance à l’insuline résulte plutôt d’un métabolisme mitochondrial prolongé.
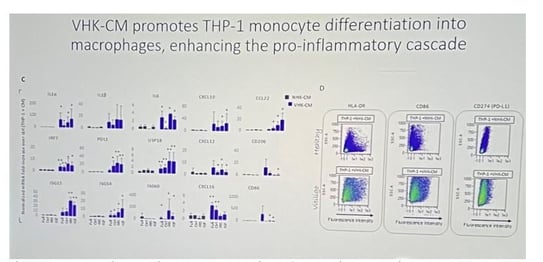
• En parallèle, les kératinocytes vitiligo sécrètent des médiateurs capables de remodeler l’activité des cellules cutanées et immunitaires voisines : leur profil déjà pro-inflammatoire est encore amplifié après stimulation par l’IGF-1 ou l’insuline. Le milieu conditionné (VHK-CM) dérivé de leur culture déclenche la différenciation des monocytes THP-1 en macrophages et accroît l’expression de nombreux gènes inflammatoires, intensifiant ainsi la cascade immunitaire (figure 8). Enfin, le stress intracellulaire caractéristique des kératinocytes et mélanocytes vitiligo facilite la libération de ces signaux activateurs vers le micro-environnement cutané.
Figure 8. Augmentation des niveaux d'ARNm de divers gènes pro-inflammatoires dans les monocytes THP-1 traités avec VHK-CM (milieu dérivé des kératinocytes)
• Un ADN mitochondrial (ADNmt) défectueux ou mal localisé agit comme signal d’alarme pour l’immunité innée. Les mitochondries lésées libèrent leur ADNmt dans les endosomes, où il déclenche le récepteur TLR9 puis la voie NF-κB, induisant une production d’IFN et une réponse inflammatoire. Ce mécanisme semble initier la libération de fragments de mélanocytes, activer les cellules immunitaires, favoriser la présentation d’antigènes aux lymphocytes et amorcer de nouvelles réponses immunitaires.
5. Approche thérapeutique avec la Pioglitazone
L'amélioration de la situation métabolique pourrait rendre les mélanocytes et les kératinocytes plus résistants au stress et moins susceptibles de libérer des facteurs activateurs de l'immunité. Pr Picardo a expérimenté la pioglitazone, un ancien médicament antidiabétique, connu pour améliorer le métabolisme du glucose.
• La pioglitazone optimise le métabolisme glucidique des mélanocytes atteints de vitiligo : elle réduit l’absorption de glucose et l’expression des transporteurs GLUT1, GLUT3 et GLUT4, tout en réorientant la production d’énergie vers la respiration mitochondriale plutôt que vers la glycolyse anaérobie.
• La pioglitazone améliore l'état bioénergétique global des mélanocytes de vitiligo. Cela se traduit par une augmentation du nombre de copies d'ADNmt et de PGC1α, une augmentation de la production d'ATP, et une diminution des niveaux de ROS. La pioglitazone restaure également le potentiel de membrane mitochondrial et augmente le taux de prolifération des mélanocytes.
• En améliorant le métabolisme du glucose, la pioglitazone diminue la capacité des cellules à produire des médiateurs inflammatoires et augmente leur capacité à produire de l'ATP, menant à un état énergétique plus équilibré. Ces résultats ont été observés à la fois sur les mélanocytes et les kératinocytes.
Effets de la pioglitazone sur les kératinocytes et la peau non lésionnelle
• Différenciation épidermique renforcée : La pioglitazone, via l’activation de PPAR γ, stimule l’expression d’enzymes de synthèse des céramides ainsi que l’involucrine, la filaggrine et la transglutaminase 1 (TGM1). Elle restaure ainsi la barrière lipidique (céramides) et atténue l’hyper-réactivité antigénique typique des kératinocytes vitiligo.
• Modulation de l'inflammation : diminution du chimiokine CXCL10, contribuant à réduire le signal pro-inflammatoire.
Effets de la pioglitazone sur les mélanocytes
• Rééquilibrage énergétique : Augmentation des ARN messagers et protéines de plusieurs enzymes glycolytiques sans accroître la consommation globale de glucose. Baisse des gènes impliqués dans la β-oxydation lipidique et le cycle de Krebs. Restauration du potentiel membranaire mitochondrial, du réseau métabolique et du nombre de copies d’ADNmt. Hausse du contenu en ATP et nette réduction de la production de ROS.
• Prolifération et survie améliorées : Accélération du taux de division
• Atténuation des signaux de danger : Diminution de HMGB1, Hsp70 (DAMPs), PD-L1 et UCP2. Réduction des marqueurs de sénescence (IGBP3, IGBP7, p16) et de l’IL-6. Baisse des molécules de stress de classe I (MICA/MICB) et des ligands NKG2D.
En résumé, la pioglitazone normalise la fonction kératinocytaire (barrière et inflammation) et réoriente le métabolisme des mélanocytes vers une respiration mitochondriale efficace, tout en diminuant le stress oxydatif et les signaux pro-inflammatoires.
CONCLUSION
• Le nombreuses données incitent à associer le vitiligo aux maladies métaboliques.
• L'activité mitochondriale altérée a un impact fort sur la capacité énergétique des cellules de vitiligo, entraînant une production réduite d'ATP. Ces perturbations peuvent créer un milieu biologique précaire qui perturbe la signalisation de l'insuline.
• Les kératinocytes semblent être particulièrement sensibles à la glucotoxicité, comme en témoigne l'augmentation marquée des ROS, des produits de glycation avancée (AGEs) et des molécules pro-inflammatoires en présence de stimulation par insuline/IGF-1. De manière importante, les kératinocytes orchestrent un processus majeur impliqué dans les maladies cutanées inflammatoires et auto-immunes.
À l'avenir, l'espoir est de produire des données cliniques pertinentes montrant que l'amélioration du métabolisme peut améliorer la réponse au traitement et la qualité de vie des patients. La possibilité de traiter certains patients avec des médicaments antidiabétiques en fonction de leur glycémie sanguine est envisagée. L'association d'inhibiteurs topiques et de thérapies systémiques avec des médicaments agissant sur le métabolisme pourrait également être une approche prometteuse, offrant une nouvelle perspective pour les maladies auto-immunes.
Orateur : Pr. Fisher
Contexte : La présentation couvrira plusieurs "courtes histoires"/domaines de recherche :
•Le grisonnement des cheveux et le mécanisme sous-jacent.
•Un modèle de souris humanisé développé, potentiellement utile pour l'étude de la repigmentation dans le vitiligo.
•Une nouvelle compréhension de la signalisation de l'AMP cyclique et de son rôle dans la régulation de la voie pigmentaire.
•Le phénotype des cheveux roux, la phéomélanine et les naevi.
•De nouvelles perspectives issues du monde clinique concernant les risques.
•Les conditions de dyspigmentation, potentiellement liées à l'agrégation de protéines de type amyloïde avec la mélanine, qui seraient des composants très courants des affections d'hyperpigmentation.
Vie de pigmentation induite par les UV : processus complexe et fortement régulé
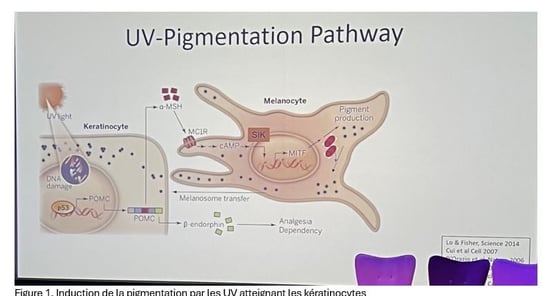
• L'exposition aux UV déclenche une cascade de réactions cutanées complexes. Tout commence par des dommages à l'ADN des kératinocytes, activant la protéine p53. Celle-ci stimule la voie POMC, entraînant la libération d’α-MSH et de β-endorphine (figure 1).
• L'α-MSH agit ensuite sur le récepteur MC1R des mélanocytes, activant la voie de l'AMP cyclique et MITF, principal régulateur de la pigmentation. Finalement, les mélanosomes pigmentés migrent vers les kératinocytes, offrant une protection contre les UV (via une coiffe périnucléaire).
Figure 1. Induction de la pigmentation par les UV atteignant les kératinocytes
• Dépendance au soleil : L'exposition aux UV produit aussi la β-endorphine, qui pourrait induire une dépendance au soleil. Cette dépendance pourrait expliquer la persistance d'une haute incidence de cancers cutanés.
• Cheveux roux : Le phénotype des cheveux roux est lié à des variants non fonctionnels du récepteur MC1R, bloquant la réponse protectrice au soleil. Cela accroît le risque de dommages UV et de mélanomes, mais cela peut avoir été salvateur à certains moments de l'évolution humaine.
Grisonnement des cheveux induit par le stress
• L'hypothèse selon laquelle le stress induit le grisonnement des cheveux est une idée présente depuis des siècles. Des travaux récents confortent cette idée en montrant que le grisonnement lié à l’âge traduit surtout la disparition progressive des cellules souches de mélanocytes (MSCs) nichées dans la « bulge » du follicule pileux.
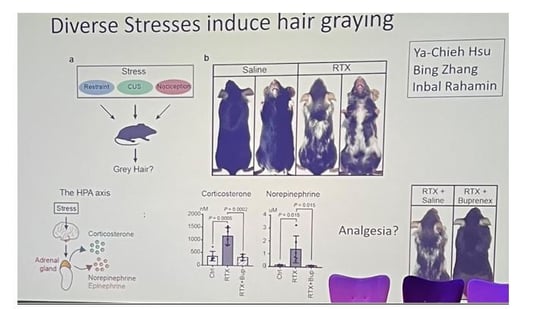
• Dans un modèle murin, divers stress – contrainte physique, stress chronique imprévisible ou nociception intense – provoquent une poussée durable de poils blancs au cycle pilaire suivant. Une seule injection de résinifératoxine (RTX), un algogène puissant, suffit : trois semaines plus tard, les nouveaux poils sont dépigmentés. Ces animaux présentent dans le sang une élévation des corticostéroïdes et de la noradrénaline, signatures du double déclenchement : axe cortico-surrénalien et système nerveux sympathique. Fait révélateur, administrer un antalgique (buprénorphine) qui bloque la perception de la douleur empêche la décoloration : c’est donc bien la sensation de stress, et non RTX en lui-même, qui lance le processus.
• Le chaînon clé est la voie adrénergique β2 : la suppression génétique du récepteur β2 sur les MSCs annule le blanchiment, alors que l’inactivation du récepteur aux glucocorticoïdes reste sans effet. L’afflux de noradrénaline force ces cellules normalement quiescentes à se différencier prématurément ; devenues pigmentées, elles entrent ensuite en apoptose. Chaque épisode de stress érode ainsi le stock de MSCs et, quand il est épuisé, les cheveux poussent définitivement blancs.
• Sur le plan thérapeutique, ces données laissent entrevoir l’intérêt de bêta-bloquants doux – appliqués localement (shampoing) ou administrés par voie générale sous une forme bien tolérée – pour freiner l’activation sympathique et préserver la réserve de cellules souches pigmentaires.
Figure 2. Le stress induit les grisonnements des poils des souris
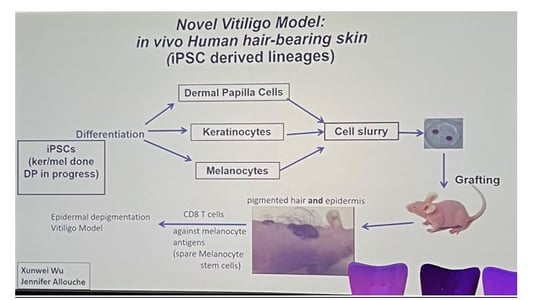
• Un nouveau modèle de souris humanisé, basé sur des greffes issues de cellules souches pluripotentes induites (iPSC), permet d'étudier la repigmentation du vitiligo. Des cellules T CD8 spécifiques détruisent les mélanocytes épidermiques mais épargnent les cellules souches du follicule pileux.
• Ces greffes produisent de la peau et des poils humains pigmentés. L'objectif est de contrôler la migration et la différenciation des mélanocytes depuis le follicule pileux pour optimiser la repigmentation. Une différenciation trop précoce pourrait empêcher une migration efficace.
• Ce modèle permet d'étudier la migration et la différenciation des mélanocytes pour favoriser la repigmentation efficace, avec des implications thérapeutiques majeures pour le vitiligo.
Figure 3. Génération de greffes de peau humaine porteuses de poils in vivo à partir de lignées dérivées de cellules souches pluripotentes induites (iPSC).
Nouvelle compréhension de la voie cAMP dans la pigmentation
• On considérait longtemps la cascade « UV → α-MSH → MC1R → AMPc → PKA → CREB → MITF » comme le schéma complet de la mélanogenèse. Cette vue s’avère trop simpliste : entre PKA et CREB intervient un relais essentiel, la famille des kinases SIK 1/2/3. En situation normale, SIK phosphoryle la protéine CRTC et la retient dans le cytoplasme (figure 4). Lorsque PKA inhibe SIK, CRTC gagne le noyau, se fixe à CREB et décuple l’activation de MITF – véritable interrupteur de la production de mélanine.
• Chez la souris dépourvue de MC1R (pelage roux), une crème à la forskoline (qui élève l’AMPc) fonce le poil, mais pénètre mal la peau humaine. Or un simple inhibiteur topique de SIK déclenche la même pigmentation, sans nécessité d’activer PKA : la transcription de MITF s’élève malgré l’absence de phosphorylation de CREB. Bloquer PKA n’annule donc pas l’effet d’un inhibiteur de SIK, confirmant que la branche SIK-CRTC-CREB suffit à elle seule pour stimuler MITF.
• Parce que SIK agit comme pivot de la signalisation AMPc dans de nombreux tissus (mélanocytes, monocytes, hépatocytes…), ses inhibiteurs représentent une cible médicamenteuse prometteuse. Leurs faibles capacités de pénétration systémique limitent les risques d’effets secondaires, ouvrant la voie à des formulations topiques. Reste à optimiser leur diffusion dans la peau humaine afin d’exploiter ce mécanisme pour moduler la pigmentation ou traiter d’autres pathologies cutanées.
Rôle carcinogène de la phéomélanine (figure 5)
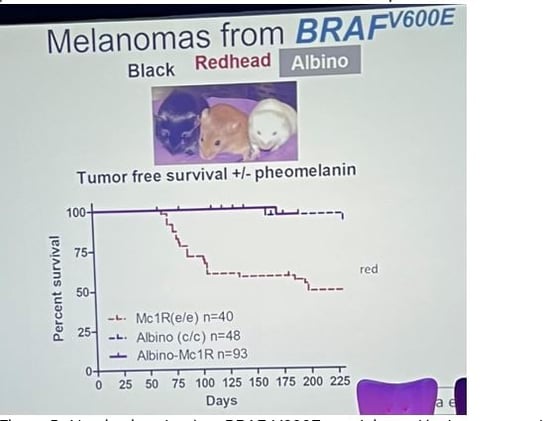
• Des travaux sur la souris montrent que la phéomélanine – le pigment roux produit lorsqu’il manque l’activité MC1R – favorise le mélanome : lorsqu’on active la mutation oncogénique BRAF V600E, les souris noires, riches en eumélanine, développent seulement de petits nævi stables, alors que jusqu’à la moitié des souris rousses évoluent vers un mélanome invasif (figure 5).
• Si l’on rend ces souris rousses albinos en supprimant la tyrosinase (donc toute synthèse de mélanine), le risque tumoral disparaît, prouvant que la phéomélanine ou sa voie de biosynthèse est intrinsèquement cancérogène, indépendamment des UV.
• Chez l’être humain, le génotype « roux » (variants MC1R non fonctionnel) confère lui aussi un risque accru de mélanome sans qu’il soit nécessaire d’invoquer les dommages solaires, probablement via une production accrue de ROS et les mutations de l’ADN qui en résultent.
Figure 5. L'activation du gène BRAF V600E conduit au développement de mélanomes invasifs chez jusqu'à 50% des souris rousses mais pas chez les souris noires.
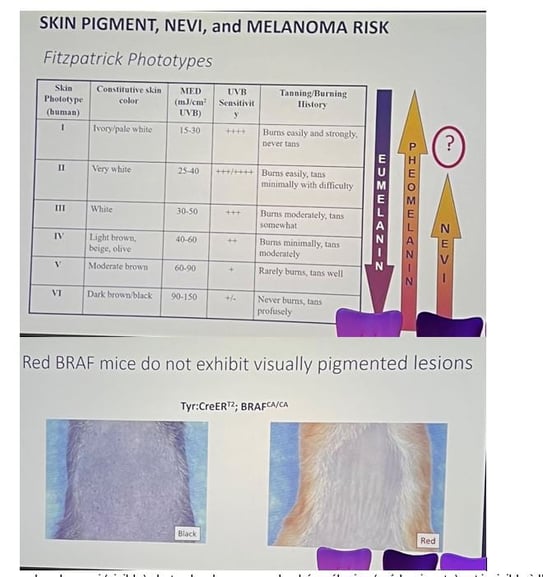
Naevi invisibles
• Chez les sujets à peau claire, le nombre de nævi visibles augmente à mesure que la carnation s’éclaircit ; pourtant, chez les personnes rousses, cette comptabilisation chute brutalement, alors même que leur risque de mélanome demeure élevé. L’explication avancée est que les roux possèdent beaucoup de nævi, mais qu’ils restent « invisibles » : la phéomélanine qu’ils contiennent n’est perceptible à l’œil nu que lorsqu’elle est très concentrée.
• Cette idée a été confirmée dans le modèle murin BRAF V600E : les souris noires développaient des lésions pigmentées bien détectables, tandis que les souris rousses paraissaient indemnes. En introduisant un gène rapporteur GFP, les chercheurs ont révélé sous le microscope un grand nombre de nævi clonaux jusque-là indétectés — environ dix fois plus que chez les souris noires — corrélés à un risque tumoral accru. Un éclairage UV in vivo et, surtout, un inhibiteur de SIK capable de convertir la phéomélanine en eumélanine (pigment noir) ont rendu ces lésions immédiatement visibles.
• Des nævi discrets, découverts fortuitement lors d’excisions chez des patients à peau claire, montrent que ce phénomène ne se limite pas aux sujets roux : il est lié à l’équilibre eumélanine/phéomélanine propre aux phototypes clairs. Ainsi, de nombreux nævi peuvent passer inaperçus tout en pesant sur le risque de mélanome, d’où l’importance de méthodes de détection adaptées.
Figure 6. Le nombre de naevi (visible) chute chez les roux car la phéomélanine (prédominante) est invisible à l'œil nu
• Différences d'expression génique : L'analyse de l'ARN unicellulaire (single cell RNA-seq) des mélanocytes de souris rousses et noires montre que bien que la plupart des séquences d'expression génique soient partagées, il existe une petite branche qui les discrimine, ce qui pourrait corréler avec les risques élevés et faibles de mélanome.
UVA et mélanome (figure 7ab)
• Les UVA amplifient de manière significative le mélanome chez les souris rousses. Une dose raisonnable d'UVA a entraîné une pénétrance de 100 % du mélanome chez les souris rousses.
Cependant, chez les souris albinos rousses (sans phéomélanine), la même dose d'UVA n'a pas augmenté l'incidence du mélanome, ce qui confirme que la phéomélanine est essentielle à la carcinogenèse induite par les UVA. Ce mécanisme est lié à la génération d'espèces réactives de l'oxygène (ROS).
• Implications pour la prévention : La protection contre les UVA dans les écrans solaires aux États-Unis est jugée insuffisante comparée à l'Europe. Une protection ciblant la phéomélanine est nécessaire, car elle possède une activité cancérigène mesurable même en l'absence d'UV.
Figure 7a. Les UVA amplifient significativement le mélanome chez les souris rousses.
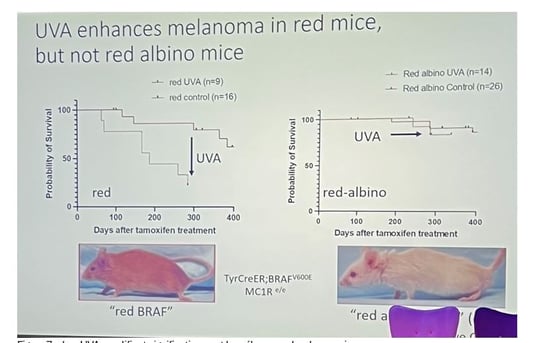
Figure 7b. Ce mécanisme est lié à la génération d'espèces réactives de l'oxygène (ROS) ; l'application topique de peroxyde a eu un effet similaire.

Maladie de Parkinson, L-DOPA, phéomélanine et mélanome (figure 8)
• Depuis longtemps, on observe une association entre la maladie de Parkinson (MP) et le mélanome sans en comprendre les raisons. L’hypothèse actuelle incrimine la L-Dopa, molécule clé du traitement antiparkinsonien : elle est non seulement précurseur de la dopamine, mais aussi intermédiaire essentiel de la phéomélanogenèse. Chez les peaux claires, l’augmentation de phéomélanine pourrait donc accroître la cancérogenèse mélanocytaire.
• Un exemple frappant l’illustre : chez un homme roux de 70 ans récemment traité par L-Dopa, on a constaté une véritable « explosion » de nouveaux mélanomes. Des expériences menées sur des souris rousses porteuses de la mutation BRAF V600E confirment ce lien : la L-Dopa double le nombre de tumeurs, tandis qu’elle reste sans effet chez des souris albinos dépourvues de phéomélanine.
• Sur le plan mécanistique, la phéomélanine — même sans rayonnement UV — génère des dimères de cyclobutane pyrimidine (CPD), marqueurs de lésions géniques. L’administration de L-Dopa augmente significativement ces CPD dans les noyaux cellulaires, soulignant un dommage oxydatif direct.
Figure 8. L'administration de L-Dopa à des souris rousses (modèle BRAF V600E) a doublé le nombre de mélanomes. Cependant, chez les souris albinos rousses (sans phéomélanine), la L-Dopa n'a eu aucun effet sur l'incidence du mélanome.
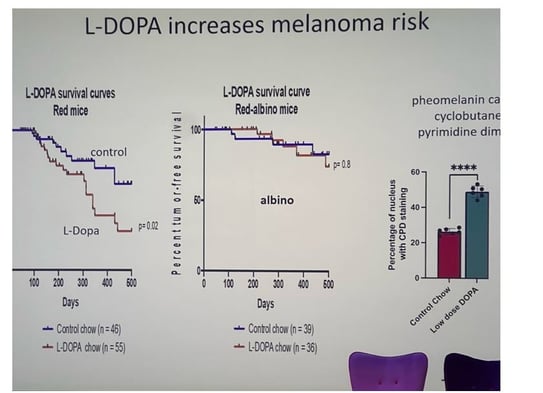
• Enfin, une vaste cohorte suédoise a validé ce lien : l’incidence du mélanome s’élève de façon dose-dépendante avec la L-Dopa, indépendamment du diagnostic de Parkinson. Ces données plaident pour une vigilance dermatologique accrue chez les patients clairs de peau sous L-Dopa et illustrent la dimension carcinogène de la phéomélanine.
Hyperpigmentation chronique : une nouvelle piste « amyloïde »
• On soupçonne désormais que la mélanine se dépose sur un échafaudage protéique de type amyloïde à l’intérieur des mélanosomes. Parmi ces protéines fibrillaires figurent Pmel et surtout l’α-synucléine, mieux connue dans la maladie de Parkinson. Si ces agrégats pigmentés s’accumulent dans l’épiderme ou le derme, ils sont souvent récupérés par des macrophages – un phénomène observé dans le lentigo solaire et le mélasma.
• Chez des souris transgéniques exprimant l’α-synucléine cutanée, une simple exposition aux UVA ou au peroxyde provoque une hyperpigmentation diffuse rappelant le lentigo. Ce résultat montre qu’un stress oxydatif peut activer la voie amyloïde et intensifier le dépôt de mélanine.
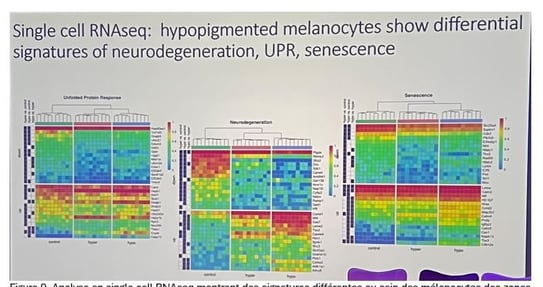
• L'autophagie semble jouer un rôle majeur. Chez des souris déficientes en autophagie, les lésions d'hyperpigmentation ne se produisent pas, mais la pigmentation devient hypopigmentée, suggérant que les mélanocytes sont "empoisonnés" lorsque l'agrégation se produit et que l'autophagie est déficiente. Il y a un équilibre entre la formation d'agrégats et la capacité des mélanocytes à les dégrader.
• Des analyses protéomiques et RNA-seq ont révélé des signaux de neurodégénérescence dans les mélanocytes hypopigmentés. Cela suggère une "neurodégénérescence de la peau" associée aux conditions d'hyperpigmentation liées à l'âge.
Conclusion
Le professeur Fisher conclut en soulignant le caractère provocateur de ces données et leur potentiel pour le développement de nouvelles thérapies, en particulier dans le contexte d'un besoin clinique non satisfait pour de nombreuses affections cutanées.
Orateur : Pr. Mauro Picardo
Contexte : L'accent est mis sur l'interconnexion complexe entre diverses cellules cutanées (mélanocytes, fibroblastes, kératinocytes, sébocytes) et leur rôle dans le développement de ces affections dermatologiques. Pr Picardo présentera également quelques données sur le rôle de l'acide azélaïque et de la metformine dans la modulation des réponses cellulaires et inflammatoires.
Peroxisome Proliferator-Activated Receptors (PPARs) : Signalisation et Fonctions
• Ces récepteurs fonctionnent comme des facteurs de transcription avec des activités de récepteurs nucléaires. Selon le type de ligand, qu'il soit physiologique ou pro-inflammatoire, les PPARs sont capables de se transférer au noyau. En fonction de l'interaction entre l'activateur et le PPAR, différents groupes de gènes peuvent être activés (figure 1).
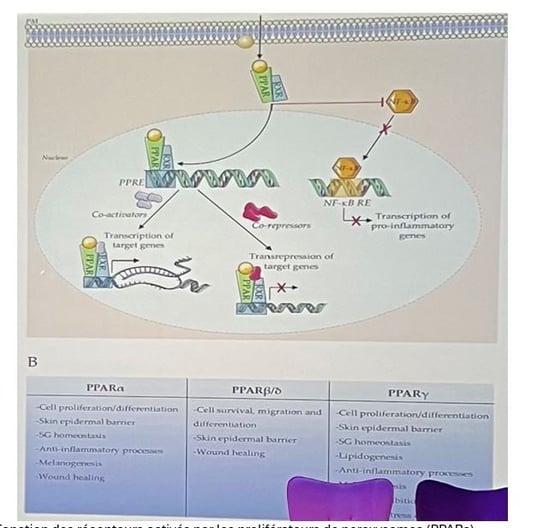
• On distingue trois groupes de PPARs (figure 1) :
1) PPARα : Étudié pour le traitement de la dermatite atopique. Ses fonctions incluent la prolifération/différenciation cellulaire, la barrière épidermique cutanée, l'homéostasie des glandes sébacées (SG), les processus anti-inflammatoires, la mélanogenèse et la cicatrisation.
2) PPARβ/δ : Impliqué dans la survie, la migration et la différenciation cellulaire, la barrière épidermique cutanée, l'homéostasie des glandes sébacées et la cicatrisation.
3) PPARγ : Contrôle la prolifération/différenciation cellulaire, la barrière épidermique cutanée, l'homéostasie des glandes sébacées, les processus anti-inflammatoires et la lipidogenèse.
• Les PPARs ont une large gamme d'activités car ils contrôlent la prolifération, la différenciation cellulaire, le métabolisme cellulaire et la lipidogenèse. Des recherches visent à identifier des activateurs ou modulateurs spécifiques, en se concentrant sur leurs fonctions anti-inflammatoires et leur capacité à contrôler le métabolisme des lipides.
Mélasma
• Le mélasma est défini comme des taches brun clair à foncé, chroniques et hyperpigmentées, avec une disposition symétrique et des bords irréguliers sur la peau du visage ayant été exposée au soleil. Pr Picardo précise que cette définition est historique et que certaines hyperpigmentations parfois appelées mélasma pourraient être post-inflammatoires.
• La prévalence du mélasma est plus élevée chez les femmes (36,3%) que chez les hommes (~6%). Elle est particulièrement élevée chez les femmes âgées de 20 à 50 ans ayant les phototypes de peau Fitzpatrick III, IV et V. La situation est donc "plus active" chez les femmes d'âge fertile et de phototype foncé.
• Il a été décrit il y a plusieurs années que les mélanocytes des peaux affectées sont plus grands, plus dendritiques et plus riches en mélanosomes comparé aux zones non affectées. Cela suggère que l'activation des mélanocytes contribue au développement du mélasma.
Facteurs inducteurs du mélasma et rôle de l'inflammation
• Les principaux déclencheurs du mélasma sont les rayons ultraviolets et la lumière visible. Outre les UVB, les UVA longs (UVA1) et courts (UVA2) participent clairement à son apparition. Une protection solaire efficace doit donc combiner des filtres UVB, UVA et, si possible, des agents filtrant la lumière visible. En effet, les UVA comme la lumière visible pénètrent jusqu’au derme, voire plus profondément.
• Le mélasma est associé à une inflammation : augmentation de l'infiltrat lymphocytaire dans la peau lésionnelle, composé de cellules T CD4+, de mastocytes et de macrophages. Niveaux significativement élevés d'IL-17 et de COX-2 dans la peau affectée par rapport à la peau saine (figure 2).
• Le score MASI (Melasma Area and Severity Index), la fraction d'élastose solaire et la mélanine épidermique sont positivement associés à l'expression de COX-2. Des altérations de la membrane basale et une vascularisation accrue sont également observées.
Figure 2. Caractéristiques histologiques du mélasma communes avec le photovieillissement

Mélasma : rôle des fibroblastes sénescents
• Il a été démontré que les fibroblastes sénescents jouent un rôle dans le mélasma. La peau lésionnelle du mélasma contient davantage de cellules sénescentes dermiques, identifiées par le marqueur p16.
• Ces fibroblastes sénescents sont capables de produire des facteurs de croissance et des composants du SASP (Senescence-Associated Secretory Phenotype). Certains de ces facteurs de croissance peuvent activer les mélanocytes. Il est donc considéré que les fibroblastes pourraient avoir un rôle dans l'activation des mélanocytes au début du mélasma.
Mélasma et glandes sébacées : rôle de l'acide azélaïque
• Le mélasma apparaît préférentiellement sur des zones du visage comme les pommettes, le front et la lèvre supérieure, qui sont riches en glandes sébacées. L'hypothèse a été émise qu'il pourrait y avoir une corrélation entre l'apparition du mélasma et l'activité des glandes sébacées (sébum) et des sébocytes.
L’acide azélaïque pourrait constituer ce point de convergence :
• D’abord employé comme inhibiteur de la tyrosinase pour traiter les hyperpigmentations (dont le mélasma), il a ensuite été adopté contre l’acné, après que des patientes soignées pour leur mélasma ont rapporté une amélioration spontanée de leurs lésions folliculaires.
• Son efficacité repose sur l’activation du récepteur nucléaire PPARγ, grâce auquel il atténue la réponse inflammatoire des kératinocytes face aux stimuli (notamment les UV). Par la même voie, il limite le vieillissement des fibroblastes induit par le PUVA.
Ainsi, l’acide azélaïque réduit l’inflammation, prévient la sénescence cellulaire et contribue à améliorer la qualité de la peau.
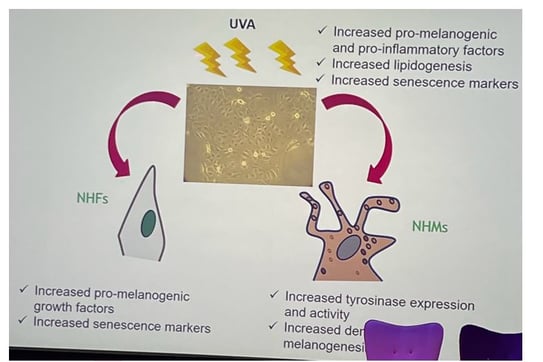
Influence des sébocytes irradiés par les UVA
• Des études ont démontrés qu'une exposition faible mais répétée aux UVA entraîne une apparence sénescente des sébocytes SZ95, une réduction du taux de prolifération et une expression de la bêta-galactosidase.
• Ces sébocytes exposés aux UVA sont capables de produire différents types de facteurs de croissance : POMC (Pro-OpioMelanoCortin), Endothéline-1 (EDN1), Stem Cell Factor (SCF), Basic Fibroblast Growth Factor (b-FGF), cytokines pro-inflammatoires.
• La coculture d'explants de peau avec des sébocytes SZ95 irradiés a entraîné une augmentation de la pigmentation et des modifications des fibroblastes. Le milieu conditionné provenant de sébocytes SZ95 irradiés a également modifié et activé l'activité des mélanocytes.
Ces données montrent qu’après des irradiations UV répétées, les sébocytes libèrent des facteurs de croissance qui stimulent la mélanogenèse (figure 3). L’effet ne passe pas seulement par un dialogue direct avec les mélanocytes : les sécrétions sébocytaires induisent aussi un phénotype sénescent chez les fibroblastes, altérant leur propre production de cytokines. Les fibroblastes ainsi « reprogrammés » synthétisent alors de nouveaux facteurs de croissance qui viennent, à leur tour, activer les mélanocytes.
Cette hypothèse expliquerait pourquoi le mélasma persiste malgré l’arrêt du soleil : une fois l’irradiation interrompue, les sébocytes continuent à sécréter ces facteurs de croissance pendant au moins dix jours.
Figure 3. Effet des UVAs sur les fibroblastes et mélanocytes humains normaux
Preuves in vivo et réseau pathogénique du mélasma
• Chez six femmes présentant un mélasma, le sébum a été prélevé par patchs absorbants sur les zones lésionnelles (L) et non lésionnelles (NL). Dans les sites atteints, il a été observé : une surexpression de p53, des niveaux accrus d’α-MSH, une augmentation de l’endothéline-1 (EDN1), du stem cell factor (SCF) et du b-FGF.
• Ces médiateurs sont exactement ceux que les sébocytes libèrent in vitro après exposition aux UV, montrant qu’in vivo, les sébocytes activés sécrètent des facteurs de croissance capables de stimuler les mélanocytes. Ce mécanisme explique la prédilection du mélasma pour les zones du visage riches en glandes sébacées.
En résumé, Pr Picardo décrit un réseau pathogénique dans lequel les UVA, la lumière visible, les UVB et la pollution activent simultanément sébocytes, kératinocytes, fibroblastes et cellules endothéliales. Les sébocytes ainsi stimulés accroissent leur production de facteurs pro-mélanogènes et pro-inflammatoires, intensifient la lipogenèse et expriment des marqueurs de sénescence. Ces médiateurs agissent surtout sur les fibroblastes dermiques, qui, à leur tour, libèrent davantage de facteurs de croissance pigmentogènes et de signaux de sénescence. L’action conjuguée des sébocytes et des fibroblastes active alors les mélanocytes, augmentant l’expression et l’activité de la tyrosinase ainsi que la production de pigment, y compris au niveau dermique. Le mélasma résulterait donc de cette interaction complexe entre les principales cellules cutanées.
Acné et métabolisme
Sébocytes, acné et voie mTOR
• Chez les personnes souffrant d’acné, la protéine mTOR est surexprimée dans la peau. Cette suractivation, associée à des médiateurs pro-inflammatoires, pousse les cellules souches des glandes sébacées à se comporter moins comme des sébocytes matures et davantage comme des kératinocytes, favorisant ainsi la formation de comédons.
• On observe alors un métabolisme du glucose déréglé, une forte production d’IL-8 et une nette sensibilité à l’insuline : celle-ci stimule la lipogenèse, augmente les acides gras mono-insaturés, active mTOR et accentue l’inflammation – autant de facteurs qui aboutissent à un « sébum de type acné ».
Figure 4. Les sébocytes peu différenciés présentent une faible expression de PPARy et une forte expression d'IGFR/IR.
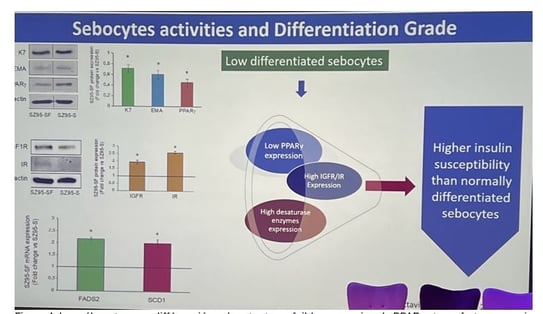
Rôle de PPARγ et intérêt du NAC-GED0507
• Les sébocytes peu différenciés présentent un faible taux de PPARγ et un fort signal mTOR. En appliquant localement le modulateur spécifique NAC-GED0507, on réactive PPARγ : les sébocytes reprennent une différenciation normale, la signalisation mTOR (pS6) diminue, l’IL-1α et la peroxydation lipidique reculent.
• Chez les patients acnéiques, ce traitement s’accompagne d’une hausse de PPARγ, d’une baisse de pS6 et d’une réduction globale de l’inflammation cutanée.
α-MSH, UV et dérèglement métabolique
• L’α-MSH, hormone impliquée dans la pigmentation, peut-elle aussi activer mTOR et stimuler l’absorption de glucose via la voie PI3K. Les UV accentuent encore ces dérèglements, rappelant certains changements observés dans le mélasma.
Metformine : une piste thérapeutique
• La metformine, connue pour réguler le métabolisme glucidique, freine la mélanogenèse et atténue les signes de sénescence cellulaire. En application topique :
- à 15 %, elle fait baisser le score MASI du mélasma après huit semaines ;
- à 30 %, son efficacité rivalise avec la crème triple combinaison, tout en provoquant moins d’effets secondaires.
Ainsi, en modulant le métabolisme du glucose et la réponse cellulaire au stress, la metformine pourrait devenir un traitement prometteur pour le mélasma.
CONCLUSION
En résumé, le mélasma résulte d'une interaction complexe où la lumière visible, les UVA, les UVB et la pollution activent les glandes sébacées, les fibroblastes et les kératinocytes. Toutes ces cellules sont capables de produire des facteurs qui ciblent les mélanocytes. Ces facteurs, combinés à une modification du métabolisme du glucose des cellules suite à une exposition accrue aux UV, conduisent à une hyperactivation qui génère une production accrue de mélanine.
Il est important de considérer que différents types de troubles pigmentaires pourraient être modulés par une voie métabolique, ce qui ouvre une nouvelle frontière et une nouvelle façon d'appréhender comment la peau peut modifier son métabolisme pour induire une protection contre tout danger potentiel.
Orateur : Pr. Hee Young Kang (HYK)
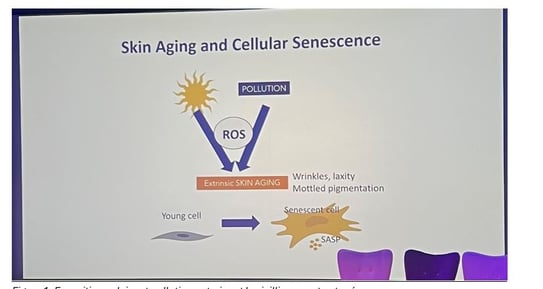
Contexte : Pr HYK rappelle que les facteurs extrinsèques tels que les rayons UV et la pollution de l'air réduisent le vieillissement cutané (figure 1). Ce vieillissement est caractérisé par des rides, un relâchement cutané, une pigmentation mouchetée (ou tachetée) et des problèmes d'hypopigmentation. L'un des principaux mécanismes en cause est l'accumulation des Espèces Réactives de l'Oxygène (ROS), qui induisent la sénescence cellulaire. Ces cellules sénescentes jouent un rôle dans le développement des problèmes cutanés
Figure 1. Exposition solaire et pollution entrainent le vieillissement cutané
Ordre de la sénescence cellulaire dans la peau
Les travaux du Pr HYK sur la sénescence cutanée, menés avec le marqueur p16 INK4A, ont permis d’établir une chronologie claire : le vieillissement cutané s’amorce chez les fibroblastes, atteint ensuite les mélanocytes et ne touche les kératinocytes qu’en dernier.
• Fibroblastes : premiers à vieillir, ils deviennent p16 + dès 10-20 ans et leur proportion augmente régulièrement avec l’âge.
• Mélanocytes : leur sénescence apparaît plus tard, autour de 40-50 ans, surtout dans les zones photo-exposées, puis progresse avec l’avancée en âge.
• Kératinocytes : rares avant 60 ans, les cellules p16 + ne s’observent qu’à maturité avancée et principalement sur la peau exposée au soleil.
Effet des cellules sénescentes sur la pigmentation
• Lorsque notre peau présente un nombre accru de fibroblastes sénescents, la pigmentation augmente. C'est pourquoi, à l'âge mûr, lorsque nous avons un nombre croissant de fibroblastes sénescents, ces cellules peuvent augmenter la pigmentation.
• Les fibroblastes devenus sénescents libèrent un SASP, un cocktail de molécules qui stimule les mélanocytes et accroît la production de pigment. Cette sécrétion excessive contribue directement aux hyperpigmentations liées à l’âge, telles que le mélasma et le lentigo sénile.
Cibler les fibroblastes sénescents pour améliorer la pigmentation
Les lentigos séniles et le mélasma se caractérisent par une accumulation de fibroblastes sénescents p16 +. Ce surplus de cellules vieillissantes semble contribuer directement à l’hyperpigmentation observée dans ces lésions.
• Pour tester cette hypothèse des sénolytiques reconnus (ABT-263 et ABT-737) ont été appliqués sur des explants de peau de lentigo sénile. Ces composés déclenchent l’apoptose sélective des fibroblastes sénescents sans affecter les fibroblastes sains. Leur utilisation a nettement diminué la pigmentation épidermique ex vivo, suggérant qu’éliminer les fibroblastes sénescents peut constituer une approche prometteuse pour atténuer les hyperpigmentations liées au vieillissement.
• Pour traduire cette idée en pratique clinique, nous avons utilisé un appareil de radiofréquence par micro-aiguilles (RF). Le traitement par RF est utilisé pour le rajeunissement de la peau. Nous avons constaté que le traitement par RF peut réduire le nombre de fibroblastes sénescents dans notre peau.
Lorsque des patients atteints de mélasma ont été traités avec le traitement RF seul, celui-ci a pu améliorer le mélasma (figure 2). Comme on peut le voir, le nombre de fibroblastes p16+ a diminué et la synthèse de procollagène-1 a augmenté. Ces résultats sont associés à une diminution de la pigmentation épidermique et, naturellement, à une amélioration du mélasma.
Figure 2. La réduction des cellules sénescentes est associé à l'éclaircissement cutané
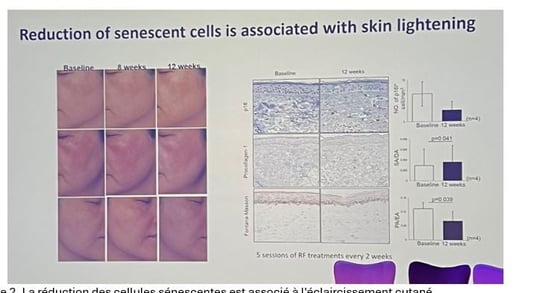
• La rechute du mélasma après l’arrêt des thérapies classiques reste l’un des principaux écueils du traitement. Pour évaluer l’intérêt de la radiofréquence (RF) dans cette phase de maintien, un essai clinique prospectif a été conduit.
Tous les participants ont d’abord reçu un protocole standard associant acide tranexamique oral et crème (Melanon) combinée pendant deux à trois mois ; une fois l’éclaircissement obtenu, ce traitement a été suspendu. Les patients ont alors été randomisés : la moitié a bénéficié d’une séance mensuelle de RF durant six mois, l’autre moitié n’a reçu aucun soin supplémentaire.
Six mois après l’arrêt du traitement conventionnel, la pigmentation du groupe témoin était revenue à son niveau initial. En revanche, les patients traités par RF ont conservé le bénéfice clinique, confirmant la capacité de cette technique à prévenir les rechutes de mélasma.
• Ces essais cliniques indiquent qu’une prise en charge efficace du mélasma doit également cibler les fibroblastes sénescents (figure 3) : puisqu’ils participent à la photopigmentation, le traitement ne peut se résumer à l’inhibition des mélanocytes, mais doit inclure des stratégies visant à éliminer ou moduler ces fibroblastes vieillissants.
Figure 3. La senescence des fibroblastes contribue au photovieillissement

Vieillissement des mélanocytes
• À partir de 60-70 ans, notre peau renferme un nombre croissant de mélanocytes sénescents. Dans un modèle in vitro obtenu par irradiation UV, ces cellules expriment beaucoup moins de MITF, de tyrosinase et de RAB27A (marqueur de transport des mélanosomes) ; ils accumulent donc la mélanine au lieu de la transférer, ce qui perturbe la pigmentation normale.
• En co-culture, de jeunes mélanocytes réagissent aux fibroblastes âgés en fabriquant davantage de pigment, tandis que les mélanocytes sénescents restent inertes (figure 4). Plus ces derniers sont nombreux, plus la pigmentation globale diminue — un phénomène illustré par l’hypomélanose en goutte : dans les lésions, on compte moins de mélanocytes et ceux qui subsistent présentent des dendrites raccourcies et des amas de mélanosomes périnucléaires, signes caractéristiques de sénescence.
Figure 4. Variation des marqueurs de senescence, de pigmentation et du SASP dans les melanocytes sénescents
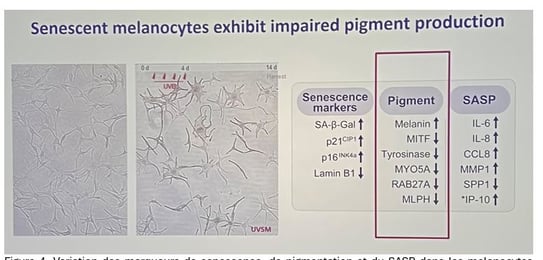
• Comme toutes les cellules vieillissantes, les mélanocytes sénescents émettent un SASP (cocktail de cytokines) qui accélère le vieillissement des voisines (figure 4). Leur sécrétion d’IP-10, par exemple, freine la prolifération kératinocytaire et favorise l’atrophie épidermique ; leur surnageant diminue filaggrine, loricrine et claudine-1, compromettant la barrière cutanée.
En résumé, les mélanocytes sénescents pigmentent mal et propagent le vieillissement autour d’eux (figure 5) ; ralentir leur sénescence ou éliminer ces cellules pourrait donc améliorer la fonction pigmentaire et la santé globale de la peau.
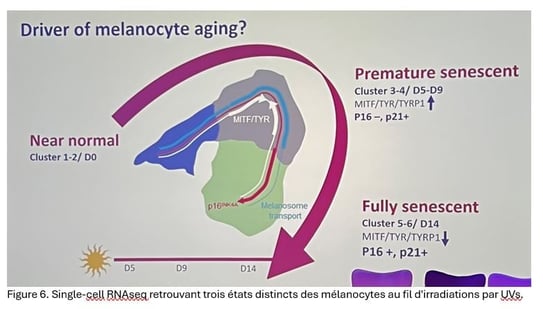
• Les mélanocytes arrivant en sénescence complète basculent vers la glycolyse. En laboratoire, l’inhibition de cette voie par 2-désoxyglucose (2-DG) retarde la sénescence et améliore leur phénotype, confirmant l’importance du métabolisme énergétique.
• Le premier signe d’entrée en sénescence est cependant la perte d’autophagie : dès les premières heures d’UV, l’expression d’ATG7 (marqueur le plus précoce et le plus constant) diminue puis reste basse. Supprimer ATG7 accélère la sénescence et augmente la production de ROS. Nous avons donc testé la metformine, connue pour restaurer l’autophagie via ATG7 et limiter le stress oxydatif ; ajoutée durant les UV, elle relance l’expression d’ATG7, réduit les ROS et retarde le vieillissement des mélanocytes.
• Enfin, le stress oxydatif s’avère crucial : le marqueur SPP1, fortement abaissé dans les cellules sénescentes, favorise la production de ROS. Des antioxydants tels que le glutathion ou la N-acétylcystéine,administrés pendant les UV, freinent à leur tour l’apparition de la sénescence.
Autophagie, métabolisme et contrôle des ROS constituent donc trois leviers complémentaires pour préserver la longévité et la fonction pigmentaire des mélanocytes.
Take home messages/Conclusion
• La pigmentation est influencée par la sénescence cellulaire : les fibroblastes sénescents entraînent une hyperpigmentation et sont des cibles thérapeutiques clés pour les maladies hyperpigmentaires telles que le mélasma.
• Dans la peau âgée, les mélanocytes sénescents ont une production de pigments altérée et peuvent accélérer le vieillissement des kératinocytes.
• Le ralentissement du vieillissement des mélanocytes implique la restauration de la fonction d'autophagie et la réduction du stress oxydatif.
En conclusion, des traitements ciblés axés sur la reprogrammation métabolique et l'interaction entre les cellules âgées et le stress oxydatif pourraient être essentiels pour la pigmentation.

Contexte : Pr Chee Leok Goh a précisé qu'il n'allait pas parler de sciences fondamentales, mais plutôt tenter de corréler ces avancées à sa pratique clinique. Il a souligné l'importance de cette corrélation, car de nombreuses découvertes faites en laboratoire ne sont pas toujours applicables en clinique, ou ne fonctionnent pas du tout dans la pratique, ce qui justifie la nécessité de mener des essais cliniques. À titre d'exemple, il a mentionné un essai en cours sur la radiofréquence pour le traitement du mélasma.
Mélasma
• Le mélasma est une affection cutanée très fréquente, se caractérisant par des taches pigmentées sur le visage. Sa prévalence varie selon les régions du monde : en Asie, elle atteint 20 à 30 % des femmes, alors qu'elle touche environ 1 à 2 % chez les Caucasiens. Pendant la grossesse, ce chiffre grimpe à 30-50 %.
• Le diagnostic du mélasma est purement clinique, ce qui le rend complexe à traiter. En effet, aucun test de laboratoire ni biopsie ne permet un diagnostic précis. Historiquement classé en mélasma épidermique (plus facile à traiter) ou dermique, il est désormais reconnu principalement comme mélasma mixte, souvent résistant aux traitements classiques.
• Il a été décrit il y a plusieurs années que les mélanocytes des peaux affectées sont plus grands, plus dendritiques et plus riches en mélanosomes comparé aux zones non affectées. Cela suggère que l'activation des mélanocytes contribue au développement du mélasma.
Facteurs étiologiques
• Le mélasma est multifactoriel (figure 1). Parmi ces facteurs, on retrouve les facteurs génétiques, l'exposition au soleil (UV et lumière visible), et les influences hormonales telles que la grossesse, la contraception orale et le traitement hormonal substitutif.
• D'autres facteurs comme les cosmétiques, certains médicaments, le stress et plus récemment la pollution atmosphérique jouent également un rôle important dans le développement du mélasma. Des études montrent une incidence plus élevée de troubles pigmentaires chez les personnes travaillant dans des environnements pollués.

Physiopathogénie : de l'ancien au nouveau paradigme
• Auparavant, le mélasma était vu comme un problème exclusivement lié aux mélanocytes, stimulés par la MSH activant le récepteur MC1-R et la tyrosinase pour produire la mélanine. Ce concept est aujourd'hui considéré comme dépassé.
• Actuellement, le mélasma est reconnu comme une affection multifactorielle, impliquant plusieurs mécanismes complexes (figure 2) :
- Voies de signalisation complexes : Le pro-opiomélanocortine (POMC) de l'hypophyse peut libérer l'ACTH, l'αMSH et la β-endorphine. La MSH, via l'AMPc et la Protéine kinase A, stimule le récepteur MC1-R.
- Récepteurs découverts récemment : De nouveaux récepteurs stimuleraient les mélanocytes. Parmi ceux-ci figurent les récepteurs opioïdes, les récepteurs aux œstrogènes et à la progestérone. Ceux-ci sont présents non seulement dans l'épiderme mais aussi en quantité accrue dans le derme.
- Facteurs liés aux fibroblastes : Les fibroblastes sécrètent des facteurs de croissance (ex: bFGF et endothéline-1) qui stimulent les mélanocytes. Des études ont montré que les niveaux de protéines αMSH et l'expression du SCF provenant des fibroblastes sont plus élevés dans la peau de mélasma.
- Rôle du stress oxydatif : L'irradiation UV peut activer la p53 et les espèces réactives de l'oxygène (ROS), qui à leur tour activent la PKA via l'AMPc et la peroxydation lipidique.
- Activation du plasminogène tissulaire (TPA) : Le TPA, via le Ca2+, peut activer la PKC, influençant également la pigmentation.
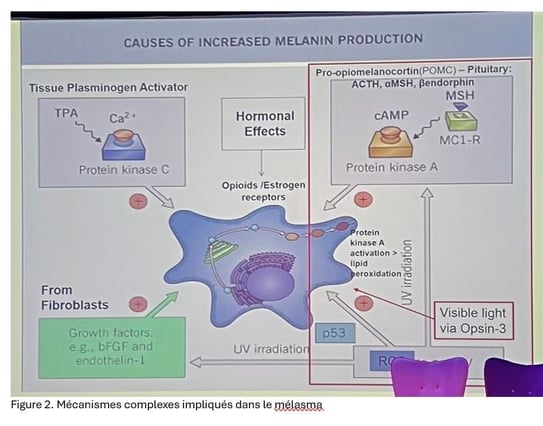
Nouveaux facteurs pathogéniques du mélasma (figure 3)
• Voie Wnt : cette voie de signalisation joue un rôle essentiel dans la pigmentation cutanée. Elle régule la différenciation des mélanocytes et la production de mélanine. Cette voie contrôle directement l’expression du MITF, gène clé dans la régulation des mélanocytes.
• Vascularisation : Le mélasma est associé à une augmentation de la vascularisation cutanée. Tous les patients atteints de mélasma n'ont pas des taches homogènes ; certains présentent de très petits capillaires (télangiectasies) associés à la pigmentation, suggérant une composante vasculaire.
Des études ont identifié une forte présence du VEGF et d’autres marqueurs vasculaires (facteur VIII) dans les lésions pigmentées. Le traitement de ces facteurs vasculaires pourrait améliorer le contrôle du mélasma
• Mastocytes : Les mastocytes sont présents en plus grand nombre dans les lésions de mélasma. L’acide tranexamique, efficace contre le mélasma, réduit la pigmentation ainsi que la densité des mastocytes et des vaisseaux sanguins dans les lésions.
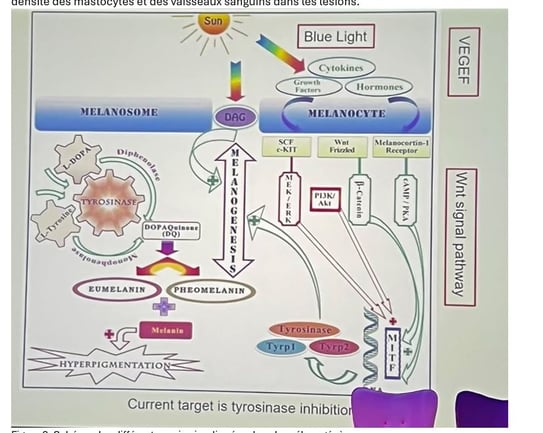
Rôle de la lumière visible (bleue) dans la pigmentation (figure 4)
• La lumière bleue visible joue un rôle significatif dans la pigmentation, particulièrement chez les phototypes de peau foncés. Cette pigmentation est durable, persistant jusqu'à six mois.
• L'Opsine-3 (OPN3) est le récepteur clé activé par la lumière bleue, entraînant une activité accrue de la tyrosinase et une pigmentation prolongée. Actuellement, les antioxydants sont utilisés en prévention, en attendant des protections spécifiques contre la lumière visible.
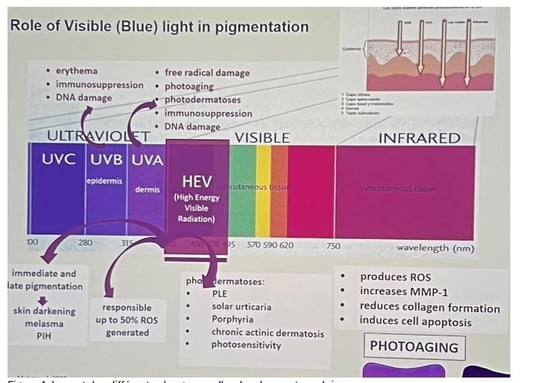
Le mélasma : Un trouble du photovieillissement et une maladie chronique
• Le mélasma est désormais considéré comme un trouble du photovieillissement chronique, caractérisé par des modifications cutanées comme une vascularisation accrue et des altérations de la membrane basale. Aucun traitement définitif n’existe à ce jour ; le but thérapeutique est de contrôler durablement la pigmentation grâce à une approche combinée.
Approches thérapeutiques et agents topiques (figure 5)
Le traitement du mélasma vise à cibler simultanément de multiples mécanismes impliqués dans les troubles de l'hyperpigmentation.
• Protection solaire : elle demeure essentielle. Les antioxydants sont recommandés, en attendant des écrans solaires adaptés à la lumière visible, particulièrement pour les phototypes IV et V.
• Traitements systémiques : L’acide tranexamique (TXA) oral est actuellement considéré comme l’un des traitements les plus efficaces. Il améliore significativement les cas récalcitrants de mélasma en réduisant la pigmentation, bien que le mécanisme précis reste à clarifier (hypothèses : effet sur la vascularisation et potentiellement sur les mastocytes). Les études sur l'acide tranexamique topique ont montré des résultats mitigés, certaines ne montrant pas d'amélioration, tandis que d'autres le jugent comparable à l'hydroquinone.
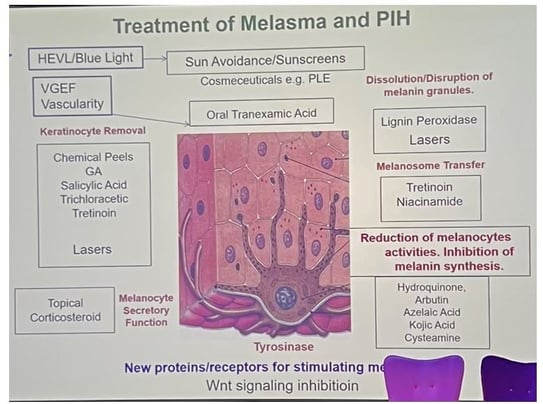
• Agents topiques : de nombreux agents topiques, y compris des prescriptions et des cosmétiques, sont disponibles.
- Hydroquinone (HQ) : Pilier du traitement, inhibe la tyrosinase et dégrade les mélanosomes. Souvent interdite en OTC.
- Méquinol : Dérivé de l'HQ, moins irritant, probable inhibiteur compétitif de la tyrosinase.
- Rétinoïdes (comme la Trétinoïne) : Analogues de la vitamine A, modulent la prolifération cellulaire, la différenciation, l'apoptose et ont des effets anti-inflammatoires.
- Acide Kojique : Métabolite fongique qui inhibe la tyrosinase en chélatant le cuivre.
- Arbutine : Dérivé de l'HQ sans effets mélanotoxiques, inhibe la tyrosinase et la maturation des mélanosomes.
- Niacinamide (Vitamine B3) : Inhibe le transfert des mélanosomes des mélanocytes vers les kératinocytes, réduisant ainsi la pigmentation. Peut être utilisée seule ou en combinaison avec la N-acétyl glucosamine.
- N-acétyl glucosamine : Inhibiteur de la glycosylation de la tyrosinase, réduisant la mélanogenèse.
- Acide Ascorbique (Vitamine C) : Antioxydant, réduit la DOPA oxydée et interagit avec les ions cuivre de la tyrosinase.
- Réglisse (Glycyrrhiza glabra) : Utilisée en cosméceutiques, avec des propriétés anti-inflammatoires, antivirales, antimicrobiennes. La glabridine inhibe la tyrosinase ; la liquiritine provoque la dépigmentation par dispersion de la mélanine.
- Soja : Active le récepteur PAR-2 sur les kératinocytes, médiant le transfert des mélanosomes.
- Acide Azélaïque : Un acide dicarboxylique qui peut être utilisé.
- Cystéamine (Cysteamine cream) : Un composé thiol qui inhibe la tyrosinase. Des études ont montré une réduction significative de l'indice MASI et de l'indice de mélanine. Bien qu'efficace, elle est coûteuse et a une odeur désagréable d'œuf pourri.
- 2-MNG (2-méthoxy-1,4-naphthoquinone) : Un nouveau composé qui se lie et inactive les précurseurs intermédiaires de la mélanine (DOPAquinone, DHICAQ, DHIQ), bloquant ainsi la formation de pigments. C'est un produit en vente libre. Des produits combinés l'incluent avec d'autres agents comme le rétinol et la niacinamide.
• Procédures esthétiques : Les lasers et autres appareils lumineux peuvent induire une hyperpigmentation post-inflammatoire ; ils sont donc limités aux cas vasculaires spécifiques. Les peelings chimiques peuvent être utiles pour éliminer les cellules pigmentées superficielles, mais nécessitent une attention particulière.
Pr Goh a conclu en réitérant que le mélasma n'est pas une entité unique et qu'il faut regarder au-delà des seuls mélanocytes. À l'avenir, les traitements devraient être adaptés aux différents sous-types de mélasma, en utilisant de multiples agents, de manière séquentielle ou concomitante, pour obtenir des résultats durables.
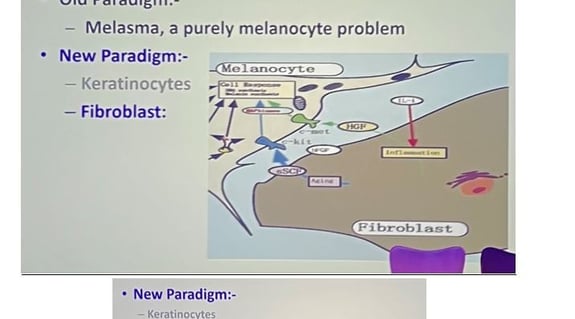
Orateur : Pr. Jean Krutmann
1. L'Exposome : un concept holistique
• L'exposome est un terme "à la mode" qui a été inventé par le Dr. Christopher Wild en 2005. Ce concept est né en réaction à la disparité des fonds de recherche et de l'attention qui étaient principalement accordés à la génomique à cette époque.
La définition fournie par Wild est la "totalité de toutes les expositions auxquelles un individu est soumis de la conception à la mort". En d'autres termes, il s'agit de l'ensemble des facteurs non génétiques auxquels nous avons été exposés dans notre vie.
L'exposome prend également en compte la séquence temporelle des expositions tout au long de la vie.
Le concept est holistique, considérant l'environnement comme un système complexe (figure 1). Il met en évidence que de multiples expositions, plutôt qu'une seule, sont nécessaires au développement d'un phénotype. Le développement d'outils et de technologies de mesure, comme les appareils portables, a grandement facilité la capacité à couvrir avec une grande précision les situations d'exposition.
L'exposome est actuellement divisé en 3 grands sous types d’exposome (figure 1) : internal, specific external et general external exposome. Ce dernier comprend les facteurs plus pertinent au niveau cutané notamment : les radiations solaires, la pollution atmosphérique et les changements climatiques.
• Le "skin aging exposome" (exposome du vieillissement cutané) a été défini comme "la totalité de tous les facteurs non génétiques contribuant au vieillissement extrinsèque de la peau". Ces facteurs incluent la lumière naturelle du soleil, différents types de pollution atmosphérique, l'exposition à la fumée de cigarette, les facteurs nutritionnels, la température, et d'autres.
2. Facteurs exposomiques et vieillissement cutané
De plus en plus de recherches sont menées sur l'exposome du vieillissement cutané. Pr Krutmann s'est intéressé à ce domaine et a résumé les preuves existantes dans un article de revue, catégorisant les facteurs exposomiques importants pour le développement des phénotypes de vieillissement cutané en quatre domaines principaux (rayonnement solaire, pollution atmosphérique, facteurs climatiques, nutrition). La présentation se concentrera sur la pollution atmosphérique et les facteurs climatiques, moins étudiés que le rayonnement solaire.
Pollution atmosphérique et peau
• La pollution atmosphérique affectant la peau est principalement liée à l'exposition aux particules fines (PM2.5), leur petite taille permet de pénétrer la peau et y causer inflammation et vieillissement prématuré. Les particules ultrafines (UFP) peuvent également jouer un rôle mais impact et leur part dans la pollution totale sont encore à l'étude. Les PM10 sont moins directement impactantes pour les couches profondes de la peau car leur taille importante limite leur pénétration. Il s'agit d'un problème mondial, pertinent non seulement dans les grandes villes comme Delhi, Mumbai ou Mexico, mais aussi en Europe (Paris, Londres, Allemagne).
• Des études de cohortes longitudinales basées sur la population sont généralement la meilleure approche pour comprendre l'impact sur la santé des facteurs environnementaux. La première étude de ce type, publiée en 2010 par Andrea Vierkötter et al. a examiné la relation entre l'exposition aux particules aériennes et le vieillissement extrinsèque de la peau. Cette étude, menée sur une cohorte de femmes allemandes âgées, a révélé des ratios de cotes très élevés indiquant une association entre la suie (équivalente aux particules de diesel) et les particules associées au trafic avec les signes de vieillissement cutané de la face, en particulier les taches pigmentaires (lentigo actiniques) sur le front et les joues, ainsi que des associations significatives avec les rides. Depuis lors, ces résultats ont été corroborés par de nombreuses études épidémiologiques dans différentes régions du monde, et il est généralement admis que l'exposition chronique à la pollution atmosphérique liée au trafic est associée à l'hyperpigmentation faciale.
Preuves mécanistiques de l'effet de la pollution sur la pigmentation
• Des études ont démontré un lien causal. L'institut du conférencier a publié une recherche utilisant le "Düsseldorf Pollution Patch Test". Ce test consiste à appliquer de manière topique une mixture standardisée de particules de diesel sur de la peau humaine ex vivo ou in vivo (volontaires sains) pendant 10 jours. Il a été observé que la peau fonce suite à une augmentation de la mélanine.
• Le mécanisme sous-jacent est médié par le stress oxydatif. L'application de particules de diesel entraîne une augmentation des dommages oxydatifs (tel que la peroxydation lipidique). Cette réponse de bronzage induite par les particules de diesel peut être réduite ou complètement empêchée par l'application topique d'antioxydants.
• Ce phénomène s'observe aussi chez les animaux, comme le mélanisme industriel (par exemple, des serpents de mer devenant noirs dans l'eau polluée, où la mélanine lie les métaux lourds toxiques, qui sont ensuite éliminés lorsque l'animal mue). Ceci est similaire aux mécanismes de protection observés dans la peau humaine.
• Il est important de noter que l'apparition des signes de vieillissement cutané lié à la pollution du trafic n'est pas médiée par un effet systémique (inhalation), mais plutôt par une exposition directe à la surface de la peau.
• Ces découvertes ont des applications translationnelles pour l'industrie cosmétique, notamment pour les études de validation de revendications. Le patch test peut être utilisé pour tester des produits cosmétiques ou des compléments nutritionnels contenant des antioxydants.
Facteurs climatiques et peau
• Le changement climatique et l'augmentation des températures sont une préoccupation croissante pour la communauté dermatologique. Bien que les effets sur la santé aient été largement étudiés pour les maladies cardiovasculaires, pulmonaires et les troubles mentaux, peu de choses sont connues sur les effets sur la peau.
• Une étude épidémiologique a été menée en Inde (dans le cadre de la cohorte CASAI : Climate, Air Pollution and Skin Aging in Indian women) sur 1500 femmes indiennes vivant dans différentes villes (Delhi, Mumbai, Bangalore) avec des niveaux de pollution et des augmentations de température ambiante variés. Cette étude a révélé une association significative entre l'effet combiné de la température ambiante et de l'humidité relative et le développement de phénotypes de vieillissement cutané, tels que les macules hyperpigmentées sur le front et diverses rides. Ces associations persistent même après ajustement pour l'exposition au soleil, l'âge biologique et la pollution atmosphérique. L'indice de chaleur (heat index) apparaît comme un facteur environnemental significativement associé au vieillissement cutané du visage.
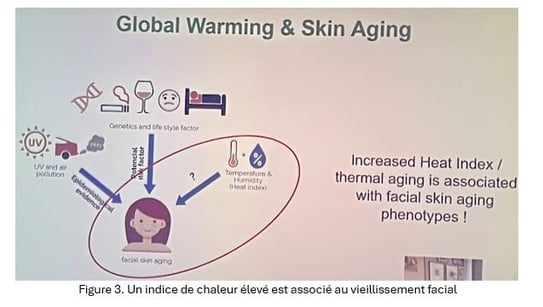
Preuves mécanistiques de l'effet de la chaleur et l'humidité sur la pigmentation
• Les preuves mécanistiques étaient initialement rares en raison de l'absence de modèles physiologiquement pertinents (les modèles existants utilisaient des températures trop élevées, reflétant un choc thermique plutôt qu'une augmentation ambiante).
• Un modèle de peau humaine ex vivo a été développé où la peau est exposée à des augmentations de température physiologiquement pertinentes (par exemple, de 31°C à 35°C ou 37°C) avec une humidité relative élevée. Ce modèle a montré une augmentation dose-dépendante de la pigmentation cutanée sur une période de 10 jours, en particulier à 35°C et 37°C.
• Le mécanisme sous-jacent est très similaire à celui de la pollution : le stress oxydatif (augmentation des produits de peroxydation lipidique et des dommages oxydatifs à l'ADN). L'application topique d'un produit cosmétique contenant des antioxydants (vitamine C, vitamine E et acide férulique) a pu réduire complètement l'augmentation de la pigmentation induite par la température et l'humidité.
• Ces découvertes ont des implications importantes pour l'industrie cosmétique, permettant de valider les revendications de protection contre les effets néfastes liés au changement climatique.
3. Syndrome de Cockayne et vieillissement cutané accéléré
Pr Krutmann a ensuite abordé un autre domaine de recherche : les syndromes de déficience de la réparation par excision de nucléotides (NER) comme modèles d'accélération du vieillissement cutané.
Cockayne Syndrome B (CSB)
• Le syndrome de Cockayne (CS) est un trouble multisystémique rare, principalement causé par des mutations dans le gène CSB. Les patients atteints de CS ont une espérance de vie considérablement réduite (moyenne de 13 ans). Ils présentent, outre des symptômes cutanés (hypersensibilité aux UV, perte de graisse sous-cutanée), un nanisme contractif et des anomalies neurodéveloppementales progressives sévères. Actuellement, il n'existe pas de traitement efficace pour le syndrome de Cockayne.
• L'équipe du Pr Krutmann a émis l'hypothèse que la protéine CSB pourrait avoir des fonctions biologiques au-delà de son rôle bien connu dans la réparation de l'ADN nucléaire induite par les UV. Ils ont découvert que la CSB se localise au centrosome et interagit avec les enzymes HDAC6 et MEC17, qui sont cruciales pour l'acétylation et la méthylation des microtubules. Une déficience en CSB entraîne une perturbation de l'autophagie (un processus de recyclage cellulaire).
Études chez la souris et corrections pharmacologiques
• Des études sur des souris déficientes en CSB exposées aux rayons UVA ont montré un phénotype cutané dramatique : perte quasi-complète de la graisse sous-cutanée, fibrose cutanée marquée et épaississement de l'épiderme (acanthose). Au niveau moléculaire, on observe une réaction inflammatoire (augmentation de TNFα, IL1β), une expression accrue de gènes liés à la fibrose (fibulin-1, collagen 1α1) et une accumulation de marqueurs d'autophagie (P62).
• L'hypothèse était que ce phénotype résultait de la perturbation de l'acétylation des microtubules et des problèmes d'autophagie. Pour corriger cela, ils ont ciblé l'acétylation des microtubules pharmacologiquement en inhibant les désacétylases histones (HDAC).
Ils ont utilisé le SAHA (Vorinostat), un inhibiteur pan-HDAC approuvé par la FDA. Le traitement de fibroblastes de peau humaine primaires de patients CSB avec SAHA a normalisé l'acétylation des protéines et l'accumulation des marqueurs d'autophagie. Une étude d'intervention sur des souris déficientes en CSB traitées avec SAHA dans l'eau de boisson a montré une récupération presque complète du phénotype cutané. La graisse sous-cutanée a été préservée, le développement de la fibrose a été empêché, et les marqueurs moléculaires sont revenus à des niveaux normaux.
• Cette découverte a été qualifiée de "changement de paradigme", car elle identifie une nouvelle fonction importante des protéines CSB dans l'acétylation des protéines et la régulation de l'autophagie. Ces conclusions ont été validées dans trois espèces (humains, souris, C. elegans).
Ciblage du phénotype cérébral du CSB
• Bien que les problèmes cutanés soient importants, la qualité de vie et l'espérance de vie des patients CSB sont principalement affectées par leur phénotype cérébral (micocéphalie, démyélinisation, déficience intellectuelle sévère).
• Les modèles animaux existants ne reflètent pas adéquatement le phénotype cérébral. L'équipe du Pr Krutmann a donc développé des approches alternatives utilisant des cellules souches pluripotentes induites humaines (iPSC), dérivées de patients ou génétiquement modifiées. À partir de ces iPSC, ils ont développé des neurosphères pour étudier les premiers stades du développement cérébral embryonnaire. Ils ont évalué la prolifération, la migration cellulaire, la différenciation neuronale et la formation de réseaux neuronaux.
Ils ont observé que les neurosphères déficientes en CSB ne montraient pas de différences significatives de prolifération, mais une diminution significative de la capacité de migration cellulaire.
• Ce défaut de migration était lié à des problèmes d'acétylation des microtubules et d'autophagie, et a pu être sauvé par un inhibiteur plus spécifique de la HDAC6, la Tubacin A (le SAHA n'étant pas bien toléré dans ces modèles).
Cependant, le traitement par inhibiteur de HDAC n'a pas réussi à sauver d'autres phénotypes, comme l'activité électrique accrue et irrégulière observée dans les réseaux neuronaux. Cela suggère que le traitement par inhibiteur de HDAC ne sera qu'une partie d'un traitement efficace pour les patients atteints du syndrome de Cockayne B.
• L'équipe explore également l'utilisation d'organoïdes cérébraux dérivés d'iPSC pour étudier des stades ultérieurs du développement cérébral. Après 40 jours, les organoïdes déficients en CSB sont beaucoup plus petits, présentent des anomalies structurelles et une activité électrique très différente (plus de pics, rythme plus irrégulier). Des recherches sont en cours pour voir si l'inhibition de HDAC peut améliorer ces phénotypes.
4. Perspectives translationnelles pour l'industrie cosmétique
La modulation des mécanismes épigénétiques dans le vieillissement cutané est un domaine encore sous-développé, et l'équipe est ouverte à la collaboration avec l'industrie cosmétique pour explorer ces pistes.
Orateur : Pr. Thierry Passeron
Contexte : Introduction du Pr Passeron présentant les principales longueurs d'ondes du spectre solaire auxquelles nous faisons face au quotidiens (UVB, UVA2, UVA1, lumière visible et infrarouge) et rappelant que plus la longueur d'onde est importante plus la pénétration dans la peau est profonde. Il précise que ces longueurs d'ondes ont à la fois des effets propres et des effets en communs (overlapping effects).
Au-delà des UV qui sont au centre des débats et dont les effets sur la peau sont bien connus, quel est l'impact de la lumière visible (LV) ? Comment la considérer/positionner au sein de nos recommandations de photoprotection ? Le but de la présentation était de passer en revue les données existantes concernant les conséquences de la LV sur notre peau.
Rappel concernant les UVs
Généralités concernant la lumière visible (LV)
Photovieillissement et lumière visible (LV)
Conclusion (photovieillissement) : nous pouvons à ce jour affirmer que la LV induit le stress oxydatif, favorise la libération de MMP et la réduction de la production de collagène. Malgré la faible quantité de données sur LV et skin-aging (pas de démonstration animal ou clinique), les résultats in vitro solides suggèrent donc que la LV participe au process de photovieillissement (à un degré moins important que le UVs).
Pigmentation et lumière visible (LV)
L'OPSIN3 fonctionne donc comme un capteur de la lumière visible. La mélanogénèse induite par l'OPSIN3 est dépendante du calcium et active ensuite CAMKII, puis CREB (kinase régulée par des signaux extracellulaires) et p38, ce qui conduit à la phosphorylation du MITF et, finalement, à l'augmentation des enzymes de la mélanogénèse : la tyrosinase (Tyr) et la dopachrome tautomérase (Dct). De plus, la lumière bleue induit la formation d'un complexe protéique stable formé par la tyrosinase et la dopachrome tautomérase (fig 1).
Ce complexe multimérique Tyr/P se forme principalement dans les mélanocytes à peau foncée et induit une activité tyrosinase prolongée, ce qui explique l'hyperpigmentation durable observée uniquement sur les peaux de phototype III et plus après irradiation par la lumière bleue.
Les appareils électroniques émettant également une lumière bleue (de faible intensité : 420-490 nm), l'exposition cumulative a suscité des inquiétudes, en particulier dans des cas tels que le mélasma, où la peau est plus réactive. Cependant, une étude publiée en 2019 (JAAD) a montré qu'une exposition à court terme et à haute intensité à un écran (8 heures/jour pendant 5 jours à 20 cm) n'aggravait pas le mélasma. Bien que peu probables, les effets à long terme ne peuvent être totalement exclus. A noter que la lumière bleue émise par les écrans est 100 à 1000 fois moins intense que celle émise par le soleil !
La conclusion claire est donc que, en particulier pour la pigmentation, si nous voulons vraiment protéger nos patients, nous devons combiner une protection contre les rayons UVA longs et la lumière visible.
Photoprotection et lumière visible (LV)
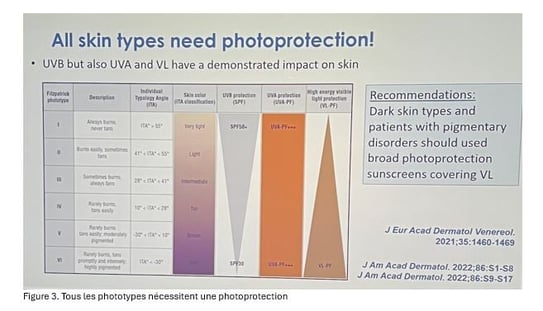
Quid des antioxydants ?
Sur le plan de la pigmentation, le rôle photoprotecteur des antioxydants contre la LV est controversé et les preuves insuffisantes. Les études montrent que les antioxydants ont des effets limités ou modérés, les formes topiques peuvent être efficaces in vivo, en particulier contre les UVA1 + VL. Les modèles ex vivo ne confirment pas l'efficacité des antioxydants tels que la NAC.
Études in vivo :
1. Antioxydants oraux (J Drugs Dermatol. 2019 et Photodermatol Photoimmunol Photomed. 2019.)
2. Antioxydants topiques (Photochem Photobiol. 2022)
Les filtres minéraux/barrières physiques : meilleure solution à l’heure actuelle contre la lumière visible
Corrélation entre la transmission de la lumière visible et l’hyperpigmentation induite
Troubles pigmentaires et lumière visible
Take home messages
Conclusion : La protection contre la lumière visible est indispensable dans les troubles pigmentaires et certaines photodermatoses. Elle pourrait également être bénéfique dans la prévention du vieillissement cutané.
Orateur : Pr. David Fisher
Contexte : La présentation aborde brièvement l'impact de la lumière ultraviolette (UVA, UVB, UVC) et de la lumière visible sur la peau, qui peut entraîner des problèmes allant du photovieillissement bénin aux cancers de la peau. Il souligne que les écrans solaires actuels, bien qu'extrêmement efficaces pour la protection contre les coups de soleil et les UVB en contexte aigu, présentent une efficacité étonnamment faible ou insuffisante contre le risque de cancer de la peau, en particulier le mélanome. Ceci suggère qu'il y a plus de mécanismes en jeu que la simple protection UV.
Les SIK, évoquées brièvement la veille, sont un groupe de kinases jouant un rôle en aval de la signalisation des seconds messagers et ayant suscité l'intérêt de son laboratoire en raison de leur contrôle de la voie pigmentaire.
1. Mécanisme de la voie SIK et pigmentation
• Le professeur décrit clairement comment le chemin de signalisation des UV, impliquant les kératinocytes, le p53 et la MSH (Melanocyte-Stimulating Hormone) qui libère des signaux vers le mélanocyte, active la production de mélanine (figure 1). Il précise ensuite qu'un composant clé en aval de l'AMP cyclique dans cette réponse de bronzage est la voie de la kinase inductible par le sel (SIK) (figure 1).

Lorsque la SIK est active, elle phosphoryle la protéine CRTC, l'ancrant dans le cytoplasme. Lorsque la SIK est inactivée (par l'augmentation de l'AMP cyclique), la CRTC n'est plus phosphorylée, se déplace vers le noyau et devient un facteur de transcription, stimulant le MITF et toute la voie pigmentaire.
==> Les inhibiteurs de la SIK peuvent donc induire la pigmentation.
• L'application d'un inhibiteur topique de la SIK sur une souris rousse a suffi à activer l'expression du MITF et la voie pigmentaire, entraînant un passage de la phéomélanine à l'eumélanine, visible par une tache pigmentaire foncée. Cependant, il est important de noter que l'application de cette technologie pour l'assombrissement de la peau humaine est actuellement un domaine de recherche actif et n'est pas encore prête pour un usage pratique, en raison de la puissante barrière cutanée humaine. Des preuves ex vivo de pigmentation existent, mais les preuves in vivo sur la peau humaine sont très faibles et spécifiques.
2. Voie SIK et réparation de l'ADN
Une étude ex vivo sur la peau humaine a montré que le pré-traitement avec SLT-001 ou SLT-008 avant l'exposition aux UVB conduit à une réparation accélérée des dimères de cyclobutane pyrimidine (CPDs), des marqueurs de dommages à l'ADN, 24 heures après l'exposition. SLT-008 est apparu plus puissant.
Ces résultats confirment que les inhibiteurs de SIK améliorent la cinétique d'une voie endogène de réparation de l'ADN, ne s'agissant pas d'un effet de filtrage UV. Par ailleurs, un inhibiteur de SIK inactif, SLT-043, a été utilisé comme contrôle négatif, et il n'a montré aucune altération de la cinétique des CPDs, validant la spécificité des résultats.
3. Voie SIK, MMP1 et réparation tissulaire
Fait intéressant : l'ampleur de la réduction de la MMP-1 peut même descendre en dessous des niveaux de base, suggérant que les inhibiteurs de SIK pourraient également diminuer les niveaux basaux de MMP-1 associés au vieillissement.
4. Essais cliniques et application potentielles
Indirectement, une diminution de l'érythème (rougeur) induit par les UV a également été observée, probablement liée à l'amélioration de la réparation de l'ADN.
Le traitement avec l'inhibiteur de SIK a essentiellement bloqué l'induction prévisible de la MMP-1 après les UV.
Les inhibiteurs de SIK offrent donc une protection tissulaire comparable au rétinol, mais avec un profil de toxicité bien meilleur, évitant les irritations et les altérations histologiques souvent associées au rétinol.
Pr Fisher identifie plusieurs opportunités majeures pour le futur :
Conclusion/Take home messages
Les inhibiteurs de petites molécules SIK, tels que SLT-001 et SLT-008, ont démontré des activités marquées sur :
Ces composés sont en phase de formulation finale pour usage clinique. L'effet de pigmentation, bien que d'un grand intérêt pour la protection contre le cancer de la peau, est une activité clairement séparable qui n'a pas été observée dans les études cliniques menées jusqu'à présent avec ces formulations, mais reste un domaine de recherche active pour de futures applications.
Créez en toute simplicité votre compte professionnel
Je crée mon compteAméliorez vos connaissances professionnelles en profitant de nombreux services exclusifs dans le domaine de la dermatologie : plus de 500 visuels de pathologies, des cas cliniques, des vidéos d’experts…
Bénéficiez d’options uniques telles que l’offre de contenus audio et de supports à proposer à vos patients.
Restez informé(e) des événements et des webinaires à venir, des dernières publications scientifiques et des innovations produit.