0 professionals
Atopie (Février 2022)
Atopie (Février 2022)
Améliorez vos connaissances professionnelles en profitant de nombreux services exclusifs dans le domaine de la dermatologie : plus de 500 visuels de pathologies, des cas cliniques, des vidéos d’experts…
Bénéficiez d’options uniques telles que l’offre de contenus audio et de supports à proposer à vos patients.
Restez informé(e) des événements et des webinaires à venir, des dernières publications scientifiques et des innovations produit.
Vous avez déjà un compte ? Se connecter
Orateurs : Carsten Flohr (Royaume Uni), Laurent Misery (France), Sandy Skotnicki (Canada)
Moderateur : Stéphane Fauverghe (France)
Sujets liés
D’après la communication du Pr Carsten Flohr, Londres
Compte-rendu rédigé par Rémi Maghia
De nouvelles thérapeutiques ciblées apparaissent dans la dermatite atopique (DA) : lebrikizumab, tralokinumab, dupilumab, némolizumab, omalizumab, inhibiteurs de JAK sélectifs.
Mais les traitements systémiques conventionnels resteront, pour une partie de notre pratique, en première ligne pour les DA sévères de l’adulte et de l’enfant : azathioprine, ciclosporine (homologation depuis plus de 16 ans), méthotrexate, mycophénolate mofétil.
Il y a peu d‘études en pédiatrie, surtout des séries de cas et des études cas-témoins. Dans les études, les données des patients pédiatriques ne sont souvent pas rapportées séparément.
La DA sévère est une maladie complexe, où interviennent des facteurs tels que : les infections cutanées, les allergies alimentaires, l’asthme et le rhume des foins, les perturbations du sommeil, l’anxiété et la dépression. Il existe un cercle vicieux prurit-grattage-inflammation cutanée.
Traiter la DA sévère nécessite souvent une approche multidisciplinaire, un travail d’équipe : dermato-pédiatre, allergologue pédiatrique, psychologue clinicien, pneumo-pédiatre, équipe de recherche clinique, programme d’éducation thérapeutique des patients.
Le dupilumab est homologué pour le traitement de la DA modérée à sévère chez les adultes et adolescents de 12 ans et plus candidats à une thérapie systémique. Ainsi que pour les enfants de 6 à 11 ans atteints de DA sévère qui sont candidats pour une thérapie systémique.
La conjonctivite associée au dupilumab
Elle est présente dans plus de 30% des cas dans les cohortes de vraie vie. Elle se manifeste par des sensations de corps étranger, brulures, prurit. Une hyperhémie du limbe est présente. Cet effet secondaire n’est pas observé dans les essais sur l’asthme et la polypose nasale.
Sa physiopathologie n’est pas encore claire. Le blocage simultané des voies de signalisation IL-4 et IL-13 pourrait entrainer une augmentation de l’activité des ligands impliqués dans la kératoconjonctivite atopique. Autre hypothèse : le demodex pourrait proliférer dans un environnement de cytokines oculaires réduites.
Cet effet secondaire est observé aussi dans les essais avec le lebrikizumab, mais pas avec le tralokinumab, ce qui tend à montrer qu’il n’est pas lié au blocage spécifique de l’IL-13.
Nous manquons d’essais face –face dans la DA pédiatrique sévère :
Tels que : traitement conventionnel vs conventionnel, conventionnel vs nouveau traitement, nouveaux traitements entre eux.
L’essai TREAT, mené dans le Royaume-Uni, concerne les enfants de 2 à 16 ans, méthotrexate vs ciclosporine A. L’étude est à présent complétée et sera publiée en 2022.
L’orateur dirige une NMA (network méta-analyse) en voie de publication dans le BMJ (1), visant à faire la revue systématique des traitements immunomodulateurs systémiques dans la DA. Les données combinent enfants et adultes, car dans la majorité des études les données pédiatriques ne sont pas reportées séparément. Les résultats de cette NMA ne sont pas encore publiés, aussi sans rentrer dans les détails, on peut dire pour la différence en terme d’EASI vs le dupilumab, font mieux : l’abrocitinib 2OOmg 1x/jour, et l’upadacitinib 15 et 30 mg 1x/jour. Ces 2 médicaments sont homologués à partir de 12 ans.
Pour ce qui est de l’abrocitinib, l’orateur a participé à une étude chez l’adolescent (12-17 ans) en combinaison avec traitement topique dans la DA modérée à sévère, publiée dans le JAMA Dermatology en 2021. 287 adolescents ont étés randomisés soit abrocitinib 200mg, soit abrocitinib 100 mg soit placebo, tous avec dermocorticoïdes. Dans les 2 groupes abrocitinib, environ 70% des patients ont atteint une réponse EASI 75, contre 40% dans le groupe placebo, ce qui est similaire aux résultats chez l’adulte.
Carsten Flohr dirige également le registre A-STAR (UK-Irish Atopic Eczema Systemic Therapy Resgister), dont le but est d’obtenir des données en vraie vie au long cours concernant l’efficacité et la tolérance des traitements systémiques de la DA, nouveaux et conventionnels.
Network meta-analysis by Drucker A, et al. Flohr C. JAMA Dermatology 2022 in press – www.eczematherapies.com
D’après la communication du Pr Laurent Misery, Brest, France
Compte rendu rédigé par le Dr Rémi Maghia, France
Le fardeau humain du prurit chronique dans les dermatoses inflammatoires est élevé. Ceci a été montré dans une étude européenne (JAAD 20218) ayant colligé 1552 patients avec différentes dermatoses prurigineuses (psoriasis 32%, DA 29%). Le prurit peut être ressenti avec des fréquences très élevées comme pénible, horrible, terrible, réfractaire, rendant agressif.
Le prurit est un défi
C’est le symptôme principal de la DA, sur les lésions et en dehors des lésions. Il est chronique et a un impact conséquent sur le sommeil, la cognition, l’apparence, le bien-être psychologique, la QDV, la vie sexuelle.
Le prurit est mal compris jusqu’à maintenant et les traitements sont décevants.
Les facteurs d’exacerbation du prurit sont nombreux : la chaleur, les vêtements (laine), l’insomnie, l’anxiété, la dépression, le cercle vicieux du grattage, la transpiration, l’inflammation, la sécheresse cutanée, la période nocturne.
Les prurirécepteurs
Ce sont des récepteurs spécifiques du prurit au niveau des terminaisons nerveuses de la peau (épidermiques et sous épidermiques). De nombreux récepteurs sont exprimés. A noter que le récepteur H1 à l’histamine en fait partie, alors qu’elle est assez peu impliquée dans le prurit de la DA. Via des médiateurs tels que des cytokines, des enzymes (protéases) ou des neuromédiateurs, ces récepteurs interagissent avec de nombreuses cellules (macrophages, kératinocytes, mastocytes, cellules T).
Dans la DA il existe de nombreux médiateurs pruritogènes : citons entre autres : kallikréine, tryptase, bradykinine, sérotonine, endothéline-1, IL-3, TSLP, Substance P, PAF, Artémine, IL-2, GRP, CGRP…
Le rôle du TSLP
Le TSLP est une cytokine produite par les kératinocytes dans l’épiderme, qui via les cellules dendritiques augmente la production par les cellules T de cytokines pro inflammatoires (voie Th2) telles que l’I-4. Le TSLP n’a pas d’action sur les voies Th1 ni Th17.
Sous l’effet de stimuli divers (orties, parasites, mastocytes), les protéases entrainent la production de PAR2 au sein des kératinocytes, entrainant le relargage de Ca2+. Il en résulte une libération de TSLP qui active les récepteurs TSLP-R au niveau des terminaisons des fibres afférentes C avec une dépolarisation de membrane. Un influx nerveux gagne la moelle épinière puis le cerveau, avec déclenchement du prurit.
Le rôle de l’IL-31
Les cellules Th2 sont la source de production d’IL-31, qui va entrainer une altération de la barrière cutanée, une action sur les éosinophiles, macrophages, basophiles et mastocytes dermiques. Il va en résulter une inflammation dermique, une élongation nerveuse (augmentation de croissance neuronale et de densité des terminaisons nerveuses) et le prurit.
Le rôle de l’IL-4 et de l’IL-13
L’IL-4 et l’IL-13 activent directement les neurones sensitifs. L’IL-4 augmente la réponse neuronale à différents pruritogènes. JAK1 est impliqué.
La sensibilisation au prurit
En cas de prurit chronique, la stimulation périphérique épidermique via les prurirécepteurs entraîne une activation du système nerveux central. La chronicité de la stimulation du système nerveux périphérique et central finit par conduire à la sensibilisation au prurit, avec des phénomènes tels que l’alloknésie (perception comme prurigineuses de sensations qui ne le sont pas habituellement) et l’hyperknésie (sensation exacerbée de prurit dans une zone topographique adjacente à celle grattée).
Altération de la barrière cutanée et prurit
L’altération de la barrière entraine un contact plus étroit entre les terminaisons nerveuses et le milieu extérieur.
Sous l’effet de l’altération de la barrière ou de l’inflammation, les cellules cutanées et immunes peuvent relarguer des médiateurs qui peuvent activer les prurirécepteurs sur les terminaisons nerveuses des fibres C.
Les cibles pour améliorer le prurit sont nombreuses
NGF : pegcantranib
TRPV1 : capsaïcine
TRPM8 : menthol, menthoxypropanediol
IL-4, IL-13 : dupilumab, lebrikizumab
IL-31 : némolizumab
IL-33
NK1 : aprépitant, serlopitant, tradipitant
PDE4 : aprémilast, crisaborole, difamilast, lotamilast
CB1/CB2 ; cannabinoïdes
KOR : difélikéfaline, nalbuphine, nalfurafine
MOR : naloxone, naltrexone
JAK : baracitinib, delgocitinib, tofacitinib, upadacitinib
Une prise de position sur la prise en charge du prurit et de la douleur dans la DA est parue dans le JEADV 2021
1ère étape, souvent suffisante : traitement de la DA, émollients, éducation thérapeutique, support psychologique.
Si persistance du prurit : ciclosporine, dupilumab, némolizumab, gabapentinoïdes, anti dépresseurs, anti-JAK, anti-PDE4, k-opioïdes, anti-NK1.
Si persistance de la douleur : analgésiques communs, gabapentinoïdes, anti dépresseurs, anti-JAK, anti-PDE4, µ-opioïdes.
Le prurit est la préoccupation majeure des patients avec une DA, ainsi que de leur famille.
La recherche sur le prurit (en particulier dans la DA) fournit de nombreuses cibles thérapeutiques.
Les émollients sont utiles à la fois pour lutter contre la sécheresse et pour le soulagement du prurit.
D’après la communication du Dr Sandy Skotnicki, Université de Toronto, Canada
Compte rendu rédigé par le Dr Rémi Maghia, France
La barrière cutanée
Elle limite la perte trans-épidermique en eau (TEWL), empêche la dessiccation, protège des agressions externes.
Elle est composée d’un réseau dense d’agrégats de filaments de kératine intra cellulaire, du film hydrolipidique, du ciment lipidique intercellulaire, des tight junctions.
Dans la dermatite atopique (DA) il y a une déficience des protéines de la barrière, une déficience en lipides, un pH de surface modifié, une dysbiose bactérienne cutanée, une altération de la réponse immune.
Les conséquences en sont : une pénétration facilitée des allergènes dans la peau, la réduction du NMF, une augmentation du TEWL, entrainant l’inflammation cutanée.
Importance des émollients dans la thérapeutique
Les émollients sont inclus dans les recommandations européennes : ils doivent être utilisés en quantité adéquate, avec une bonne fréquence, et avec une teneur en lipide plus importante en hiver. Dans la DA modérée à sévère cela permet une épargne cortisonique, mais il est nécessaire en premier lieu d’obtenir une rémission par les topiques dermocorticoïdes ou inhibiteurs de calcineurine. Ceci est valable dans les recommandations européennes pour les adultes et les enfants. De même dans les recommandations US, avec le conseil d’appliquer ces émollients peu après le bain.
Les émollients doivent être utilisés quotidiennement. Les quantités doivent être appropriées et elles sont importantes :
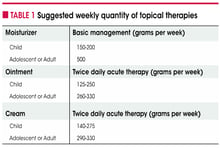 Off
Off
D’après Fleischer et al. Atopic dermatitis: skin care and topical therapies. Semin Cutan Med Surg. 36: 104-110.
Dans la DA on observe fréquemment un défaut de compliance : 2 patients sur 3 ne sont pas compliants avec leur traitement topique, et 1 patient sur 2 utilise une quantité d’émollients inférieure à la quantité recommandée.
Quels ingrédients dans ces émollients ?
Les ingrédients d’utilité sont par exemple : céramides, cholestérol, phytosphingosine (constituant naturel des céramides), acides gras essentiels, avoine colloïdal.
Lesquels choisir ?
Il faut combiner : efficacité, tolérance, absence de sensations de brûlures ou de picotements, et confort d’utilisation pour assurer la compliance et des résultats à long terme.
L’exemple d’Atoderm Intensive Baume* de Bioderma*
Le Complexe Lipigenium* comprend une phytosphingosine pure, des lipides biomimétiques, qui contribuent à la restauration de la barrière notamment lipidique.
L’enoxolone apporte une action anti inflammatoire et anti prurigineuse et réduit l’expression du TSLP au sein de l’épiderme atopique.
Le PEA (PalmitoylEthanolAmide) topique présente une action anti prurigineuse.
Une étude en double aveugle randomisée contre placebo chez 130 sujets atteints de DA modérée âgés de 6 mois à 15 ans, a comparé un traitement avec dermocorticoïdes ou tacrolimus topique, associé soit au Baume Atoderm Intensive* soit à un émollient faisant office de placebo pendant 6 mois.
Sans rentrer dans les détails de l’étude, les différences étaient constamment significatives en faveur du Baume Atoderm Intensive* vs placebo, que ce soit pour la diminution du SCORAD constatée par les médecins, ou constatée par les patients, et en terme d’amélioration de la QDV. 76% des patients traités avec le Baume n’ont pas présenté de rechute à 6 mois, et ont eu 20 jours de plus sans rechute vs ceux sous placebo. 94% des patients ont eu une diminution de l’urgence à se gratter et 88% ont eu un arrêt durable du prurit.

Le professeur Carsten FLOHR est titulaire de la chaire de dermatologie et de sciences de la santé des populations au St John's Institute of Dermatology, King's College London, où il dirige l'unité de recherche en dermatologie basée sur la population. Il a étudié aux universités de Cambridge et d'Oxford, puis s'est formé à la fois en pédiatrie et en dermatologie.
Carsten FLOHR a été le premier chercheur clinicien en dermatologie du National Institute for Health Research (NIHR) du Royaume-Uni (2009-2014) et le seul dermatologue à avoir reçu une bourse de développement de carrière du NIHR (2014-2019). Il s'intéresse particulièrement aux nouvelles méthodes de prévention de la dermatite atopique (DA) (facteurs de risque en début de vie) et aux thérapeutiques, en particulier dans la MA sévère.
Il est l'investigateur en chef de l'étude anglo-irlandaise sur le traitement de l'eczéma sévère chez les enfants (TREAT), qui compare la cyclosporine au méthotrexate chez les enfants atteints d'eczéma atopique récalcitrant. Il est également chercheur en chef de l'essai sur l'eau adoucie pour la prévention de l'eczéma (SOFTER) et du registre britannique-irlandais de thérapie systémique de l'eczéma atopique (A-STAR), ainsi que des consortiums BIOMAP et Trans-Foods financés par l'UE.
Le professeur FLOHR est directeur fondateur de l'International Eczema Council et ancien président de la British Society of Pediatric Dermatology, ainsi que membre honoraire de la Société française de dermatologie. Il est également rédacteur fondateur de la section Evidence-Based Dermatology du British Journal of Dermatology et rédacteur des essais cliniques de la section F1000 Atopic Dermatitis.
Dermatite atopique pédiatrique complexe : coup de projecteur sur les thérapies systémiques - Carsten Flohr (Royaume-Uni)

Après des études et ses premières années professionnelles à Lyon et Saint Etienne, Laurent MISERY devient professeur de Dermatologie à l'Université de Brest.
Il est aujourd'hui chef du service de Dermatologie au CHU de Brest. Laurent MISERY a fondé et dirige le Laboratoire sur les Interactions Neurones-Kératinocytes (LINK) et le Centre Expert Français des Démangeaisons. Son équipe se consacre à la recherche translationnelle sur les démangeaisons, des aspects fondamentaux (biologiques et physiologiques) aux aspects physiopathologiques, cliniques, psychologiques et thérapeutiques.
Il s'intéresse particulièrement aux relations entre la peau et le système nerveux, du point de vue biologique (co-cultures entre cellules cutanées et neurones) au point de vue clinique (prurit, peau sensible) ou psychologique.
Le Pr MISERY est président du groupe de travail EADV sur la psychodermatologie. Ses intérêts de recherche sont : la peau sensible ; irritation de la peau; irritant; sensibilité; produits de soins de la peau. Il a été distingué par le prix Herman Musaph en 2017.
Dermatite atopique : derrière les démangeaisons - Laurent Misery (France)

Le Dr Sandy SKOTNICKI est le directeur fondateur du Bay Dermatology Centre et est professeur adjoint à l'Université de Toronto, Département de médecine dans les divisions de dermatologie et de santé au travail et environnementale.
Le Dr SKOTNICKI a lancé le Bay Dermatology Center en 2006 dans le but de fournir un centre de dermatologie à service complet qui se concentre sur le patient et non sur les procédures. Elle est diplomate de l'American Board of Dermatology et membre de l'Association médicale canadienne, de l'Association canadienne de dermatologie, de l'American Dermatology Association et de l'American Contact Dermatitis Society.
Le Dr SKOTNICKI est dermatologue consultant au St. Michael's Hospital de Toronto et est un expert des maladies allergiques cutanées. Elle est également consultante pour la Commission de l'assurance contre les accidents du travail. Active dans la recherche et l'éducation, la Dre SKOTNICKI enseigne aux résidents en dermatologie, en allergie et en médecine familiale de l'Université de Toronto à sa clinique de l'hôpital St. Michael's depuis 1999. Elle est également membre du Centre d'expertise en recherche sur les maladies professionnelles et a publié de nombreux articles sur différents aspects de la maladie allergique cutanée.
Largement considérée comme la dermatologue incontournable au Canada pour les réactions et la sécurité des ingrédients, elle fournit régulièrement des commentaires et contribue aux revues médicales, aux médias et parle des réactions aux produits chimiques dans l'industrie des soins de la peau.
Le rôle des soins de la peau dans la prise en charge de l'atopie : impact sur la barrière cutanée - Sandy Skotnicki (Canada)