6 professionals
Bioderma Congress Reports JDP 2025
Bioderma Congress Reports JDP 2025
Améliorez vos connaissances professionnelles en profitant de nombreux services exclusifs dans le domaine de la dermatologie : plus de 500 visuels de pathologies, des cas cliniques, des vidéos d’experts…
Bénéficiez d’options uniques telles que l’offre de contenus audio et de supports à proposer à vos patients.
Restez informé(e) des événements et des webinaires à venir, des dernières publications scientifiques et des innovations produit.
Vous avez déjà un compte ? Se connecter
Rapports écrits par Déborah Salik (dermatologue, Belgique), Nicolas Kluger (dermatologue, Finlande) et Ibrahima Traoré (dermatologue, Guinée), Joël Claveau (dermatologue, Québec), Laura Boix (dermatologue, Guyane), Margaux BONHOMME (dermatologue, St Etienne)

Sujets liés
Rapport rédigé par Déborah Salik (dermatologue, Belgique)
Président : Yvon Perrillat (France)
Intervenant·e(s) : Yvon Perrillat (France), Thierry Fusade (France), Samy Fenniche (France), Kawtar Zouhair (Maroc), Nathalie Gral (France), Sabrina Fourcade Roch (France)
Introduction
Cet atelier pratique avait pour but d'initier les participants aux différentes technologies laser. Chaque participant a pu se familiariser avec leur fonctionnement, a pu manipuler les appareils en conditions réelles et maîtriser les règles de sécurité essentielles pour une utilisation quotidienne.
Techniques et sécurité
La séance a commencé par un rappel des consignes essentielles de sécurité. L'utilisation des lasers en dermatologie nécessite de porter des lunettes de protection spécifiques, adaptées à la longueur d'onde du laser utilisé. Pour le patient, il est fortement recommandé d'utiliser des coques oculaires pour prévenir tout risque d'erreur relatif au type de lunette.
Lasers vasculaires et lumière pulsée (IPL) :
Le laser colorant pulsé (LCP) opère à une longueur d’onde de 595 nm, qui correspond au spectre d'absorption de l'hémoglobine. Il peut être couplé à un laser YAG pour une dualité d'action. Ses indications principales sont l'angiome plan (visage, tronc, membres), la rosacée, la poïkilodermie de Civatte et les angiomes stellaires. Il peut être utilisé chez le nourrisson.
D'autres systèmes vasculaires existent :
Laser CO2 : Le laser CO2 est un outil ablatif puissant opérant à 10600 nm. L'Ultra Pulse peut atteindre 4 mm de profondeur et est utilisé pour les cicatrices, le resurfaçage du visage et le traitement des condylomes. Le système Déka combine un laser CO2 ablatif (10600 nm) avec un laser fractionné non ablatif (1540 nm) afin d'éviter l'hyperpigmentation post-inflammatoire, notamment pour le resurfaçage des cicatrices atrophiques.
Lasers pigmentaires : Ils traitent les lésions pigmentaires et le détatouage. Les systèmes Q-Switched utilisent des longueurs d’onde de 1064 nm (infrarouge, pour des lésions profondes comme le nævus d'Ôta) et à 532 nm (pic d'absorption de la mélanine, possible jusqu'au phototype IV).
AviClear : Un laser innovant traitant l’acné inflammatoire à une longueur d’onde de 1726 nm. Il agit directement sur les glandes sébacées, provoquant leur atrophie et réduisant la sécrétion de sébum.
Lasers épilatoires : L'Alexandrite et le Nd:YAG sont les plus utilisés. Ces types de laser sont également indiqués pour des affections comme le kyste pilonidal ou la maladie de Verneuil.
Rapport rédigé par Déborah Salik (dermatologue, Belgique)
Président : Henri Adamski (France)
Intervenant·e(s) : Henri Adamski (France), Martine Avenel-Audran (France), Chistophe Bedane (France), Christelle Comte (France), François Aubin (France), Laurent Meunier (France), ManuelleViguier (France), Jean-Claude Béani (France)
Le rayonnement solaire : composition
Rapport rédigé par Déborah Salik (dermatologue, Belgique)
Intervenant·e : Henri Adamski (France)
Le rayonnement solaire se compose des UVA et des UVB (7%), mais inclut également la lumière visible (40%) et les infrarouges (53%).
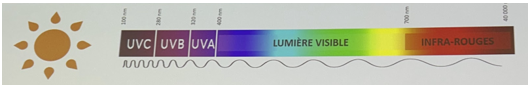
Caractéristiques des rayonnements
Les effets du spectre solaire sur la peau
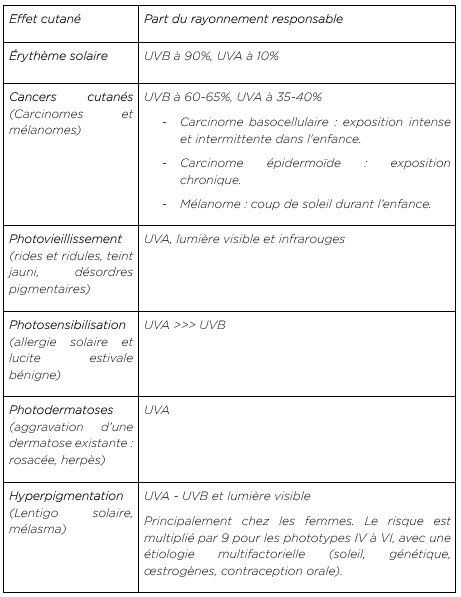
Effets bénéfiques
L'exposition solaire a des effets positifs sur la dépression saisonnière et également sur la synthèse de vitamine D (par les UVB).
La quantité d’UV nécessaire à la synthèse de vitamine D est très faible. En effet, selon la littérature, un enfant caucasien habillé, exposant uniquement ses mains et son visage, requière une exposition de 30 minutes à 2 heures par semaine pour une synthèse adéquate de vitamine D. Pour l’adulte, on évoque une exposition de 5 minutes/jour 3 fois par semaine pour un phototype claire et 10 minutes pour un phototype foncé (PMID : 16164370). L'utilisation d'une protection solaire adéquate ne modifie pas le statut en vitamine D des patients, à l'inverse de leurs habitudes d'exposition (recherche d’ombre, habillement).
Les recommandations de l’AFSSAPS relatives aux produits antisolaires imposent qu’un antisolaire répondre à 3 critères : la rémanence, la photostabilité et la protection vis-à-vis de tous les effets délétères des UVs.
Rapport rédigé par Déborah Salik (dermatologue, Belgique)
Intervenant : Bertrand Richert
Le Professeur Richert a fait un exposé de ses plus beaux cas des 35 dernières années.
L’onychopapillome
Diagnostics les plus fréquents des altérations unguéales de l’enfant (PMID: 30835872)
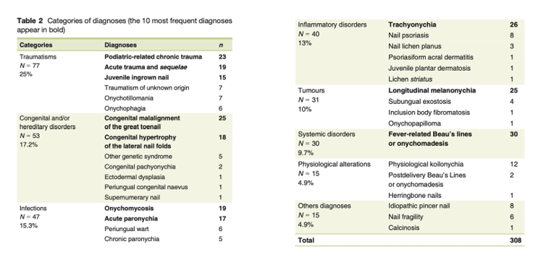
Les pathologies unguéales de l’enfant sont généralement bénignes et souvent auto-résolutives.
Syndrome d’Iso Kikuchi
L’onychoostéodysplasie congénitale des index (MIM605779), ou syndrome d’Iso-Kikuchi, correspond à l’association d’une anomalie de l’ongle des index révélant une particularité osseuse sous-jacente. Des critères diagnostiques ont été décrits : brachymétacarpie et/ou brachydactylie congénitale, hypoplasie, uni- ou bilatérale, de l’index et onychodysplasie d’aspect variable. La radiologie permet de confirmer le diagnostic en montrant une bifurcation en “Y” et une hypoplasie de la phalange distale du doigt concerné.
Différentes hypothèses physiopathologiques ont été proposées : iatrogènes (anticonvulsivants durant la grossesse), vasculaires (lésions ischémiques in utero des artérioles issues de l’artère radiale), ou des altérations de l’ostéogenèse. Aucune n’a pu être confirmée. Plusieurs cas familiaux ont été rapportés, suggérant la transmission autosomique dominante d’une maladie mendélienne monogénique, mais aucun gène à l’heure actuel n’est décrit.
Carcinome épidermoïde
Onychomatricome
Rétronychie
Rapport rédigé par Déborah Salik (dermatologue, Belgique)
Président(s) : Laura Fertitta (France)
Intervenant·e(s) : Laura Fertitta (France), Aranaud Jannic (France), Sébastien Barbarot (France), Pierre Wolkenstein (France), Mona Amini-Adle (France)
Neurofibromes sous-cutanés et diagnostic différentiel
Intervenant : Sébastien Barbarot (France)
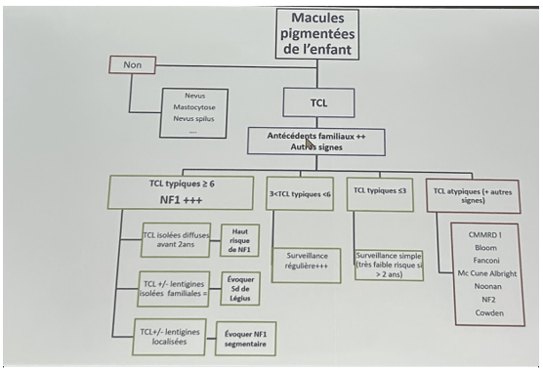
Il faut se poser 6 questions devant les taches café au lait (TCL)
Algorithme de prise en charge des TCL de l’enfant :
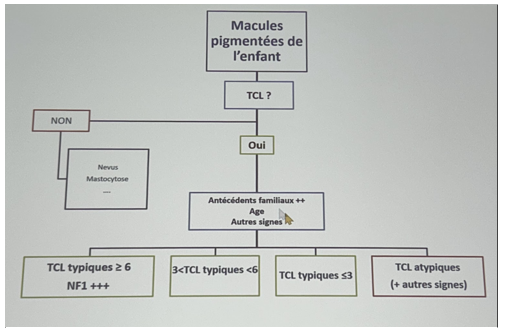
Les patients atteints de 3 TCL représentent 20% de la population.
Diagnostics différentiels des TCL :
La TCL évocatrice de la NF1 est une macule arrondie ovalaire à bordure nette, épargnant l’extrémité céphalique. Les lésions sont généralement présentes à la naissance et les lentigines s’ajoutent vers l’âge de 2-3 ans. Les neurofibromes (NF) apparaissent plus tardivement et sont très polymorphes. Ils sont soit superficiels, maculo-papuleux avec une atrophie cutanée ou ils sont sous-cutanés ; ils forment alors des petits nodules fermes suivant les trajets nerveux. Leur présence constitue un facteur de mauvais pronostic et de présence de neurofibromes internes.
Les grandes taches café au lait peuvent devenir progressivement pileuses et peuvent être associées à la présence de NF plexiformes. Les NF plexiformes peuvent aussi être atrophiques mais c’est une présentation clinique plus rare.
Il existe aussi une présentation segmentaire de la NF1, qui correspond à un phénomène de mosaïcisme de type 1, soit une mutation post zygotique, soit de type 2, basée sur la théorie du second hit.
Il peut exister d’autres signes cliniques associés :
Les autres pathologies avec TCL :
Noonan syndrome non PTPN11
Syndrome de Bloom : scoliose, chéilite chronique, érythème du visage (photosensibilité), télangiectasies en ailes de papillon
Syndrome de TURCOT: Childhood constitutional Mismatch repair deficiency
En résumé :
Complications de la NF1
Intervenante : Laura Fertitta (France)
La NF1 est une pathologie multisystémique dont les complications diffèrent en fonction de l’âge.
Chez l’enfant :
2. Complications neurodéveloppementales
3. Complications osseuses
4. Complications staturo-pondérales
5. Complications cardio-vasculaires : HTA
Chez l’adulte
2. Dépistage de l’HTA
3. Déminéralisation osseuse
4. Particularité de la grossesse
5. Risque de cancers
Prise en charge des NF plexiformes
Intervenante : Mona Amini-Adle (France)
Les NF plexiformes
Étude SPRINT : Sélumetinib
Mirdametinib
Il existe une toxicité cutanéo-muqueuse des anti-mek avec de l’acné, paronychie et périonyxis, aphtes et des ulcérations de la muqueuse buccale.
Rapports rédigés par Ibrahima Traoré (dermatologue, Guinée)
Présidente : Fatimata Ly (Sénégal)
Intervenant·e·s : Fatimata Ly (Sénégal), Mariem Kebe Dia (Mauritanie), Mame Thierno Dieng (Sénégal)
Dépigmentation cosmétique volontaire (DCV) : Historique et motivations
Intervenant : Mame Thierno Dieng (Sénégal)
Mame Thierno Dieng a introduit la problématique de la DCV en retraçant brièvement son évolution historique et ses racines socioculturelles. Il a expliqué comment cette pratique, initialement limitée à certains groupes sociaux, s’est progressivement diffusée dans de nombreux pays d’Afrique subsaharienne.
Points essentiels
Pr Dieng a insisté sur la nécessité de comprendre les motivations profondes pour mieux orienter la prévention et les stratégies de prise en charge, qui doivent intégrer un volet éducatif et socioculturel.
Complications infectieuses de la dépigmentation cosmétique volontaire
Intervenante : Mariem Kébé Dia (Mauritanie)
Mariam Kébé Dia a abordé les complications infectieuses liées à la DCV, en mettant l’accent sur l’immunosuppression cutanée induite par l’usage prolongé de corticoïdes et autres agents dépigmentants.
Points essentiels
Pr Kébé Dia a rappelé que la prise en charge doit combiner traitement anti-infectieux, arrêt des produits dépigmentants dangereux et éducation sur les risques de ces pratiques.
Complications non infectieuses de la dépigmentation cosmétique volontaire
Intervenante : Fatimata Ly (Sénégal)
Fatimata Ly a présenté les complications non infectieuses, souvent sévères et largement sous-estimées, en illustrant particulièrement les risques carcinologiques.
Points essentiels
Pr Ly a souligné l’urgence de renforcer la régulation des produits dépigmentants, d’améliorer la sensibilisation communautaire et de développer des stratégies de prise en charge adaptées, incluant un suivi dermatologique rigoureux.
Dermatologie sur peau noire : des images pour y voir plus clair
Présidente : Émilie Baubion (CHU Martinique)
Intervenantes : Émilie Baubion (CHU de Martinique), Emmanuelle Amazan (CHU de Martinique), Gladys Ferrati-Fidelin (CHU de Martinique)
Les trois intervenantes ont proposé une formation entièrement centrée sur l’imagerie clinique, destinée à améliorer la reconnaissance des dermatoses sur peau noire, domaine encore peu représenté dans la littérature dermatologique classique. Plutôt qu’un enseignement théorique traditionnel, elles ont opté pour une approche interactive basée sur la projection et le commentaire de nombreuses photographies cliniques, favorisant l’apprentissage visuel et l’analyse diagnostique.
L’objectif principal était d’améliorer la compétence diagnostique face aux multiples présentations cliniques dermatologiques observées sur peau foncée. Les intervenantes ont illustré :
Un objectif secondaire consistait à rappeler les particularités thérapeutiques éventuelles lorsque ces maladies surviennent sur peau noire, notamment en cas de risque accru de dyschromies post-inflammatoires.
Points essentiels
La session a permis aux participants d'améliorer nettement leur capacité à reconnaître les dermatoses sur peau noire grâce à la grande variété d’exemples cliniques. Les intervenantes ont démontré la nécessité d’une formation spécifique pour ce phototype, et ont permis aux dermatologues présents de gagner en assurance diagnostique et en pertinence thérapeutique.
Rapport rédigé par Joël Claveau (dermatologue, Québec)
Intervenant·e(s) : Docteur Marina Alexandre, docteur Christelle Le Roux-Villet et docteur Ishai Yaacov Sitbon de l’Hôpital Avicenne de Bobigny, France.
Introduction et définitions
Les maladies bulleuses auto-immunes (MBAI) sont des dermatoses rares mais potentiellement sévères, caractérisées par des bulles et érosions cutanéo-muqueuses induites par des auto-anticorps dirigés contre des protéines d’adhérence. Elles surviennent surtout chez le sujet âgé, avec une incidence croissante liée au vieillissement de la population. Le mécanisme central est un clivage tissulaire entraînant une perte d’adhérence soit inter-kératinocytaire (pemphigus), soit à l’interface dermo-épidermique (pemphigoïdes et affections apparentées). Cette réponse auto-immune entraîne des lésions chroniques, parfois compliquées de cicatrices et de séquelles fonctionnelles. Le diagnostic repose sur une approche intégrée combinant clinique, histologie et immunopathologie. La prise en charge doit être individualisée selon l’entité, l’étendue et les comorbidités.
Classification et principes anatomopathologiques
Les MBAI se répartissent en deux catégories selon le niveau de clivage. Les formes intra-épidermiques, dominées par les pemphigus, impliquent des anticorps IgG dirigés contre les desmosomes (Desmoglein 1 et 3), provoquant une acantholyse et des bulles flasques. Les formes sous-épidermiques regroupent les pemphigoïdes et affections connexes, avec des anticorps contre BP180 (collagène XVII), BP230 ou le collagène VII, responsables de bulles tendues. La pemphigoïde bulleuse représente environ 66 % des MBAI, suivie par la pemphigoïde cicatricielle, l’épidermolyse bulleuse acquise (EBA) et la maladie à IgA linéaire. Cette distinction morphologique est essentielle pour orienter le diagnostic et le traitement.
Phénotypes cliniques
Les pemphigus se présentent par des bulles flasques laissant des érosions douloureuses, souvent muqueuses (buccales, pharyngées). La pemphigoïde bulleuse touche surtout les sujets âgés (>70 ans) et se traduit par des bulles tendues sur fond urticarien, prédominant sur les zones de frottement (coudes, genoux, dos des mains et pieds), avec prurit marqué. La pemphigoïde cicatricielle affecte principalement les muqueuses buccales, oculaires et ORL, exposant à des synéchies et sténoses sévères pouvant compromettre la vision ou la respiration. L’EBA entraîne des bulles tendues et cicatrices atrophiques, parfois avec grains de milium. La maladie à IgA linéaire présente des bulles en collerettes, souvent prurigineuses, et peut être pédiatrique ou médicamenteuse. Certaines formes sont associées à des maladies systémiques (lupus bulleux, dermatite herpétiforme).
Démarche diagnostique
Le diagnostic repose sur l’examen clinique, l’histologie et l’immunopathologie. La biopsie en bord de lésion récente permet d’identifier le niveau de clivage : intra-épidermique avec acantholyse dans les pemphigus, sous-épidermique dans les pemphigoïdes et l’EBA. L’immunofluorescence directe révèle des dépôts en résille intercellulaire (pemphigus) ou linéaires à la membrane basale (pemphigoïdes). L’immunofluorescence indirecte et les tests ELISA permettent de détecter des anticorps spécifiques : anti-Desmoglein 1/3, anti-BP180/BP230, anti-collagène VII. La technique du salt-split skin distingue l’EBA (dépôts côté dermique) des pemphigoïdes (côté épidermique). L’immunoblot et l’immunoprécipitation peuvent être utiles dans les formes atypiques.
Principales entités et prise en charge
La pemphigoïde bulleuse, la plus fréquente, se traite par dermocorticoïdes puissants, associés si besoin à la doxycycline; les formes sévères peuvent nécessiter méthotrexate ou biothérapies (omalizumab). La pemphigoïde cicatricielle impose une stratégie agressive avec dapsone ou sulfasalazine, et immunosuppresseurs ou rituximab dans les formes graves. L’EBA, liée à des anticorps anti-collagène VII, est plus résistante et peut nécessiter dapsone, colchicine ou immunosuppresseurs. Le pemphigus vulgaire est traité par corticoïdes systémiques associés à rituximab, devenu le standard. La maladie à IgA linéaire répond bien à la dapsone.
Pronostic et suivi
Le pronostic varie selon l’entité et l’âge. La pemphigoïde bulleuse est potentiellement sévère en raison des comorbidités et du risque iatrogène, mais un contrôle efficace est possible avec des approches graduées. Les pemphigus bénéficient des biothérapies (rituximab), réduisant les rechutes et l’exposition prolongée aux corticoïdes. Les formes muqueuses cicatricielles et l’EBA présentent un risque accru de séquelles fonctionnelles; une prise en charge précoce et multidisciplinaire est essentielle. Le suivi inclut l’évaluation clinique, la tolérance des traitements et l’éducation du patient.
Conclusion
Les maladies bulleuses auto-immunes reposent sur une classification selon le niveau de clivage et la nature des antigènes cibles. Le diagnostic combine clinique, histologie et immunologie. La prise en charge doit être individualisée, avec une surveillance étroite pour prévenir les séquelles et optimiser la qualité de vie.
Rapport rédigé par Joël Claveau (dermatologue, Québec)
Intervenant·e(s) : Docteurs Vincent Sibaud, Sarah Baali, Céline Pagès-Laurent et Valentine Théret, CHU de Toulouse, France
Introduction
La conférence « Être un dermatologue efficace en milieu oncologique », présentée lors des Journées Dermatologiques de Paris en décembre 2025, a mis en lumière le rôle crucial du dermatologue dans la prise en charge des patients atteints de cancer. À travers une série de diapositives illustrées et documentées, les intervenants ont souligné l’importance de la collaboration interdisciplinaire, de la surveillance des effets secondaires cutanés des traitements oncologiques et de l’adaptation thérapeutique en fonction du profil oncologique du patient.
Surveillance des lésions vasculaires atypiques
Les lésions vasculaires atypiques, notamment dans le contexte post-radiothérapie, peuvent évoluer vers des angiosarcomes. L’analyse anatomopathologique systématique, incluant l’amplification de la protéine c-MYC (par IHC et FISH), est essentielle pour distinguer ces lésions. Bien que très discriminante, cette analyse peut présenter des faux négatifs. Une surveillance active est recommandée, en particulier pour les lésions pouvant précéder un angiosarcome. D’autres sarcomes comme le léiomyosarcome ou l’ostéosarcome doivent également être envisagés dans le diagnostic différentiel.
Prurit et exanthème maculopapuleux
Le prurit est une manifestation fréquente des traitements par anti-PD-1/PD-L1. Il peut s’accompagner d’exanthèmes maculopapuleux, souvent localisés au tronc et aux extrémités. Histologiquement, ces lésions présentent des caractéristiques eczématiformes avec spongiose et infiltrat lymphocytaire périvasculaire. Le prurit peut être intense et nécessite une prise en charge symptomatique adaptée (diminuer irritants, hydratation, corticoïdes topiques, antihistaminiques et parfois une médication comme le dupilumab).
Psoriasis et immunothérapie
L’immunothérapie, notamment les inhibiteurs de points de contrôle immunitaire (ICI), peut induire ou exacerber le psoriasis. Les formes les plus fréquentes sont le psoriasis vulgaire, suivi des formes palmoplantaire, unguéale et en gouttes. Une prise en charge adaptée est nécessaire, tenant compte du type de cancer, du temps écoulé depuis l’initiation de l’ICI, de la sévérité du psoriasis et des comorbidités. Les agents systémiques comme les inhibiteurs IL-23, IL-17, PDE4 et les rétinoïdes sont préférés pour leur faible impact sur l’efficacité des ICI.
Manifestations dermatologiques variées des inhibiteurs des points de contrôle
La diversité des réactions cutanées liées aux inhibiteurs des points de contrôle est vaste : lichen plan, granulome annulaire, sarcoïdose cutanée, kératose actinique inflammatoire, rosacée, vasculite, lichen scléreux, lipodystrophie, etc. Ces manifestations nécessitent une expertise dermatologique pour une reconnaissance rapide et une gestion appropriée.
Sarcoïdose et traitements ciblés
La sarcoïdose peut aussi survenir sous traitement par inhibiteurs BRAF/MEK, avec une atteinte cutanée prédominante (érythème noueux, nodules). L’atteinte médiastinale est fréquente, et une évaluation cardiologique est souvent indiquée. Une forme cutanée isolée est observée dans 10 % des cas.
Toxicité dermatologique des thérapies ciblées
Les anticorps glycoconjugués comme l’enfortumab vedotin ciblent la nectine-4, exprimée dans les kératinocytes. Leur toxicité dermatologique est quasi systématique. De même, les inhibiteurs de BTK (ibrutinib, acalabrutinib, zanubrutinib) peuvent induire des hématomes, folliculites, panniculites et infections cutanées. Ces effets sont liés à l’inhibition directe de BTK et d’autres kinases off-target.
Rôle de l’oncodermatologue
La gestion dermatologique des patients oncologiques, appelée « supportive oncodermatology », inclut la prévention, la détection précoce et le traitement des toxicités cutanées induites par les traitements anticancéreux. Elle englobe également la prise en charge des infections cutanées, des syndromes paranéoplasiques et des manifestations spécifiques. Le dermatologue joue un rôle essentiel dans le parcours de soins oncologiques.
Conclusion
Être un dermatologue efficace en milieu oncologique implique une connaissance approfondie des effets secondaires cutanés des traitements anticancéreux, une capacité à collaborer avec les oncologues, et une vigilance constante pour adapter les traitements dermatologiques sans compromettre l’efficacité oncologique. Cette conférence a souligné l’importance stratégique du dermatologue dans l’optimisation de la qualité de vie et du pronostic des patients atteints de cancer.
Rapport rédigé par Joël Claveau (dermatologue, Québec)
Intervenant·e(s) :
Photoprotection et Vitamine D
Pr Christophe Bédane du CHU de Dijon, France
La photoprotection, qu’elle soit naturelle ou artificielle, constitue un élément central de la prévention dermatologique. La peau dispose de mécanismes intrinsèques — couche cornée, film hydrolipidique, mélanine, épaississement progressif — qui limitent les effets délétères des UV. L’érythème solaire, principalement induit par les UVB, représente un signal d’alerte biologique. Le bronzage, quant à lui, résulte surtout des UVA et participe à une photoprotection secondaire.
Synthèse de la vitamine D
La production cutanée de vitamine D dépend essentiellement des UVB. Une dose érythémale minimale peut générer jusqu’à 20 000 UI de vitamine D. Cette synthèse varie selon des facteurs individuels (âge, phototype, comportement solaire) et environnementaux (latitude, saison, pollution). La conversion du 7-déhydrocholestérol en vitamine D3, puis en calcidiol et calcitriol, est modulée par ces paramètres.
Impact des écrans solaires
Contrairement à une idée répandue, l’usage normal des écrans solaires n’entraîne pas de déficit en vitamine D. Les formulations modernes, équilibrées entre UVA et UVB, permettent une synthèse suffisante tout en prévenant les coups de soleil. Les habitudes d’exposition jouent un rôle bien plus déterminant que les filtres eux-mêmes.
Photoprotection physique et comportementale
Les vêtements anti-UV, initialement développés en Australie, ont démontré leur efficacité, notamment dans la prévention de nouveaux nævi chez l’enfant. Leur performance dépend du tissage, de la couleur, de la fibre et de l’humidité. L’éducation des familles reste un pilier majeur : connaître les risques, adapter les comportements, éviter les heures les plus intenses et privilégier l’ombre.
Rôle des antioxydants naturels
La peau possède des systèmes antioxydants (vitamines C et E, glutathion, caroténoïdes, acide urocanique) qui neutralisent les espèces réactives de l’oxygène (ERO) générées par les UV. Les infrarouges du matin pourraient même renforcer les mécanismes de réparation de l’ADN. En conclusion, cette présentation a rappelé que photoprotection et synthèse de vitamine D ne sont pas incompatibles, et que l’éducation solaire reste la pierre angulaire d’une prévention durable.
Antioxydants et Photoprotection
Dr Marie Thérèse Leccia, CHU de Grenoble, France
La photoprotection antioxydante constitue une stratégie complémentaire essentielle. Les UVB et UVA induisent des dommages directs et indirects via la formation d’ERO, responsables d’altérations de l’ADN, des lipides et des protéines. Les antioxydants, endogènes ou apportés par voie externe, limitent ces effets en maintenant l’équilibre redox.
Systèmes antioxydants cutanés
La peau dispose d’un arsenal complexe : vitamines C et E, ubiquinol, glutathion, zinc, sélénium, caroténoïdes. Ces molécules agissent en synergie, mais leur concentration chute rapidement sous UV, justifiant l’intérêt d’un apport externe.
Données cliniques
L’étude SU.VI.MAX a montré une réduction de l’incidence des cancers cutanés chez les hommes supplémentés. Toutefois, des doses excessives peuvent devenir pro oxydantes, inhiber l’apoptose et favoriser des états prénéoplasiques. La nicotinamide (vitamine B3) a démontré une efficacité notable dans la prévention des kératoses actiniques et des carcinomes épidermoïdes, en particulier chez les sujets immunocompétents.
Antioxydants d’origine végétale
Les polyphénols (EGCG, resvératrol, silymarine) et l’extrait de Polypodium leucotomos montrent des effets protecteurs contre les UVA et la lumière visible : réduction des CPD, modulation des voies inflammatoires, amélioration de la réparation de l’ADN.
Microbiome et photoprotection
Le microbiome cutané apparaît comme un acteur émergent : certaines souches produisent des pigments photoprotecteurs ou stimulent des voies de réparation. Cette dimension ouvre la voie à une photoprotection personnalisée intégrant filtres, nutrition et modulation microbienne.
Choix des écrans solaires – Dr Jean Claude Béani de Grenoble
Le docteur Béani a présenté une analyse détaillée des critères permettant de qualifier un produit comme véritable système de photoprotection solaire (PPS).
Propriétés essentielles
• Remanence : résistance à l’eau et à la sudation.
• Photostabilité : stabilité du produit fini sous UV.
• Protection harmonieuse UVA/UVB : ratio CPB/CPA ≤ 3 pour éviter les coups de soleil et limiter la carcinogénicité des UVA.
Méthodes d’évaluation
• In vivo : tests sur volontaires non bronzés, ITA ≥ 28°.
• In vitro : spectrophotométrie, longueur d’onde critique (LOC ≥ 370 nm).
• Normes ISO : SPF (UVB) et PPD (UVA).
Composition et galénique
L’efficacité dépend du choix des filtres (minéraux, organiques, nanoparticulaires), de la galénique (crème, gel, mousse, stick) et de la substantivité (adhérence à la couche cornée). Les additifs doivent être surveillés : certains peuvent induire des réactions cutanées ou fausser le SPF par effet anti inflammatoire. Des pratiques industrielles discutables existent (ajout de filtres non déclarés).
Normes internationales
Les normes européennes sont plus strictes que celles de la FDA, notamment pour la protection UVA. De nombreux produits américains à haut SPF ne répondent pas aux critères européens.
Photoprotection personnalisée selon le phototype
• Phototypes clairs (I–IV) : priorité à la protection UVB (SPF ≥ 50).
• Phototypes foncés (V–VI) : priorité à la protection UVA1 et lumière visible ; intérêt des produits teintés contenant des oxydes de fer. L’ITA permet une classification objective de la pigmentation et une adaptation fine de la photoprotection.
Implications pratiques
Le choix du PPS doit intégrer :
• Le phototype et l’ITA,
• L’intensité de l’ensoleillement,
• La zone d’application,
• La galénique la plus adaptée.
En résumé, la sélection d’un écran solaire repose sur la qualité intrinsèque du produit, l’adaptation au phototype et aux conditions d’exposition, et une utilisation correcte et régulière.
Rapport rédigé par Joël Claveau (dermatologue, Québec)
Intervenant·e(s) : Docteur Hélène Aubert, CHU de Nantes, France
Dans la première partie, elle révise les indications et les traitements topiques du psoriasis.
Le psoriasis est une dermatose inflammatoire chronique impliquant une hyperprolifération kératinocytaire et une dysrégulation immunitaire centrée sur les axes IL‑23/Th17 et TNF‑α. Le traitement topique demeure la pierre angulaire des formes légères à modérées et conserve un rôle adjuvant dans les formes sévères sous traitement systémique ou biothérapeutique. Le choix des topiques doit être raisonné selon la localisation, l’épaisseur des plaques, la tolérance cutanée et le profil du patient.
Les dermocorticoïdes constituent la classe la plus utilisée grâce à leur action anti‑inflammatoire rapide et leur capacité à moduler les cytokines pro‑inflammatoires. Leur puissance varie de très forte (clobétasol) à faible (hydrocortisone), avec une sélection dictée par la zone atteinte : faible puissance pour le visage et les plis, forte pour les plaques épaisses du tronc et des membres. Le schéma d’application repose sur une phase d’attaque courte (quotidienne pendant deux à quatre semaines), suivie d’une décroissance progressive afin de limiter les rebonds et les effets indésirables tels que l’atrophie cutanée ou les télangiectasies. Le cuir chevelu bénéficie de galéniques adaptées (gel, mousse, lotion) et d’associations avec des kératolytiques en cas de squames abondants.
Les analogues de la vitamine D, tels que le calcipotriol et le calcitriol, régulent la différenciation kératinocytaire et inhibent la prolifération, avec une bonne tolérance. Ils sont utilisés seuls sur plaques stables ou en association avec les dermocorticoïdes, combinaison qui améliore la rapidité et la durabilité de la réponse. Les schémas alternés (calcipotriol le matin, corticoïde le soir) ou les associations prêtes à l’emploi sont particulièrement efficaces en entretien proactif. Les inhibiteurs de la calcineurine, comme le tacrolimus et le pimécrolimus, sont indiqués pour les zones à peau fine (visage, plis, génital), où la corticothérapie prolongée est inadaptée. Les rétinoïdes topiques (tazarotène) peuvent être envisagés sur plaques hyperkératosiques, mais leur tolérance locale limite leur usage. Enfin, les kératolytiques (acide salicylique, urée) facilitent la pénétration des actifs sur les plaques épaisses, notamment au niveau du cuir chevelu.
Le traitement des zones particulières requiert des ajustements. Au niveau du visage et des plis, on privilégie les inhibiteurs de la calcineurine ou des corticoïdes de faible puissance en cures courtes, suivies d’un entretien bi‑hebdomadaire ; pour le cuir chevelu, les mousses ou gels cortisonés peuvent être alternés avec des kératolytiques ; pour les ongles, l’efficacité des topiques reste limitée, mais des corticoïdes sous occlusion et le calcipotriol peuvent être tentés avant d’envisager un traitement systémique. Les symptômes associés, tels que prurit ou douleur fissuraire, doivent être intégrés à la décision thérapeutique.
Dans la deuxième partie, elle aborde les traitements systémiques et biothérapies.
Les formes modérées à sévères, définies par une atteinte étendue (>10 % de la surface corporelle), un PASI élevé, une atteinte unguéale invalidante, un rhumatisme psoriasique ou un retentissement psychosocial majeur, justifient un traitement systémique. Les algorithmes recommandent le méthotrexate comme option de première ligne en raison de son efficacité, de son coût et de sa compatibilité avec des comorbidités fréquentes. Il nécessite une supplémentation en acide folique, une surveillance biologique régulière et une contraception stricte. Il est contre‑indiqué en cas de grossesse, d’insuffisance rénale sévère ou d’hépatopathie active. L’acitrétine est réservée aux formes pustuleuses ou hyperkératosiques, mais son risque tératogène impose une contraception prolongée. La ciclosporine est indiquée en poussée aiguë ou dans les formes érythrodermiques, en cures courtes en raison de ses risques néphrotoxiques.
La photothérapie par UVB est une alternative pour les formes en gouttes ou les rechutes, notamment chez les patients souhaitant éviter les immunosuppresseurs. Elle est contre‑indiquée en cas d’érythrodermie ou de pustulose généralisée et chez les sujets à risque carcinogène.
Les biothérapies ont transformé la prise en charge. Les anti‑TNFα (adalimumab, infliximab, étanercept) sont efficaces, notamment en cas de rhumatisme psoriasique. Les anti‑IL‑12/23 (ustekinumab) offrent une tolérance robuste. Les anti‑IL‑17 (secukinumab, ixekizumab) sont particulièrement efficaces sur les ongles et le cuir chevelu, tandis que les anti‑IL‑23 (guselkumab, risankizumab, tildrakizumab) se distinguent par des intervalles d’injection longs et une persistance élevée. La stratégie repose sur des objectifs quantifiés (PASI 90/100, DLQI ≤ 1) et une réévaluation à 12–16 semaines pour ajuster ou changer de classe en cas de réponse insuffisante.
Les scénarios particuliers incluent la grossesse, où la photothérapie NB‑UVB et le certolizumab sont privilégiés, tandis que le méthotrexate, l’acitrétine et le PUVA sont contre‑indiqués. Chez les sujets âgés, la surveillance des risques infectieux, des interactions médicamenteuses et de la fonction rénale/hépatique oriente vers des biothérapies à profil de tolérance favorable ou vers la photothérapie. En cas de maladies inflammatoires chroniques de l’intestin, les anti‑TNFα ou anti‑IL‑23 sont préférés, alors qu’il faut être prudent vis‑à‑vis des IL‑17.
Finalement, elle nous résume ses messages clés et recommandations en réitérant que la prise en charge doit être individualisée et proactive.
Tous les patients doivent bénéficier d’un traitement adapté à la sévérité, à la localisation et aux objectifs fonctionnels et psychosociaux. Les topiques restent essentiels, même sous biothérapie, pour contrôler les zones difficiles et prévenir les rechutes. Les algorithmes recommandent une phase d’attaque courte et efficace, suivie d’un entretien proactif bi‑hebdomadaire sur les zones à risque. La décroissance progressive des dermocorticoïdes est indispensable pour éviter les rebonds, et l’association vitamine D et corticoïde optimise l’efficacité et la tolérance. En cas d’échec topique, la décision se fait vers la photothérapie ou le méthotrexate, puis vers les biothérapies avec une réévaluation précoce et des objectifs quantifiés.
Les cas particuliers doivent être anticipés. En effet, en grossesse, il faut privilégier la photothérapie NB‑UVB et éviter les molécules tératogènes. Chez les patients âgés, il faut évaluer la fonction rénale et hépatique ainsi que les interactions médicamenteuses. Les atteintes unguéales et du cuir chevelu justifient souvent une escalade thérapeutique vers les biothérapies ciblées. L’éducation thérapeutique et l’adhésion sont essentielles : choix de galéniques agréables, explication des schémas proactifs, planification des rendez‑vous d’évaluation et utilisation d’indicateurs comme le PASI et le DLQI. Enfin, les innovations telles que les inhibiteurs de TYK2 et les stratégies personnalisées basées sur les phénotypes et comorbidités ouvrent la voie à une optimisation continue des traitements.
Rapport rédigé par Joël Claveau (dermatologue, Québec)
Intervenant·e(s) : Docteur Thibault Kervarrec, Anatomo-pathologiste au CHU de Tours, France, docteur Nicolas Macagno, anatomo-pathologiste, Hôpital La Timone à Marseille et docteur Maxime Battistella, anatomo-pathologiste, Hôpital St-Louis, Paris, France
Introduction et classification
Les tumeurs annexielles cutanées regroupent des néoplasies dérivées des structures pilo-sébacées et sudorales. Elles se classent selon la ligne de différenciation : folliculaire, sébacée et sudorale. Cette classification repose sur des critères histologiques et immunohistochimiques. Ces tumeurs peuvent être bénignes ou malignes, les formes malignes apparaissant de novo ou par transformation. Leur diversité morphologique impose un diagnostic histopathologique précis.
Épidémiologie et données cliniques
Une étude rétrospective sur 1615 cas a montré que 97 % des tumeurs annexielles sont bénignes et seulement 3 % malignes. Chez l’enfant, le pilomatricome est la tumeur la plus fréquente, souvent localisée au visage ou aux extrémités. Chez l’adulte, les entités dominantes sont l’hidrocystome, le trichilemmome, le spiradénome et le porome. Environ 9 % des cas sont liés à des syndromes génétiques, ce qui impose une vigilance particulière. Les carcinomes annexiels sont rares mais peuvent être agressifs, avec un tropisme pour les zones céphaliques.
Principales entités histologiques
Les tumeurs sudorales bénignes incluent le porome, l’hidradénome et la tumeur mixte apocrine. Le porome se développe à partir des cellules poroïdes et cuticulaires, souvent en connexion avec l’épiderme. L’hidradénome est une tumeur nodulaire dermique, parfois kystique, pouvant présenter une double différenciation eccrine et apocrine. Les formes malignes sudorales comprennent le porocarcinome, le carcinome annexiel microkystique (MAC) et l’hidradénocarcinome. Le MAC est particulièrement infiltrant, avec atteinte périneurale fréquente, expliquant son risque élevé de récidive lors d’exérèse incomplète.
Les tumeurs folliculaires incluent le trichoblastome, caractérisé par des cellules basaloïdes et des structures folliculaires rudimentaires, et le pilomatricome, qui présente des cellules matricielles périphériques et des « ghost cells » calcifiées au centre. Les variantes malignes incluent le carcinome trichoblastique, qui se distingue par son architecture infiltrante et ses atypies cytologiques. Les tumeurs sébacées vont de l’adénome au carcinome sébacé, ce dernier étant souvent localisé en région palpébrale et associé au syndrome de Muir-Torre. Une étude multicentrique CARADERM portant sur 2372 carcinomes annexiels a montré que 42 % sont sudoraux, 35 % folliculaires et 11 % sébacés.
Diagnostic et dermatoscopie
La dermatoscopie des tumeurs annexielles est peu spécifique et peut simuler des carcinomes basocellulaires ou des lésions mélaniques. Certains indices peuvent orienter, comme des structures translucides ou des vaisseaux polymorphes, mais ils ne permettent pas un diagnostic avec certitude. L’examen histologique reste le standard de pratique, privilégiant une biopsie-exérèse pour évaluer l’architecture complète. L’immunohistochimie est souvent nécessaire pour confirmer la ligne de différenciation et rechercher des anomalies des protéines de réparation des incompatibilités ou mauvais appariements (MMR) dans les tumeurs sébacées. Les marqueurs utiles incluent le CEA et EMA pour les tumeurs sudorales, adipophiline pour la différenciation sébacée, et PHLDA1 au niveau folliculaire.
Syndromes de prédisposition
Plusieurs syndromes génétiques sont associés aux tumeurs annexielles. Le syndrome de Brooke-Spiegler, lié à des mutations CYLD, entraîne des cylindromes et spiradénomes multiples. Le syndrome de Birt-Hogg-Dubé, associé à des mutations FLCN, se manifeste par des fibrofolliculomes et un risque de carcinome rénal. Le syndrome de Cowden, lié à des mutations PTEN, se caractérise par des trichilemmomes multiples et un risque accru de cancers mammaires et thyroïdiens. Le syndrome de Muir-Torre, variante du syndrome de Lynch, associe des tumeurs sébacées cutanées à des cancers viscéraux tels que colorectal, endométrial et ovarien. Ces syndromes imposent une surveillance dermatologique et systémique, ainsi qu’un conseil génétique. La présence de tumeurs multiples, d’un âge jeune au diagnostic ou d’une localisation périoculaire pour le carcinome sébacé doit alerter le clinicien.
Prise en charge thérapeutique
Le traitement des tumeurs annexielles repose sur l’exérèse chirurgicale complète avec marges saines. Pour les lésions bénignes, cette approche permet de limiter le risque de récidive locale, estimé entre 10 et 15 %. Pour les carcinomes, un bilan d’extension est nécessaire, incluant échographie ganglionnaire, tomodensitométrie thoraco-abdomino-pelvienne et PET-TDM. La chirurgie est le standard, avec recours à la technique de chirurgie micrographique de Mohs pour les formes infiltrantes comme le MAC ou les carcinomes sudoraux agressifs. La radiothérapie peut être envisagée en adjuvant pour des marges impossibles ou des atteintes périneurales diffuses. Les formes avancées ou métastatiques, bien que rares, peuvent bénéficier de thérapies ciblées telles que les inhibiteurs de la voie Hedgehog (vismodegib, sonidegib) pour les carcinomes basocellulaires, ou d’immunothérapie anti-PD-1 (cemiplimab) dans des protocoles individualisés. Le suivi doit être prolongé, surtout en cas de contexte syndromique ou de localisation à haut risque de récidive.
Conclusion
Les tumeurs annexielles cutanées sont majoritairement bénignes, mais certaines formes malignes présentent un risque métastatique et nécessitent une prise en charge spécialisée. Le diagnostic repose sur l’histologie et l’IHC, et la reconnaissance des syndromes génétiques est essentielle pour orienter le suivi et le dépistage des cancers associés. La chirurgie reste le traitement de référence, avec des options ciblées pour les formes avancées. Une vigilance clinique, une exérèse complète et un suivi adapté permettent d’optimiser le pronostic et de prévenir les récidives.
Rapport rédigé par Laura Boix (dermatologue, Guyane)
Intervenants :
Dr Johan CHANAL (Dermatologue et vénérologue à Paris, Praticien Attaché à l’APHP)
Classification OMS 2020 des lésions vulvaires pré-cancéreuses
Il est nécessaire d’utiliser la dernière classification (OMS 2020) des lésions pré-cancéreuses vulvaires qui sépare les lésions HPV induites composées des LSIL (correspondent aux condylomes, qui ne sont pas des lésions pré-cancéreuses) et des HSIL (=lésion malpighienne intra-épithéliale de haut grade), des lésions HPV indépendantes correspondant aux dVIN (VIN différenciée sur dermatose inflammatoire pré-existante (ex : lichen)). Les termes de VIN 1, 2 ou 3 ne doivent plus être utilisés.
Erythème pigmenté fixe (EPF)
Il conviendra d’évoquer le diagnostic d’érythème pigmenté fixe (EPF) devant une lésion génitale à type de placard érythémateux ou œdémateux, de lésion bulleuse (voire d’érosion post-bulleuse peu spécifique), d’autant plus que les lésions sont récidivantes. La localisation génitale de l’EPF est prépondérante chez l’homme, quasi-exclusivement sur le gland. Les lésions apparaissent 1 jour à 2 semaines après la prise du médicament inducteur, le délai peut se réduire à quelques heures en cas de récidive. L’évolution est spontanément favorable en quelques jours.
Lichen plan vulvaire érosif
Une biopsie est indispensable devant tout lichen plan vulvaire érosif (forme la plus fréquente de lichen plan au niveau vulvaire, 85% des cas) afin d’éliminer une dermatose bulleuse auto-immune, notamment un pemphigus.
Rapport rédigé par Laura Boix (dermatologue, Guyane)
Intervenants :
Cheveux laineux dès la naissance + kératodermie palmo-plantaire
En cas de cheveux laineux présents dès la naissance (à différencier du syndrome des cheveux incoiffables) associés à une kératodermie palmo-plantaire, il conviendra d’évoquer un syndrome de Carjaval ou une maladie de Naxos qui nécessitera une surveillante cardiaque renforcée (risque de cardiomyopathie dilatée et cardiopathie arythmogène respectivement).
Trichoscopie
La trichoscopie de l’alopécie androgéno-génétique peut recouvrir : une anisotrichie (variation du diamètre des cheveux), une miniaturisation (cheveux duveteux), un seul cheveu par unité folliculaire, des orifices pileux vides et des points jaunes d’aspect huileux. Les signes trichoscopiques de la pelade active sont les suivants : points noirs, cheveux cassés, cheveux en point d’exclamation.
Pour finir, on rappellera ici l’importance majeure de la dermoscopie/trichoscopie dans le diagnostic de teigne ; sont en faveur du diagnostic : cheveux en virgule et cheveux en tire-bouchon (pattern courbé, évoquant plutôt une teigne trichophytique de parasitisme endothrix), cheveux en zig-zag et cheveux en code-barres (pattern droit évocateur d’une teigne microsporique de parasitisme ectothrix). Il est également nécessaire de s’équiper d’une lumière de Wood, intégrée dans certains dermoscopes.
Rapport rédigé par Laura Boix (dermatologue, Guyane)
Intervenants :
Dermatose neutrophilique du dos des mains (vascularite pustuleuse)
Une entité à bien connaître : la dermatose neutrophilique du dos des mains, également dénommée vascularite pustuleuse du dos des mains. Il s’agit d’une variante localisée du syndrome de Sweet qui se présente cliniquement par des plaques érythémateuses infiltrées, des pustules voire des bulles du dos des mains. L’histologie retrouve un infiltrat neutrophilique dense du derme, parfois associé à une vascularite leucocytoclasique. Il faut éliminer une infection mais surtout savoir penser au diagnostic pour éviter des chirurgies (parfois très délabrantes) inutiles. Le traitement repose sur une corticothérapie générale ou locale. La dermatose neutrophilique du dos des mains est associée dans 40% des cas à une maladie sous-jacente (hémopathie, cancer solide, MICI), un bilan d’extension est donc de rigueur.
Angiosarcomes
Les angiosarcomes sont des tumeurs rares, d’évolution agressive et de pronostic sombre (survie à 5 ans entre 10 et 35%), favorisées par le lymphœdème chronique ; le sex ratio est de 3:1 en faveur des hommes et la localisation préférentielle est la région tête et cou. Il faut y penser devant un œdème inflammatoire localisé, purpurique ; l’histologie retrouve des cavités vasculaires anastomosées bordées de cellules endothéliales atypiques avec une forte activité mitotique.
Toxidermie de contact à l’huile de Nigelle
Pour terminer, on rappellera le cas particulier de la toxidermie de contact à l’huile de Nigelle (huile aux vertus cicatrisantes à base de thymoquinone et de terpènes, allergènes bien connus), qui doit être traquée à l’interrogatoire en raison d’une possible extension des lésions jusqu’à dix jours après l’arrêt de l’application cutanée.
Rapport rédigé par Laura Boix (dermatologue, Guyane)
Intervenants : Pr Romain BLAIZOT (Chef de service de dermatologie et vénéréologie du CHU de Cayenne, Guyane Française)
Histoplasmose
L’histoplasmose « américaine » est très polymorphe cliniquement, pouvant donner des tableaux prurigo-like ou dermatophyte-like ; elle fait partie des infections opportunistes les plus fréquentes chez les pvVIH (notamment en Guyane Française). L’histoplasmose « africaine » se présente habituellement par des nodules froids, qui ressemblent à des lésions de molluscum ; la sévérité de la maladie est classiquement moindre que celle de l’histoplasmose « américaine » car l’atteinte est exclusivement cutanée.
Ulcères à bords décollés à penser à l’ulcère de Buruli
En cas d’ulcère à bords décollés, il faut penser à l’ulcère de Buruli (infection par Mycobacterium ulcerans signalée par l’OMS dans au moins 33 pays situés dans des régions au climat tropical, subtropical ou tempéré d’Afrique, d’Amérique du Sud et du Pacifique occidental), d’autant plus chez les professionnels qui ont régulièrement les membres inférieurs immergés dans l’eau (riziculteurs, pêcheurs, etc…). La clinique est évocatrice : il existe le plus souvent une phase nodulo-oedémateuse précédent une ulcération non douloureuse. Le diagnostic différentiel se fait avec les autres ulcères phagédéniques tropicaux, notamment à Mycobacterium marinatum, dont l’infection présente des facteurs de risque similaires, toutefois, les bords de l’ulcère ne peuvent pas se décoller au stylet.
Maladie de Kaposi
Pour terminer, nous mentionnerons la maladie de Kaposi, classées en cinq types, de physiopathogénie mixte, à la fois cancéreuse et infectieuse. La maladie de Kaposi correspond à un sarcome de la peau dû à HHV8, qui a la particularité de pouvoir se disséminer, réalisant dans sa forme anaplasique une affection mortelle. Le diagnostic précoce est essentiel, et sera suspecté devant des lésions maculo-papuleuses violacées à brunâtres, localisées ou disséminées. Les lésions étant très vascularisées, des précautions seront prises lors des biopsies cutanées.
Rapport rédigé par Laura Boix (dermatologue, Guyane)
Intervenants : Pr Vincent SIBAUD (Praticien Hospitalier, IUCT ONCOPOLE de Toulouse)
Rôle du dermatologue
Le dermatologue a un rôle diagnostique et thérapeutique essentiel dans la prise en charge des toxicités dermatologiques des thérapies anticancéreuses. De surcroît, les toxicités dermatologiques sous immunothérapie sont un marqueur d’alerte d’autres toxicités immuno-induites, devant faire instaurer une surveillance renforcée de ces patients.
Erythème toxique à la chimiothérapie
Il est important de connaître l’érythème toxique à la chimiothérapie qui est de mécanisme non-allergique mais toxique, dose-dépendant. Il se localise surtout au niveau des zones de friction et d’hypersudation ; on peut le voir classiquement sur les zones où sont apposés des pansements entraînant une hypersudation par occlusion, conduisant à un érythème toxique localisé dû à l’excrétion de la chimiothérapie.
Cas particulier : Enforyumab vedotin
Nous aborderons le cas particulier de l’Enfortumab vedotin, première ligne thérapeutique des cancers urothéliaux avancés ; il s’agit d’un anticorps glycoconjugué dirigé contre la nectine 4 combiné à un agent cytotoxique (le vedotin). La protéine nectine 4 est naturellement exprimée dans les kératinocytes (jonctions adhérentes, adhésion intercellulaire), les glandes eccrines et les follicules pileux. La toxicité dermatologique est quasiment obligatoire et correspond à une toxicité ciblée et toxique. L’érythème toxique à la chimiothérapie est souvent pris pour un syndrome de Lyell car on observe un décollement épidermique parfois impressionnant. En revanche, cette toxicité dermatologique peut être traitée en diminuant les doses de chimiothérapie (alors que dans le syndrome de Lyell, la reprise du traitement est strictement contre-indiquée).
Rapport rédigé par Margaux BONHOMME (dermatologue, St Etienne)
Intervenant·e(s) : A. Nosbaum, O. Dereure, L. Jaulent
JAKi = inhibiteur de JAK = inhibiteur de Janus kinase
Les inhibiteurs de Janus kinase existent depuis les années 2010 en rhumatologie et depuis 2020 en dermatologie, en administration orale ou topique. Leur durée de vie courte rend leur action rapidement réversible et sélective. Les indications dermatologiques de cette classe thérapeutique vont progressivement augmenter dans les prochaines années.
Pour rappel, il existe trois molécules de JAKi systémiques ayant l’AMM dans la dermatite atopique en France : l’abrocitinib, le baricitinib et l’upadacitinib. En topique, on dispose du ruxolitinib dans le vitiligo et du delgocitinib pour l’eczéma des mains.
Le premier thème abordé est celui de l’efficacité variable des différents JAKi chez un même patient, illustré par des cas cliniques.
Exemple : une patiente de 46 ans atteinte d’une dermatite atopique résistante aux dermocorticoïdes, aux UV, au méthotrexate, et présentant un effet indésirable oculaire sous dupilumab. Un traitement par baricitinib est débuté, puis par abrocitinib. Les deux molécules perdent en efficacité dans le temps, motivant un switch vers l’upadacitinib. Au total, on observe une bonne efficacité des inhibiteurs de Janus kinase, mais avec une perte d’efficacité dans le temps pour deux de ces molécules. La perte d’efficacité d’un JAKi n’est pas prédictive de celle des autres JAKi.
Un second cas est ensuite discuté : un patient d’une trentaine d’années sous abrocitinib 200 mg par jour, bien toléré mais partiellement efficace pour une dermatite atopique. Il avait auparavant reçu de l’upadacitinib, mal toléré en raison de douleurs thoraciques fonctionnelles, mais efficace. Il a poursuivi l’abrocitinib au long cours et, en cas de poussée, s’automédique en prenant de l’upadacitinib pendant deux ou trois jours. Ce patient a donc, de lui-même, combiné un traitement bien toléré mais moins efficace avec un traitement efficace mais mal toléré en cas de poussée. Cette procédure est en dehors de toute recommandation, mais ouvre des perspectives pour le futur de la thérapeutique par JAKi.
Ensuite, on aborde les JAKi spécifiquement dans la dermatite atopique et les indications de prescription. Dans l’algorithme de la Société Française de Dermatologie, le traitement par JAKi est envisageable au même niveau que la ciclosporine ou les biothérapies. Cependant, pour le remboursement, il est actuellement obligatoire d’essayer d’abord la ciclosporine, sauf en cas de contre-indication ou d’intolérance.
Ces traitements oraux ne doivent être utilisés qu’en l’absence d’alternative et à posologie réduite dans les cas suivants : patients de plus de 65 ans, fumeurs ou anciens gros fumeurs, patients à risque cardiovasculaire ou thromboembolique, ou en cas de néoplasie. L’efficacité des JAKi pour l’eczéma s’évalue après 8 à 16 semaines de traitement.
Quand privilégier un JAKi plutôt qu’une biothérapie dans la dermatite atopique ?
Bien qu’ils soient au même niveau dans les recommandations de la SFD, l’oratrice donne un avis personnel : privilégier les JAKi en cas de volonté d’action rapide, notamment en cas de prurit sévère ; en cas de préférence pour un traitement oral ; en deuxième ligne en cas de conjonctivite ou d’atteinte tête et cou sous biothérapie ; ou en cas d’une autre indication associée à un JAKi pour une comorbidité (polyarthrite rhumatoïde, MICI…).
Pour l’eczéma chronique des mains, le delgocitinib est arrivé cette année. Il s’agit d’un JAKi topique. Les études DELTA 1 et 2, ayant conduit à l’AMM, montrent que pour un eczéma modéré à sévère, toutes formes confondues, avec pour critère primaire un IGA 0 ou 1 après 16 semaines, 20 à 30 % des patients atteignent ce critère. Les effets secondaires sont légers et conduisent rarement à l’arrêt du traitement. Ce traitement est actuellement délivré en milieu hospitalier uniquement, en accès direct. L’AMM concerne l’eczéma chronique des mains modéré à sévère dont le traitement par DCT est inadéquat ou inapproprié. L’application se fait une fois par jour jusqu’à guérison, puis reprise en cas de rechute.
Le nombre de publications sur les JAKi en dermatologie suit une évolution exponentielle. Les données d’études sont à interpréter avec prudence : le long terme correspond souvent à 52 semaines, ce qui est court par rapport aux décennies de pratique médicale. Il n’y a pas d’épuisement d’efficacité des JAKi selon les données actuelles, mais plusieurs questions persistent : efficacité à long terme, tolérance à long terme, évolution à l’arrêt.
Dans les quelques études en vie réelle chez les patients de plus de 60 ans, il n’y a pas de sur-risque cardiovasculaire ou de cancer, mais les durées d’exposition sont courtes. Chez les patients de moins de 12 ans, l’efficacité semble moindre et une vigilance est nécessaire concernant les troubles lipidiques.
Des études en cours explorent des indications innovantes : alopécies cicatricielles (alopécie frontale fibrosante, lichen plan pilaire, alopécie centrale centrifuge), via un JAKi contre placebo pendant 24 semaines puis JAKi pour tous les patients. Des essais sont également en cours dans la maladie de Verneuil, avec des résultats préliminaires très encourageants. Et à l’arrêt du traitement ? L’efficacité disparaît rapidement, ce qui pose la question de la durée optimale de traitement et de la toxicité cumulative.
À l’arrêt, la rechute survient le plus souvent dans les 3 mois. La reprise ne retrouve pas l’efficacité initiale : ces données ne soutiennent donc pas une stratégie « on/off » selon les poussées.
Une méta-analyse sur les effets secondaires retrouve principalement : éruptions acnéiformes, infections, anomalies biologiques, sans toxicité cardiovasculaire ou thromboembolique particulière — mais par principe, la prudence reste de mise. Les effets indésirables infectieux sont les plus fréquents : zona, herpès disséminé. Il est nécessaire de bien interroger les patients et de réaliser les sérologies. La vaccination contre le zona (Shingrix) est recommandée avant traitement. En cas de vaccination vivante, un arrêt de 3 mois avant puis 1 mois après est nécessaire.
La littérature est très abondante concernant les effets indésirables. Pour les indications dermatologiques, on retrouve peu ou pas de signal cardiovasculaire, thromboembolique ou oncologique. Les signaux ayant été décrits concernent surtout des populations rhumatologiques traitées pour polyarthrite rhumatoïde. Pour la dermatite atopique, la pelade ou le vitiligo, il existe peut-être un sur-risque cardiovasculaire ou thromboembolique chez des hommes jeunes avec facteurs de risque familiaux dans une étude rétrospective. Dans une étude prospective observationnelle, il existerait peut-être un sur-risque dans l’hidradénite suppurée, mais pas dans d’autres indications. À ce jour, il y a clairement moins d’effets indésirables graves dans les indications dermatologiques que rhumatologiques, mais cela pourrait changer avec la généralisation des JAKi.
Dans le vitiligo, l’absence de réponse à 6 mois nécessite de prolonger le traitement de 3 mois supplémentaires. L’efficacité est plus lente que dans la dermatite atopique ou la pelade.
De nombreuses autres indications sont en cours d’essai ou ont fait l’objet de case reports en dehors des AMM : lupus érythémateux (résultats variables selon la molécule), dermatomyosite, granulomatoses, GVH cutanée, et bien d’autres.
Certaines études rapporteraient que l’association JAKi et immunothérapie augmenterait l’efficacité de l’immunothérapie en oncologie, permettant de franchir un « plafond de verre ». Des données existent également dans le mycosis fongoïde et les papules lymphomatoïdes.
Rapport rédigé par Margaux BONHOMME (dermatologue, St Etienne)
Intervenant·e(s) : J.N. Scrivener, A. Petit, M. Rybojad, M. Mokni
Cette FMC revient sur des cas cliniques de diagnostic difficile en décrivant des vignettes cliniques ; nous revenons ici sur les cas les plus étonnants.
Le premier orateur aborde le sujet de l’intelligence artificielle (IA) en médecine. La seule étape de la prise en charge qui ne peut pas être remplacée par l’IA est le recueil des données du patient, qui nécessite d’entrer en relation directe avec lui.
Le premier cas clinique concerne un patient présentant un tableau associant asthénie, arthralgies et éruption érythémateuse annulaire centrifuge du visage. La biologie retrouve une CRP à 47 mg/L. La biopsie montre quelques lymphocytes, sans élément évocateur d’un diagnostic précis. Une récidive survient un an plus tard, avec apparition de l’éruption annulaire du visage à la suite d’une angine à streptocoque. Il s’agissait donc d’un érythème marginé discoïde, appartenant aux critères de Jones du diagnostic de rhumatisme articulaire aigu. Le message à retenir est que des entités anciennes, devenues rares de nos jours, peuvent encore survenir.
Le deuxième cas est celui d’une femme de 62 ans, fébrile à 38 °C, asthénique, présentant des poussées de nodules hypodermiques inflammatoires de grande taille, évoluant vers des plaques à bordure annulaire rouge et infiltrée, entourant de larges plages d’atrophie sous-cutanée. Les lésions sont symétriques et prédominent au niveau des membres. Les nodules évoluent en un mois vers de larges plaques atrophiques. La biopsie retrouve une panniculite lipophagique avec des cellules de Touton. Un traitement par Plaquenil® est instauré pour soulager les symptômes, mais il ne permet pas de corriger l’atrophie persistante, hyperpigmentée et déformante. Une prise en charge par lipofilling peut être proposée aux patients atteints.
Le troisième cas clinique concerne une patiente de 24 ans, enceinte de cinq mois de son deuxième enfant. Les gynécologues contactent les dermatologues devant une majoration du volume mammaire et un aspect inflammatoire des aréoles. La patiente décrit une augmentation de la taille de ses seins, mais la barrière de la langue présente rend l’interrogatoire difficile. Les premières biopsies cutanées réalisées par les gynécologues ne permettent pas de poser le diagnostic. Celui de gigantomastie gravidique bilatérale est finalement retenu. La grossesse stimule, par le biais des hormones, la croissance des glandes mammaires jusqu’à l’accouchement. Dans ce cas, l’accouchement a été déclenché dès que le terme a été atteint afin de limiter la croissance mammaire. Il n’existe pas de traitement permettant de stopper cette croissance. Il s’agit d’une entité très rare, sans série décrite. La prise en charge repose sur la chirurgie réparatrice.
Le cas suivant est celui d’un patient de 14 ans, sans antécédent notable, présentant des macules hypopigmentées sur une peau de phototype VI, au niveau du corps et du visage, sans prurit associé. Le diagnostic d’épidermodysplasie verruciforme par mutation EVER 1 ou 2 est évoqué. Une sérologie VIH est réalisée et revient positive, faisant de ce tableau une épidermodysplasie verruciforme acquise liée à HPV5, sur un VIH congénital. Il s’agit d’un diagnostic différentiel de l’épidermodysplasie verruciforme génétique, qui provoque une susceptibilité anormale au papillomavirus humain par tropisme pour les kératinocytes.
Le cinquième cas concerne un patient présentant une plaque prurigineuse du dos évoluant depuis plus de vingt ans, responsable d’insomnies, sans efficacité des antihistaminiques, du Versatis® ou des antidépresseurs. La peau en regard de cette plaque a un aspect pavimenteux, en relief et palpable. L’histologie met en évidence des dépôts amorphes entre deux papilles dermiques. L’ensemble de ces éléments permet de poser le diagnostic d’amylose cutanée de type lichen amyloïde. Le patient présente comme antécédents une thyroïdectomie, une parathyroïdectomie ainsi qu’une surrénalectomie pour phéochromocytome. Il est porteur d’un syndrome de néoplasies endocriniennes multiples (NEM) de type 2A, dont l’un des marqueurs les plus fréquents est le lichen amyloïde.
Un autre cas concerne un patient de 70 ans présentant une lésion pénienne au niveau du prépuce. Une circoncision avec exérèse de la lésion est réalisée ; l’analyse histologique décrit un carcinome épidermoïde verruqueux micro-invasif, opéré avec des marges saines. Le carcinome récidive une première fois et est réopéré avec des marges saines, puis une troisième fois ; les histologies restent compatibles avec un carcinome épidermoïde. Le scanner et l’IRM sont normaux. Une quatrième récidive survient, et les urologues envisagent une pénectomie. Cliniquement, la lésion correspond à une collerette hypopigmentée entourant une lésion croûteuse jaunâtre. Un dermatologue évoque alors le diagnostic de balanite pseudo-épithéliomateuse kératosique et micacée de Lortat-Jacob et Civatte. Il s’agit d’une pathologie rare, touchant l’homme de plus de 60 ans, souvent sur un terrain de lichen scléreux. On retrouve classiquement une croûte micacée. L’évolution est lente et un traitement par dermocorticoïdes peut être instauré. L’histologie est proche de celle du carcinome épidermoïde.
Le septième cas est celui d’un homme de 38 ans, sans antécédents connus, présentant une lésion tumorale de la verge apparue en moins de six mois, d’évolution rapidement progressive. Deux diagnostics sont évoqués : une acanthose réactionnelle ou un carcinome spinocellulaire verruqueux. Après exérèse complète, l’aspect histologique est compatible avec un carcinome épidermoïde. L’échographie, le scanner et l’IRM retrouvent des adénopathies inguinales bilatérales ainsi qu’une infiltration des corps caverneux. Un bilan sérologique est réalisé de principe : la sérologie syphilitique est positive et, après relecture histologique, le diagnostic de syphilis à présentation pseudo-carcinomateuse est retenu.
Le dernier cas décrit un patient présentant des clous cornés au niveau des follicules pilosébacés associés à une adénopathie cervicale très volumineuse. Le tableau fait initialement suspecter un lymphome cutané folliculaire. La biopsie de l’adénopathie pose le diagnostic de tuberculose. Il s’agit donc d’un lichen scrofulosorum, présentation rare de la tuberculose, appartenant au groupe des tuberculides.
Rapport rédigé par Margaux BONHOMME (dermatologue, St Etienne)
Intervenant·e(s) : M. Samimi, B. Cribier, C. Paul, D.F. Murrell, N. Kluger
La première oratrice présente les interrogations à se poser avant de proposer un article à la publication.
En premier lieu, s’agit-il d’un travail scientifique original ou d’un article didactique ?
Le travail scientifique valorise une activité de recherche ou des missions du cursus académique, comme les travaux de thèse ou de mémoire. Un article didactique est utile pour la communauté médicale en visant un lectorat large ; ce sont des travaux peu valorisés sur le plan académique mais fréquemment cités.
Ensuite, faut-il nécessairement publier dans une revue dermatologique ?
De nombreux sujets sont à la croisée d’autres spécialités, et l’article aura potentiellement plus de chances d’être publié dans une revue d’oncologie, de médecine interne, de rhumatologie, de maladies infectieuses, d’ORL ou de gynécologie. Cependant, il faut bien s’assurer que le sujet n’a pas déjà été largement traité dans la spécialité ciblée.
Se pose ensuite la question de la forme de la publication.
L’article original a pour avantage une plus forte valorisation académique et une meilleure visibilité, permettant de mieux mettre en valeur les résultats. La research letter présente une probabilité d’acceptation plus élevée ; elle est plus rapide à rédiger et plus « flexible », tout en conservant une bonne visibilité. Son principal inconvénient est un format très condensé, pouvant sacrifier une partie des résultats.
Faut-il être ambitieux dans le choix du niveau de la revue ?
Il faut viser ce que l’on mérite. Il est recommandé de viser haut lorsque les résultats sont innovants, avec une méthodologie très robuste, une portée internationale et un message scientifique clair et impactant. À l’inverse, il n’est pas nécessaire d’être ambitieux lorsque les résultats confirment des données déjà existantes, que la méthodologie est correcte mais non robuste, que l’effectif est faible ou non atteint, que l’étude a été réalisée sans biostatisticien, qu’elle a une portée franco-française, ou qu’il s’agit de données descriptives intéressantes mais sans véritable message scientifique.
Les éléments à prendre en compte pour le choix de la revue sont : la spécialité de la revue, son score bibliométrique, le type de revue (ce qu’elle publie), les catégories d’articles acceptées, ainsi que l’existence ou non de publications antérieures sur la même thématique et avec un design similaire.
La seconde oratrice aborde les différents modes de publication.
Il existe deux principaux modes : le libre accès, avec un article accessible gratuitement, aux frais des auteurs ou de la revue et les revues par abonnement, qui correspondent au mode traditionnel, avec paiement des frais d’abonnement par les lecteurs. Les éditeurs génèrent leurs revenus via ces abonnements.
Le libre accès est facilement accessible mais présente souvent un impact plus faible et un coût élevé pour les auteurs. Les revues sur abonnement sont généralement plus prestigieuses et bien établies ; les articles y sont davantage cités, mais le processus de publication est plus long, avec des reviewers rigoureux, et l’accès à la lecture se fait aux frais du lecteur.
Pour rappel, l’indice h est basé sur le nombre de citations d’un auteur ou d’un article, et l’indice i10, associé à Google Scholar, correspond au nombre de publications ayant reçu au moins 10 citations.
Le troisième orateur revient sur les critères essentiels à respecter pour espérer être publié.
Tout d’abord, le plan doit être standardisé et rigoureusement respecté : introduction, méthodes, résultats, discussion, bibliographie, légendes des figures, tableaux et figures. Le manuscrit doit être rédigé comme un véritable article scientifique.
Les raisons de refus les plus fréquentes sont les suivantes : le manuscrit n’est pas écrit comme un article scientifique, les instructions aux auteurs de la revue ne sont pas respectées, le plan n’est pas conforme, les images sont intégrées dans le texte au lieu d’être fournies dans des fichiers séparés, il s’agit d’une thèse de médecine à peine remaniée, l’absence totale d’originalité , le type d’article ne correspond pas à la ligne éditoriale de la revue (par exemple, un article de recherche fondamentale soumis à une revue de recherche clinique).
Le titre est primordial pour attirer le lecteur et favoriser les citations. Il ne faut jamais mentionner un pays dans le titre, sauf si cela est réellement pertinent, comme pour une maladie spécifique à une région du monde. Le titre doit rester sobre, court et informatif ; chaque mot compte. Il ne doit jamais être formulé sous forme de question, sauf pour un éditorial.
Concernant l’abstract, il est essentiel de respecter le nombre de mots imposé : chaque mot compte. Il ne faut pas y exposer des généralités connues de tous. De même, la discussion doit rester concise.
Les figures ne doivent pas figurer dans le fichier Word : le texte doit être fourni séparément, avec des fichiers d’images joints, sans montage entre elles. La qualité minimale requise est de 150 Ko, au mieux 500 Ko. Il est impératif de préciser que l’autorisation écrite du patient a été obtenue pour la publication des images. Les conflits d’intérêts doivent également être déclarés.
L’orateur suivant aborde les revues prédatrices.
Elles fonctionnent selon un modèle purement commercial : tout article soumis moyennant finance est publié, sans comité de relecture ni validation scientifique. Les listes de ces revues sont disponibles en ligne.
Enfin, comment maximiser ses chances d’être publié ?
Il faut commencer par le pourquoi et raconter une histoire scientifique cohérente. Pour un article original, il est indispensable de formuler une question de recherche selon l’acronyme PICO et de développer une méthodologie rigoureuse pour y répondre.
L’article est systématiquement soumis à un « check IA » ; l’utilisation d’outils d’intelligence artificielle pour la rédaction est donc à proscrire. Les mots-clés MeSH sont essentiels pour améliorer la visibilité et les citations de l’article. Pour la traduction en anglais, il ne faut pas hésiter à utiliser des outils comme DeepL. Enfin, les délais de review peuvent dépasser trois mois : il est nécessaire de faire preuve de patience.
Rapport rédigé par Margaux BONHOMME (dermatologue, St Etienne)
Intervenant·e(s) : O. Zehou, C. Lesage, E. Gérard
Dans un premier temps, est abordé la question du ganglion sentinelle (GS) dans le mélanome.
Cette procédure ne doit être envisagée que si un traitement adjuvant est susceptible d’être proposé. En l’absence de projet de traitement adjuvant, la réalisation du GS n’a pour seul intérêt qu’une meilleure classification selon les stades.
Pour envisager la procédure du ganglion sentinelle, un bilan d’extension négatif est requis. Chez les patients présentant un mélanome de Breslow > 1 mm, la recherche du GS est recommandée. Pour les mélanomes de Breslow compris entre 0,8 et 1 mm, cette procédure peut être proposée au patient, quel que soit le statut ulcéré. En dessous de 0,8 mm, la recherche du GS est exceptionnelle et ne se discute qu’en cas de mélanome ulcéré.
En cas de GS positif, il n’y a pas d’indication à un curage ganglionnaire systématique immédiat. Un curage peut être discuté de manière exceptionnelle, au cas par cas, notamment en cas de fort envahissement du ganglion sentinelle.
La question de la réalisation du GS se pose chez les patients de stades IIB et IIC, désormais éligibles à une immunothérapie adjuvante d’emblée. La procédure du ganglion sentinelle reste recommandée pour un meilleur staging, en particulier en cas de mutation BRAF. En effet, le traitement adjuvant par thérapie ciblée ne peut être envisagé que si le ganglion sentinelle est positif, et non sur les seuls critères histologiques.
Pour les patients de stade IIIA, avec un ganglion sentinelle envahi de manière micro-métastatique, les données actuelles ne montrent pas de bénéfice du traitement adjuvant. Le stade IIIA correspond à des mélanomes T1 ou T2a, soit un Breslow ≤ 2 mm, non ulcéré, avec un ganglion sentinelle micro métastatique.Il s’agit d’un stade de très bon pronostic. Le bénéfice du traitement adjuvant concerne moins de 20 % des patients, avec un risque de toxicités et un impact sur la qualité de vie. La réalisation d’un ganglion sentinelle et l’indication d’un traitement adjuvant doivent donc être discutées au cas par cas. De manière générale, il faut traiter 8 patients pour qu’un seul évite une récidive sous immunothérapie adjuvante. La thérapie ciblée adjuvante entraîne davantage de toxicités que l’immunothérapie (40 % d’effets indésirables de grade III contre 15 %). Cependant, les effets secondaires de la thérapie ciblée sont le plus souvent réversibles, contrairement à ceux de l’immunothérapie, qui peuvent être irréversibles.
Il est possible de laisser le choix au patient, après une présentation claire et équilibrée des bénéfices et des risques.
Il est à noter que chez les patients porteurs d’une mutation BRAF V600K, l’immunothérapie est à privilégier en situation adjuvante plutôt que la thérapie ciblée. Concernant la thérapie ciblée adjuvante, seule l’association dabrafénib–tramétinib dispose d’une AMM.
Chez les stades IIB et IIC, le ganglion sentinelle est recommandé. Les bénéfices attendus sont une meilleure classification tumorale, améliorant la précision du pronostic, une surveillance mieux adaptée, l’accès et le choix d’un traitement adjuvant et la possibilité de participation à certains essais cliniques. Le potentiel effet thérapeutique de l’exérèse du GS reste débattu. La réduction de la masse tumorale pourrait théoriquement être bénéfique, mais aucune preuve formelle ne le démontre. À l’inverse, la persistance d’antigènes tumoraux pourrait favoriser l’efficacité de l’immunothérapie.
Les contre-indications à la réalisation du GS sont une radiothérapie antérieure sur la zone chirurgicale, une extension loco-régionale mise en évidence au bilan initial, des comorbidités limitantes, une contre-indication ou un refus du patient concernant le traitement adjuvant.
Les principaux risques sont ceux inhérents à l’anesthésie générale, les complications locales, notamment le lymphoedème, l’échec technique, en particulier au niveau de la tête et du cou.
Les principales erreurs retrouvées en pratique sont l’absence de proposition du GS au patient, ou sa réalisation secondairement. Le ganglion sentinelle doit être proposé en même temps que la reprise chirurgicale. Sa réalisation après reprise expose à un risque de modification du drainage lymphatique, avec prélèvement possible d’un ganglion non pertinent.
Un calculateur de risque de décès sur l’âge et du fait du mélanome, est disponible sur le site melanomarisk.org.au. Il peut aider à la décision chez les patients âgés concernant la pertinence d’un traitement adjuvant.
L’information du patient doit présenter le traitement adjuvant comme un équilibre entre ses attentes (vivre sans récidive, maintenir la qualité de vie) et les risques potentiels.
Le rôle du médecin est d’expliquer le risque de récidive dans le temps, le risque de surtraitement, le risque d’effets indésirables réversibles et irréversibles.
À ce jour, les études ne montrent pas de bénéfice en survie globale du traitement adjuvant, mais uniquement un bénéfice en survie sans récidive. Le seul bénéfice démontré en survie globale concerne les patients BRAF V600E mutés traités par thérapie ciblée adjuvante, avec une réduction du risque de décès de 25 %.
Il existe des débats à ce jour, hors recommandations. Certaines hypothèses suggèrent un effet immunologique du maintien du GS en place, via la persistance d’antigènes tumoraux stimulant la réponse immunitaire sous immunothérapie.
La question de la qualité de vie est centrale : contraintes liées aux traitements, visites hospitalières et effets indésirables. Une étude a montré que la rechute avait un impact plus délétère sur la qualité de vie que le traitement adjuvant lui-même.
Concernant les biomarqueurs prédictifs de réponse, les analyses de sous-groupes n’ont pas apporté de résultats concluants à ce jour. Néanmoins, les mélanomes nodulaires ou de localisation tête et cou pourraient tirer un bénéfice plus important du traitement adjuvant.
Pour les GS micro-métastatiques non palpables et non visibles à l’imagerie, la question du traitement néo-adjuvant ne se pose pas. Elle peut être envisagée en cas de macro-métastases ganglionnaires.
L’étude SWOG sur le traitement néo-adjuvant a démontré la possibilité d’évaluer la réponse pathologique sur les pièces d’exérèse. Un consortium international, publié dans Nature Medicine, a standardisé cette évaluation comme une réponse pathologique majeure : < 10 % de cellules tumorales viables, une réponse partielle : 11 à 50 % et une absence de réponse : si plus de 50 % de cellules tumorales viables.
La survie sans progression était de 49 % vs 72 % dans la première étude. L’étude NADINA, incluant uniquement des stades III, montre une survie de 55,7 % vs 77,3 %, confirmant l’intérêt du néo-adjuvant. Chez les patients ayant une réponse pathologique majeure, la survie sans récidive atteint 95 % à 18 mois. Cependant, on observe 30 % d’effets indésirables graves, contre 15 % en adjuvant seul.
Les recommandations actuelles positionnent le traitement néo-adjuvant comme une option pour les stades III et IV.
On note que le cas particulier du mélanome desmoplastique qui est particulièrement sensible à l’immunothérapie. En cas de métastases, le plus souvent cutanées, ces patients sont généralement très bien rattrapés par l’immunothérapie, cette donnée est à considérer pour la prise en charge.
Rapport rédigé par Margaux BONHOMME (dermatologue, St Etienne)
Intervenant·e(s) : M.A. Richard, N. Beneton, N. Quiles-Tsimaratos, C. Girard
Prise en charge dans des situations particulières :
Cette FMC aborde quatre thématiques : le rhumatisme psoriasique, le traitement du psoriasis en cas de grossesse, chez les patients âgés, et en cas de facteurs de risque cardiovasculaire. Ces quatre thématiques sont séparées en quatre paragraphes.
Dans un premier temps, concernant le rhumatisme psoriasique, l’oratrice nous présente le cas d’un patient ayant présenté une arthrite réactionnelle s’intégrant dans le cadre d’un syndrome de Fiessinger-Leroy. Le bilan biologique retrouve une PCR Chlamydiae positive. Le patient a été traité par 21 jours de doxycycline. Plusieurs années plus tard, il présente une éruption cutanée profuse se révélant être un psoriasis. À l’examen clinique, on retrouve une dactylite des deux hallux, et le patient rapporte des douleurs dorso-lombaires. Un bilan complet est réalisé et met en évidence des signes biologiques et radiologiques de spondyloarthrite périphérique.
Ce cas clinique illustre bien la continuité et le chevauchement qui existent entre les spondyloarthrites, l’arthrite réactionnelle et le rhumatisme psoriasique. Il montre aussi la nécessité d’évaluer soigneusement l’atteinte articulaire chez un patient psoriasique. Le dermatologue étant en première ligne dans cette situation, il faut savoir interroger le patient et surtout réaliser une éducation sur le risque de survenue ultérieure de douleurs articulaires, nécessitant de reconsulter un dermatologue ou d’en informer le médecin traitant. En effet, le psoriasis précède souvent l’atteinte articulaire de plusieurs années, et le patient peut être perdu de vue. La spondyloarthropathie étant destructrice, parfois dans un délai inférieur à deux ans, il ne faut pas tarder à introduire un traitement.
Deux scores peuvent aider le dermatologue à dépister l’atteinte articulaire : l’échelle PURE 4 et l’échelle PsA.
Ensuite est abordé le sujet du traitement du psoriasis en cas de grossesse et d’allaitement. Il existe toujours un retard dans les recommandations concernant les femmes enceintes, du fait de leur absence dans les études ; les données sont obtenues secondairement via la pharmacovigilance. Le GrPso français a émis des recommandations.
Pour les traitements topiques du psoriasis pendant la grossesse, on peut utiliser le calcipotriol, les dermocorticoïdes, le ruxolitinib (hors AMM dans le psoriasis) et le tacrolimus topique.
Le méthotrexate est formellement contre-indiqué pendant la grossesse en raison de son risque tératogène. Son arrêt avant conception chez la mère peut se faire 24 heures à l’avance, la demi-vie de la molécule étant de 3 à 4 heures. Chez le père, il n’est plus nécessaire d’interrompre le traitement avant conception. Concernant l’allaitement, les données sont très limitées ; les recommandations actuelles sont de jeter le lait dans les 24 heures suivant l’administration hebdomadaire du méthotrexate.
L’acitrétine est contre-indiquée en cas de grossesse et doit être arrêtée trois ans avant un projet de conception ; sa prescription est donc peu envisageable chez les femmes en âge de procréer.
La ciclosporine est également à proscrire en cas de grossesse car elle entraîne une morbidité foeto-maternelle accrue. Elle peut être poursuivie chez le père.
Les biothérapies sont utilisables au cours de la grossesse, mais la question demeure de savoir quelles classes sont envisageables. Pour cela, il faut prendre en compte l’architecture de la molécule, son passage transplacentaire, sa demi-vie, le terme de la grossesse, ainsi que les données de pharmacovigilance.
À ce jour, les molécules les plus documentées sont le certolizumab et l’étanercept. L’adalimumab et l’infliximab restent possibles, mais doivent être arrêtés au troisième trimestre, comme l’ustékinumab. Pour le sécukinumab, la dernière injection doit être réalisée à 22 semaines d’aménorrhée.
Pour les autres biothérapies récemment mises sur le marché, il n’existe pas encore de données suffisantes pour établir des recommandations.
À noter une contre-indication aux vaccins vivants atténués jusqu’à 6 mois de vie chez l’enfant, si la mère a reçu une biothérapie après 16 semaines de gestation, sauf si le bénéfice de la vaccination est clairement supérieur.
Les biothérapies peuvent être poursuivies pendant la conception chez le père.
Pour le deucravacitinib et l’aprémilast, l’arrêt doit avoir lieu trois jours avant la conception chez l’homme et la femme, et ils ne doivent pas être repris pendant la grossesse chez la femme.
Globalement, les données concernant le traitement du psoriasis pendant la grossesse sont rassurantes ; il est important de déclarer à la pharmacovigilance tout événement survenant durant cette période afin de faire progresser les connaissances.
Concernant la prise en charge du psoriasis chez un patient âgé, il n’existe pas de recommandations spécifiques. Il faut suivre les recommandations générales, adaptées aux comorbidités. Les patients âgés sont trop souvent sous-traités par crainte de la iatrogénie, alors que le psoriasis peut fortement impacter leur autonomie et leur qualité de vie.
Le méthotrexate peut être prescrit, après vérification de la fonction rénale. Il est compatible avec une néoplasie en cours. Du fait de la masse musculaire plus faible et en particulier en cas d’hypoprotidémie, il faudra diminuer la dose.
Concernant les biothérapies, la tolérance est très bonne, identique à celle des patients plus jeunes malgré les comorbidités plus fréquentes.
Avec l’aprémilast, les effets indésirables (céphalées, diarrhées) sont les mêmes que chez les patients plus jeunes, et le traitement n’est pas contre-indiqué en cas de néoplasie.
À noter une immunosénescence chez le patient âgé nécessitant des vaccinations plus rapprochées.
Enfin est abordé le traitement du psoriasis chez les patients ayant des facteurs de risque cardiovasculaire. Il faut savoir que le psoriasis est lui-même un facteur de risque cardiovasculaire : l’inflammation ne se limite pas à la peau, elle est systémique, avec atteinte de l’endothélium vasculaire.
Il faut orienter un patient atteint de psoriasis à risque cardiovasculaire élevé ou très élevé vers le cardiologue ; ce risque doit être évalué notamment par les outils SCORE2 ou PREVENT.
Les molécules contre-indiquées en cas de facteurs de risque cardiovasculaire sont la ciclosporine (majoration de la pression artérielle, détérioration du bilan lipidique et atteinte rénale possible) et l’acitrétine (perturbation du bilan lipidique).
L’aprémilast améliore plutôt les paramètres cardio-métaboliques.
Le deucravacitinib n’augmente pas le risque cardiovasculaire par rapport au placebo, mais davantage de données sont nécessaires.
Pour les anti-TNF alpha, les feux sont au vert : ils diminuent significativement les événements cardiovasculaires.
L’ustékinumab (anti-IL12/23) constitue un cas particulier : il existe un risque d’événement cardiovasculaire important chez les patients à risque élevé lors de l’introduction du traitement, par déstabilisation des plaques d’athérosclérose. En revanche, il n’entraîne pas de sur-risque chez les autres patients.
Les anti-IL17 et les anti-IL23 peuvent être prescrits.
En cas de risque cardiovasculaire élevé ou très élevé, il faut privilégier le méthotrexate ou les anti-TNF alpha en première intention, les anti-IL17 en deuxième intention. Pour le deucravacitinib et les anti-IL23, il n’existe pas de recommandations du GrPso France dans ce contexte.
L’utilisation des anti-IL12/23 est déconseillée, et la ciclosporine ainsi que l’acitrétine ne sont pas recommandées comme traitements de choix chez les patients psoriasiques ayant un risque cardiovasculaire élevé ou très élevé.
Rapport rédigé par Nicolas Kluger (dermatologue, Finlande) à partir de :
Les biothérapies anti-IL-17 actuellement disponibles en France en dermatologie comprennent le sécukinumab et l’ixékizumab, deux anticorps monoclonaux ciblant spécifiquement l’IL-17A ; le brodalumab, qui bloque le récepteur IL-17RA et inhibe ainsi plusieurs isoformes de l’IL-17 ; et le bimékizumab, qui neutralise simultanément l’IL-17A et l’IL-17F, offrant une inhibition plus large de la voie IL-17. Ces traitements sont utilisés dans les formes modérées à sévères du psoriasis nécessitant une prise en charge systémique, après échec ou intolérance des traitements conventionnels et de l’hidradénite suppurée pour le sécukinumab et le bimékizumab.
Des réactions paradoxales cutanées ont été rapportées avec l’ensemble des inhibiteurs de l’IL-17. Les manifestations les plus courantes sont des éruptions psoriasiformes (palmoplantaire ou pustuleuses) ou eczématiformes.
Desjonqueres et al. (poster 245) ont rapporté plusieurs cas de réactions psoriasiformes notamment des plis chez des patients avec une HS traités par bimékizumab. L’histologie était plutôt en faveur d’une réaction eczématiforme et lichénoïde. Corticothérapie locale et méthotrexate étaient proposées et l’arrêt n’était pas nécessaire
Frédeau et al. (poster 231) ont quant à eux rapporté 3 patientes avec une éruption similaires des grands plis sous mammaires, mais aussi axillaires et inguinaux et une histologie là aussi évocatrice d’eczéma et sous différents traitements dans le cadre de psoriasis (secukinumab, bimkizumab et ixékizumab)
Notons que dans la cohorte SECU-Ped qui regroupe des enfants avec un psoriasis modéré à sévère sous anti-IL17 (Communication 022), quelques cas d’eczémas paradoxaux ont été observés sous sécukinumab (5/139, 3.5%) et ixékizumab (2/21, 9%)

PARTIE 1
Rapport rédigé par Nicolas Kluger (dermatologue, Finlande) à partir de :
L’anifrolumab est un anticorps monoclonal utilisé pour traiter le lupus érythémateux systémique modéré à sévère en bloquant le récepteur de l’interféron de type I, une voie suractivée chez les patients lupiques. Il a l’AMM depuis 2022 dans le lupus systémique avec atteinte cutanée active malgré un traitement standard.
L’anifrolumab a une efficacité rapide et comparable selon les sous-types de lupus cutanés : lupus discoïde, subaigu, aigu ou lupus engelures. L’efficacité semble meilleure chez les patients avec une score d’activité CLASI modéré (et non sévère) à l’initiation du traitement. Cependant peu de facteurs prédictifs sont de réponse, hormis le dosage de l’activité interféron ou de la signature interféron (CO95).
Il est administré par voie IV (300 mg toutes les quatre semaines) en hôpital de jour. Ainsi, la question de l’espacement des perfusions se pose chez les patients en rémission. Une étude prospective (encore en cours) visait à évaluer le taux de rechutes lors de l’espacement de dose. Une rechute était notée dans un tiers des cas sur une série de 78 patients avec une durée de médiane de 11,5 mois après le début de l’espacement (22% à 12 mois, avec un espacement à 8 semaines) (CO94).
Le Bellour et al ont rapporté l’efficacité notable de l’anifrolumab dans une petite série de patients avec une panniculite lupique (PL). La PL est une forme de rare de lupus cutané souvent réfractaire aux thérapeutiques classiques (hydroxychloroquine, corticothérapie orale, méthotrexate etc.). Elle peut être isolée ou s’associer à une atteinte systémique ou à d’autres formes comme le LD ou le lupus engelure. L’efficacité du traitement était notable à 6 mois, même si des séquelles cutanées inhérentes à la panniculite sont observables.
Ces résultats sont encourageants dans cette forme de lupus cutané, mais la place de l’anifrolumab reste á préciser.
Les principales infections associées à l’anifrolumab sont surtout des infections respiratoires et des infections virales cutanées, notamment herpes
Dans la série de de La Rochefoucaud, 23% des patients développaient une infection et dans la série de Le Bellour 45% une infection virale mais aussi un sepsis à point de départ urinaire.
Mollet et al ont rapporté le cas d’une femme de 34 ans qui a développé sous anifrolumab et valaciclovir un herpès génital chronique résistant au valaciclovir (P186).
Enfin, les réactions paradoxales à type de psoriasis sous anifrolumab sont possibles. En neutralisant la voie de l’interféron, l'anifrolumab peut perturber une boucle de rétroaction, permettant une hyperactivité Th17 incontrôlée et un environnement inflammatoire permissif pour le psoriasis, chez les personnes présentant une susceptibilité génétique ou épigénétique à l'inflammation Th17 (P236).
PARTIE 2
Rapport rédigé par Nicolas Kluger (dermatologue, Finlande) à partir de :
Sur le plan clinique,
Les papules palmaires sont le plus souvent associées avec la dermatomyosite (DM) à anticorps anti-MDA5, mais ne sont en rien spécifique de cette forme. Pourraient-ils servir de marqueurs pour identifier des patients à risque de pneumopathie interstitielle ? (CO92)
La DM peut être paranéoplasique et s’associer d’autres syndromes paranéoplasiques comme un cas d’hypertrichose lanugineuse acquise de mauvais pronostic (P345)
Sur peau riche en mélanine, la dermatomyosite juvénile (DMJ) se présente avec des symptômes classiques comme l’érythème ou l’œdème des paupières et les papules de Gottron sur le dos des mains. On insistera sur l’aspect poikilodermique hypopigmenté du tronc particulier sur peau sombre et qui peut être déstabilisant au premier abord. Les lésions nécrotiques apparaissent quant à elles achromiques (P126)
Enfin, l’atteinte péri-oculaire/palpébrale lors de la DM ne doit pas être confondue avec l’érythème périorbitaire en lunettes, fixe, indolore, sans œdème décrite par Cordel et al. lors de la maladie de Still (P343)
Sur le plan thérapeutique,
L’hydroxychloroquine (HCQ) est considérée comme efficace sur l’atteinte cutanée de la DM/DMJ seule ou en association. Cependant, il existe peu de données dans la littérature et son efficacité varie largement de >10% à 75%. Une étude rétrospective multicentrique a comparé 57 patients ayant reçu de l’HCQ et 45 n’en ayant pas reçu. Au total, 46% des patients sous HCQ ont obtenu une réponse complète sur le plan cutané contre 75% dans le groupe sans HCQ. En analyse multivariée, seule l’HCQ était associée significativement avec moins de réponse complète. Au total, l’HCQ semble associée à moins de réponse cutanée complète. De études prospectives ou avec un plus grand effectif sont nécessaires pour confirmer ces résultats.
L’anifrolumab serait une option prometteuse dans les formes juvéniles sévères réfractaires aux thérapeutiques classiques (P105).
Rapport rédigé par Nicolas Kluger (dermatologue, Finlande) à partir de
Neildez et al. Lymphomes T cutanés au cours d’un traitement par dupilumab : revue systématique de la littérature. CO116
Le dupilumab est un anticorps monoclonal humain bloquant l’action des cytokines IL‑4 et IL‑13. Il est notamment indiqué pour traiter la dermatite atopique (DA) modérée à sévère, l’asthme sévère, le prurigo nodulaire, l’œsophagite à éosinophiles, etc.
Quelques cas cliniques et séries rétrospectives ont pointé du doigt une possible augmentation de l’incidence des lymphomes cutanés T (LcT) chez des patients avec une DA sous dupilumab.
S’agit-il d’authentiques LcT induits par le dupilumab ou bien des cas démasqués durant des DA ou des LcT diagnostiqués à tort comme des DA ?
Une revue systématique de la littérature réalisée par le GFLEC et le GREAT a inclus 51 études, majoritairement des cas cliniques (33) et 6 cohortes rétrospectives. Au total 547 patients ont été identifiés avec une lymphoprolifération, dont 531 avec un diagnostic de LcT sous dupilumab. L’âge moyen de ce groupe était de 58 ans (47% de femmes), avec une DA dans 95% des cas. Le LcT précédait ou était concomitant du diagnostic de DA respectivement dans 1,7% et 2,9% des cas. On retrouvait des antécédents d’atopie dans 56% des cas. 70% avaient recu un traitement systémique notamment cyclosporine dans 61% des cas et méthotrexate dans 36% des cas.
Les LcT se présentaient dans 75% des cas comme une aggravation de lésions préexistantes, et dans les autres 25% comme l’apparition de nouvelles lésions. Le délai était de 9 mois après initiation du traitement. Dans >70% des cas, il s’agissait de mycosis fongoïdes et dans > 10% un syndrome de Sézary. Rétrospectivement 5 patients avaient en réalité un diagnostic de LcT avant mise sous dupilumab après relecture de lames histologique. Sur le plan clinique, le patiente se présentait avec une érythrodermie (23%) et avec des plaques de mycosis dans 12%. Le dupilumab était interrompu après diagnostic du LcT dans 75% des cas. Pour les patients dont on avait le suivi, 70% des patients étaient en rémission après traitement et 13% étaient décédés. À noter des cas de régressions spontanées après l’arrêt du dupilumab
Sur la base de cette revue, un consensus d’expert a été établi entre les membres du GFELC et du GREAT par méthode DELPHI:
Au total, cette revue de la littérature pointe du doigt un lien avec des patients avec une DA tardive de l’adulte, sans antécédent d’atopie et l’aggravation de lésions préexistantes. En augmentant la biodisponibilité de l’IL13 sous dupilumab, cette cytokine pourrait se fixer sur le récepteur IL13Ralpha2, qui n’est pas bloqué par le dupilumab, mais surexprimé dans certains cancers. : il s’agirait donc plutôt de LcT démasqué ou de LcT non diagnostiqué. Les autres biothérapies anti Th2 dans le DA (tralokinumab, lebrikizumab) ont un mécanisme différent du dupilumab mais le recul est actuellement insuffisant pour écarter un risque.
Rapport rédigé par Nicolas Kluger (dermatologue, Finlande) à partir de
Neildez et al. Risque d’événement cardiovasculaire grave chez des adultes traités par inhibiteurs de JAK pour une dermatite atopique : une étude de cohorte nationale à partir du Système national des données de santé. CO117
Plusieurs inhibiteurs de JAK sont actuellement disponibles dans la dermatite atopique (DA). Cependant, une augmentation du risque d’événements cardio-vasculaires majeures (MACE) observés chez les patients de plus de 50 ans avec au moins un facteur de cardiovasculaire traités par tofacitinib pour polyarthrite rhumatoïde a poussé les autorités de santé à émettre des recommandations quelle que soit l‘indication, DA incluse.
En utilisant le Système National de Données de Santé ont été identifié les patients > 18 ans ayant reçu un JAKi (n=4300) ou une biothérapie (23574) pour une DA entre 2018 et 2024 et chaque cohorte a été comparée à une cohorte population générale.
Il ressort que dans la cohorte de patients DA sous JAKi il n’y a pas d’augmentation de risque de MACE (infarctus, accident vasculaire ischémique) par rapport à la population générale. Ceci peut s’expliquer par une application des recommandations des autorités de santé avec une limitation de l’usage du traitement chez les patients à risque et un bon triage des patients. D’autres études étrangères n’ont pas retrouvé de lien non plus entre MACE et usage de JAKi dans la DA.
Une augmentation de risque de MACE était notée dans le groupe biothérapie avant initiation du traitement et durant la 1ere année d’exposition, ce qui repose la question du rôle de l’inflammation systémique de la DA sévère comme facteur de risque indépendant cardiovasculaire ?
Rapport rédigé par Nicolas Kluger (dermatologue, Finlande)
Intervenante : Pr Marie-Sylvie Doutre (France)
Le Pr Marie-Sylvie Doutre présentait durant la session des Hot topics les nouvelles recommandations françaises de la prise en charge de la dermatite atopique (DA), qui ont été développée et adaptée d’après les recommandations européennes publiée en 2022. Elles sont également publiées en totalité dans le numéro de décembre 2025 des Annales de dermatologie et de vénéreologie FMC




Rapport rédigé par Nicolas Kluger (dermatologue, Finlande)
D’après Dereure O. Autres indications, tolérance et suivi. FMC01 Anti-JAK : les dermatologues aussi !
Les effets secondaires des inhibiteurs de JAK (JAKi) sont fréquents, surtout avec les JAKi de 1ere génération à spectre large type « pan JAK ».
Les complications infectieuses sont les plus fréquentes, notamment avec les anti-JAK à large spectre : infections bactériennes, virales, fongiques. Elles sont cependant bénignes le plus souvent.
Les infections graves comprennent les infections urinaires, digestives (colites), cutanées (surinfection de plaies) et virales notamment herpes et zona d’où l’importance de la mise à jour des vaccinations contre le zona. Les vaccins vivants sont interdits durant le traitement et la mise à jour des vaccins avant traitement est fortement suggéré. Pour une vaccination avec un vaccin vivant sous JAKi, le traitement doit être interrompu 3 mois et repris 1 mois après la vaccination.
Pour minimiser les risques d’effets secondaires graves (maladies cardio-vasculaires, thromboses, cancers et infections graves), le PRAC (Pharmacovigilance Risk Assessment Committee de l’agence européenne du médicament) a émis les recommandations suivantes générales pour les JAKi et pour toutes les pathologies chroniques inflammatoires, et qui s’appliquent également pour la dermatite atopique ou la pelade.
Cependant, rappelons que, à ce jour, les patients avec DA ou pelade ne présentent globalement pas le même profil que celui des patients âgés avec maladie inflammatoire type polyarthrite rhumatoïde. De plus, la littérature est rassurante dans nos populations quant aux risques de morbidité grave liés à l’usage de JAKi. Il faut néanmoins garder en tête ces facteurs de risque pour des patients particuliers (patients fumeurs ; patients sous contraception oestroprogestatif ; patient en obésité etc…). Un article a été publié l’année dernière dans les Annales de dermatologie et de vénéréologie – FMC en 2024 (Staumont Sallé D, et al. Aide à la prescription des inhibiteurs de JAK en dermatologie : évaluation du risque cardiovasculaire et thrombotique veineux et conduite à tenir)
Enfin, sur le plan tumoral, à noter un surrisque de cancers cutanés épidermoïdes principalement de la région tête et cou uniquement sous ruxolitinib et dans des indications hématologiques exclusivement (jusqu’à présent).

Rapport rédigé par Nicolas Kluger (dermatologue, Finlande)
D’après Boccara O. Naevus chez l’enfant. Quand faut-il s’inquiéter ? Forum FO13 Proliférations mélanocytaires de l’enfant
Olivia Boccara a donné un cours rassurant sur les naevus de l’enfant. Il est important de se remémorer que les règles de surveillance telles qu’elles sont appliquées à l’adulte en termes de diagnostic et de suivi des naevus ne s’applique pas à l’enfance. En effet, l’enfance est une période d’apparition physiologique de naevus (naevus acquis) et donc, par définition, en croissance et ce parfois dès la naissance. De plus, il n’y a peu ou pas d’exposition solaire cumulée. L’apparition d’un nouveau naevus n’est pas inquiétant et sa croissance est un phénomène normal ; que ce soit en aspect ou en taille. On rappellera également qu’un traumatisme n’augmente pas le risque de mélanome.
Le taux d’incidence du mélanome chez les 0-14 ans est de 1,74 pour 1 million de personnes/année, soit 60 fois moins que les adultes et enfants de plus de 15 ans selon une étude américaine. Le SSM est quasi inexistant chez les enfants alors qu’il est « le » mélanome de l’adulte. Rare surtout chez les < 10 ans, le mélanome sur naevus est très rare, de même le mélanome sur naevus congénital géant est la aussi peu fréquent. En revanche, un enfant avec plusieurs dizaines de naevus doit faire l’objet de plus d’attention.
Les critères ABCDE ne doivent pas être appliqués chez les enfants.
Chez ces derniers, les mélanomes sont souvent en relief ; non pigmentés. Ils ne sont pas irréguliers et pas très larges. Un acronyme ABCD a été proposé pour les enfants : Amélanotique ; Bombée (Bump : en relief ; bleeding : saignant) ; de Couleur homogène ; De novo, quel que soit le Diamètre. En somme, on s’inquiètera devant un nodule achromique/érythémateux récent qui grossit rapidement. Cependant, même avec ces critères, un naevus de Spitz classique (bénin) peut répondre à ces critères…
Enfin, les mélanonychies longitudinales isolées de l’enfant sont quasi-exclusivement bénignes et un suivi simple suffit avec parfois une régression de la pigmentation.
Rapport rédigé par Nicolas Kluger (dermatologue, Finlande) d’après :
L’hyperplasie épithéliale focale (HFE ou maladie de Heck), est une affection bénigne de la muqueuse buccale causée par une infection HPV, principalement les types 13 et 32. Elle touche surtout les enfants et adolescents, mais peut aussi apparaître chez l’adulte. Rare. En Europe, elle est fréquente en cas d’infection par le VIH ou une transplantation d’organe. Elle se manifeste par de petites lésions multiples, molles, rosées ou blanchâtres, indolores et non ulcérées, situées surtout sur les lèvres, les joues et la langue. La maladie est non cancéreuse et souvent auto-résolutive, disparaissant spontanément en quelques mois ou années. Le diagnostic est généralement clinique, parfois confirmé par biopsie avec PCR HPV pour typage. Le traitement n’est pas toujours nécessaire avec abstention thérapeutique, mais curetage, cryothérapie, imiquimod, ablation par laser CO2 peuvent être proposées pour des raisons fonctionnelles ou esthétiques
La papillomatose confluente et réticulée de Gougerot-Carteaud est une dermatose rare et bénigne touchant surtout les adolescents et jeunes adultes. Elle se manifeste par des plaques brunâtres, verruqueuses, confluentes au centre et réticulées en périphérie, siégeant principalement sur le tronc et le cou. Son origine est mal connue, impliquant des troubles de la kératinisation et parfois une flore bactérienne anormale. Le diagnostic est clinique, avec élimination d’une mycose. Le traitement repose surtout sur les antibiotiques (minocycline) ou les kératolytiques, avec une bonne évolution.
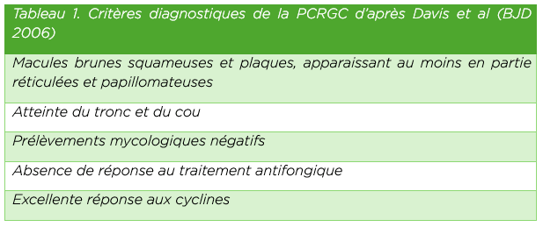
La dermatose faciale discoïde (« facial discoid dermatitis ») est une affection inflammatoire chronique rare touchant principalement le visage décrite pour la première fois en 2010 par Ko et al. (Int J Dermatol 2010). Elle se manifeste par des plaques arrondies ou discoïdes, érythémateuses, roses ou orangées parfois squameuses, bien limitées. Les lésions siègent surtout sur les joues, le front et le menton. Elles peuvent être prurigineuses mais sont souvent peu symptomatiques. Une quarantaine de cas ont été décrit à ce jour. Elle semble toucher plus fréquemment les femmes. L’histologie est peu spécifique : hyperplasie épidermique psoriasiforme, hyperkératose avec parakératose, infiltrat périvasculaire lymphohistiocytique, bouchons folliculaires, spongiose et demodex. L’étiologie reste mal connue. Le diagnostic est clinique, parfois complété par une biopsie. Les diagnostics différentiels incluent le lupus discoïde, le pemphigus superficiel ou la dermatite séborrhéique. Le traitement repose sur les dermocorticoïdes topiques avec ou sans calpotriol et l’acitrétine. L’évolution est généralement chronique, les lésions restent stables pendant des années, la réponse thérapeutique est décevante. La pathologie est toutefois bénigne, sans atteinte systémique. Son individualisation n’est pas claire. S’agit-il d’une vraie entité ou une présentation particulière de psoriasis, de dermatite séborrhéique, de demodecidose ou de psoriasis ?
La panniculite linéaire lupique du scalp est une forme rare de lupus cutané touchant principalement (mais non exclusivement) les jeunes hommes originaires du sud-est asiatique. Elle est asymptomatique et progressive, de distribution linéaire, annulaire, ou arciforme, suivant les lignes de Blashko et pouvant toucher n’importe quelle région du scalp.
Il s’agit d’une alopécie non-cicatricielle avec possible régression et repousse des cheveux, et rarement systémiques. Les anticorps antinucléaires sont positifs dans 50 à 60% des cas. Les traitements comprennent l’hydroxychloroquine, la corticothérapie locale ou orale voire le méthotrexate.
Le prurigo pigmentosa est une dermatose chronique inflammatoire et prurigineuse évoluant par poussée. Elle a été décrite par Nagashima dans les années 70 et cette pathologie est bien connue au Japon et en Corée. Elle affecte plutôt les femmes jeunes (11-30 ans). E
Elle a une distribution particulière proximale, touchant le cou, le tronc, le dos, et les épaules. Les lésions initiales papuleuses deviennent crouteuses et laissent place des macules hyperpigmentées qui vont durer plusieurs mois. La maladie évoluant par poussées, on observe des lésions d’âge différent qui coexistent et une coalescence de certaines donnant un aspect réticulé. Le régime cétogénique, le diabète, l’anorexie mental, mais aussi le frottement ou le stress sont des facteurs déclenchant de la maladie. Le traitement repose sur une antibiothérapie par cycline, macrolides) ou par dapsone.
La plasmocytose cutanée est une maladie chronique « hématologique » touchant plus fréquemment les individus originaires d’Asie du Sud-Est. Elle se présente sous la forme de macules ou de papules peu spécifiques, hyperpigmentées, asymptomatiques, d’évolution chronique, principalement sur le tronc. La biopsie cutanée montre un infiltrat périvasculaire de plasmocytes matures du derme et de l’hypoderme. Sur le plan biologique existe un syndrome inflammatoire avec Hypergammaglobulinémie (plus polyclonale que monoclonale). L’atteinte d’une deuxième organe interne avec infiltrat de plasmocytes matures, bien différenciés et sans atypie fait classer la maladie en plasmocytose « systémique ». Il faut bien évidemment éliminer les causes de plasmocytoses cutanées « classiques » comme la syphilis ou la borréliose. De plus, on s’acharnera à éliminer un lymphome. La plasmocytose peut s’associer avec une maladie de Castleman, un maladie à IgG4, un lymphome… Divers traitements peuvent être proposés : corticothérapie orale, thalidomide; PUVA… Il s’agit d’une maladie plutôt de suivi universitaire…
Le syndrome EPPER (Eosinophilic Polymorphic and Pruritic Eruption associated with Radiotherapy) est une complication cutanée rare liée à la radiothérapie. Il se manifeste par une éruption polymorphe prurigineuse des quatre membres et épargnant la tête et débutant au site de radiothérapie et faites de papules, plaques ou vésicules. On observe fréquemment une éosinophilie sanguine associée. L’histologie montre un infiltrat périvasculaire eosinophilique dans le derme. Le mécanisme exact est mal compris, mais une réaction immuno-allergique induite par l’irradiation est suspectée. Le syndrome apparaît généralement pendant ou après la radiothérapie. Elle peut parfois être retardée de plusieurs mois. Le traitement repose sur les corticoïdes topiques ou systémiques et les antihistaminiques. L’évolution est le plus souvent favorable après prise en charge, mais il peut être spontanément résolutif.
L’exposition accidentelle au mercure est encore possible en France, comme l’illustre le cas d’un commissaire-priseur qui a développé un exanthème pustuleux de type PEAG avec atteinte pulmonaire et syndrome inflammatoire. L’exposition au mercure est probablement professionnelle via la manipulation d’antiquités.
Rapport rédigé par Nicolas Kluger (dermatologue, Finlande) d’après
Tristan A. Quand Staphylococcus Aureus s’attaque à la peau. Le staphylocoque doré dans tous ses états FMC047
Le Dr Anne Tristan du CNR des staphylocoques a rappelé l’épidémiologie, la bactériologie et les différentes présentations associées aux toxines du Staphylocoque doré
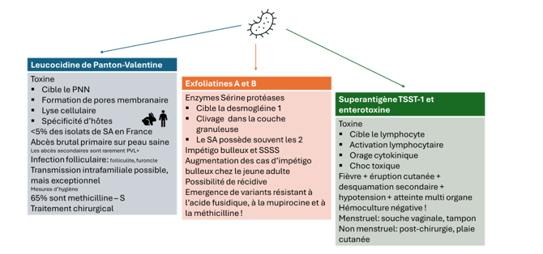
Figure 1. Les présentations cliniques toxiniques à Staphylocoque doré